基于前列腺全器官大组织切片评价弥散加权成像技术对病灶范围检测的准确性
2021-07-01郭程浩丁雪飞朱良勇
郭程浩,肖 芹,陈 骥,丁雪飞,朱良勇,栾 阳,高 鹰
(扬州大学附属苏北人民医院:1.泌尿外科;2.泌尿生殖肿瘤MDT中心;3.病理科;4.影像科;5.妇产科,江苏扬州 225001;6.大连医科大学研究生院,辽宁大连 116044)
前列腺癌是一种严重危害男性健康的疾病。美国癌症研究所最新资料预测显示,2019年将诊断出1 762 450例新的肿瘤病例,其中前列腺癌174 650例,占9.91%,发病率居男性恶性肿瘤首位[1]。在我国,由于人口老龄化、生活方式及饮食习惯的不断改变,前列腺癌发病率逐年增加,其发病率已上升至男性恶性肿瘤的第6位,严重威胁老年男性的健康[2]。磁共振成像(magnetic resonance imaging,MRI)作为前列腺癌重要的辅助检查,对前列腺癌的诊断及治疗具有重要的意义[3]。弥散加权成像(diffusion wei-ghted imaging,DWI)作为MRI的重要组成部分,近年来也获得了广泛的关注。然而,MRI在检测前列腺癌病灶范围上的准确性并不能完全令人满意[4-5]。本研究旨在通过对比患者术前MRI与前列腺癌根治术后全器官大组织病理结果,评价DWI在检测前列腺癌病灶范围上的准确性及影响因素,以此为前列腺癌的临床诊疗及科研工作提供更多有价值的信息。
1 资料与方法
1.1 研究资料收集2018年3月至2019年8月于扬州大学附属苏北人民医院行前列腺穿刺被证实为前列腺癌、并行腹腔镜下前列腺癌根治术、术后标本制备前列腺全器官大组织切片的40例患者纳入研究。40例患者的平均年龄(70.32±4.83)岁;穿刺前平均PSA水平(22.92±24.25)μg/L;平均前列腺体积(47.68±20.10)mL;穿刺Gleason评分:6分者7例(17.5%),7分者17例(42.5%),8分者10例(25.0%),9分者6例(15.0%)。
1.1.1纳入标准 ①患者具有完整的临床资料;②术前均于苏北人民医院行3.0 T多参数MRI检查;③术后用离体前列腺标本制备前列腺全器官大组织切片。
1.1.2排除标准 ①临床资料不完整;②既往有前列腺手术史;③既往有慢性前列腺炎病史;④既往有前列腺放射或化学治疗史。
1.2 检查方法所有纳入研究的患者均于穿刺前行MRI检查,使用美国GE公司Discovery MR750 3.0 T磁共振仪。扫描范围包括全部前列腺和两侧精囊腺。其中涉及本研究的成像主要包括:T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)、多b值弥散加权成像(DWI1000,DWI2000)、表观弥散系数(apparent diffusion coefficient,ADC)等。
1.3 前列腺全器官大组织切片制作流程首先将离体标本完整固定于体积分数为5%的甲醛溶液24~48 h,而后用染料标记标本左右(图1A)。切取左右精囊腺、左右输精管、前列腺尖部2 mm及基底部2 mm组织行常规病理检查。而后沿垂直于尿道的方向将前列腺均匀切成3 mm薄层(图1B),沿尖部至基底部方向依次标记1、2、3……,拍照留存,避免标本混淆。薄层组织继续甲醛固定24 h后常规脱水、浸蜡,并用专门针对大体积组织的方盒模具(图1C)进行包埋,待冷却后逐层切片,行HE染色。最后用数字切片扫描设备(NanoZoomer 2.0-RS)扫描切片,而后由2位经验丰富的病理科医师标记病灶位置并测量肿瘤最大径(maximum tumour diameter,MTD)(图1D),测量精度可达0.1 mm。

A:染色标记左右;B:均匀切成3 mm薄层;C:方盒模具D:数字扫描设备。图1 前列腺全器官大组织切片的制作及扫描示意图
1.4 组织收缩校正因子的计算考虑到前列腺全器官大组织切片制作过程中前列腺体积会因为脱水、浸蜡等流程发生变化[6],本研究通过测量10例患者离体前列腺处理前后体积变化计算组织收缩校正因子。
1.4.1计算步骤 前列腺标本离体后,将前列腺标本用保鲜膜包裹后浸入装有生理盐水的量杯中,通过测量液面变化计算离体后前列腺体积,测量完毕后将离体标本行固定、切片、上机脱水等步骤(具体流程见大组织切片制作流程)。将上机成功后的标本按同理予保鲜膜包裹,计算脱水、浸蜡后前列腺体积,并计算组织收缩校正因子。
1.4.2测量结果 10例患者组织收缩平均值为1.25(表1),故本研究暂以1.25为前列腺全器官大组织切片的组织收缩校正因子。
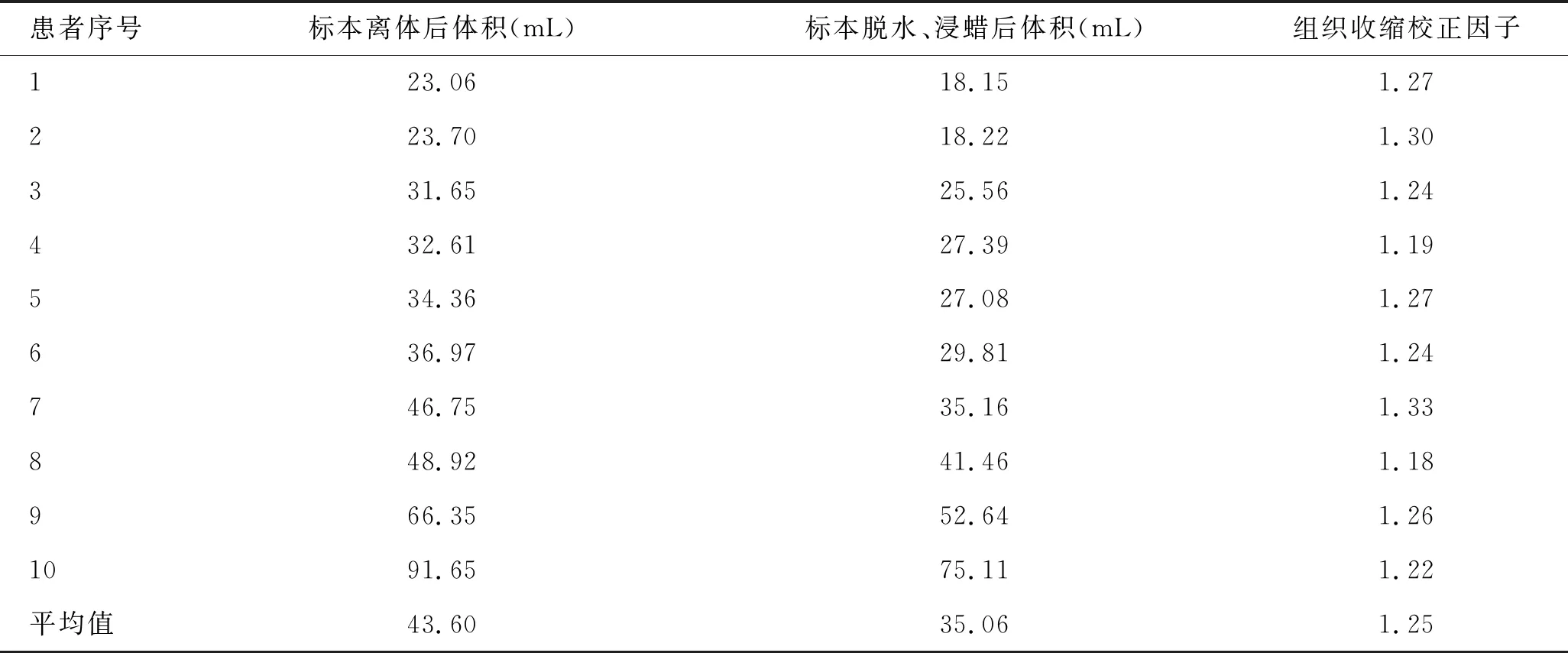
表1 组织收缩校正因子的计算
1.5 测量结果对比术前由2位阅片者对所有患者的MRI进行阅片,依据前列腺影像报告和数据系统(prostate imaging reporting and data system,PI-RADS,version 2)对其行评分,并将所有评分为3、4、5分的可疑区域进行登记。将术后离体前列腺标本制成前列腺全器官大组织切片,由2名经验丰富的病理科医师在大组织切片上确定“主要肿瘤”并给出Gleason评分和测量MTD。将病理阅片结果与术前MRI阅片结果进行对比,若“主要肿瘤”在MRI下可见且在术前已被登记,则认为“主要肿瘤”可被MRI检测到,反之则被认定为MRI下不可见前列腺癌。在DWI 2000上测量那些可被MRI检测到的“主要肿瘤”的MTD(注意测量方向与病理切片测量方向相一致)。最后将大组织切片下测得的MTD乘以缩水校正系数后与DWI的影像测量结果进行对比。
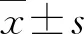
2 结 果
2.1 一般情况前列腺全器官大组织切片与MRI相对比,40例患者中共有31例经组织学证实且被MRI检测到的“主要肿瘤”病灶,9例患者因前列腺穿刺证实为前列腺癌,但MRI下无明显可疑信号或病理阅片结果与术前MRI阅片结果不匹配而被排除,其肿瘤MTD普遍小于0.5 cm。MRI对主要肿瘤检出的敏感性为77.5%(31/40)。
2.2 MTD对比31例患者的主要肿瘤在DWI下的MTD平均值为(18.79±9.63)mm,大切片下测得与DWI下对应区域的肿瘤MTD乘以1.25(组织收缩校正因子)后的平均值为(21.79±9.86)mm,两组间差异平均值为(3.00±2.23)mm,低估程度平均值为(15.12±9.82)%。采用配对样本t检验结果显示两组数据之间差异有统计学意义(t=7.72,P<0.001)。见图2。
2.3 有序多分类Logistic回归分析对“主要肿瘤”可被检测到的31例患者的临床资料行有序多分类Logistic回归分析[其中平行线检验结果(10.928,P=0.142)提示,各回归模型系数一致,可以进行该回归分析]。拟合优度检验结果示:皮尔逊卡方检验表明模型具有统计学意义(P=0.344)。回归分析结果提示,Gleason评分分级对检出病灶的低估程度差异有统计学意义(OR=-3.626,P<0.05)(表2),DWI在检测Gleason评分病灶时会产生更大的低估。
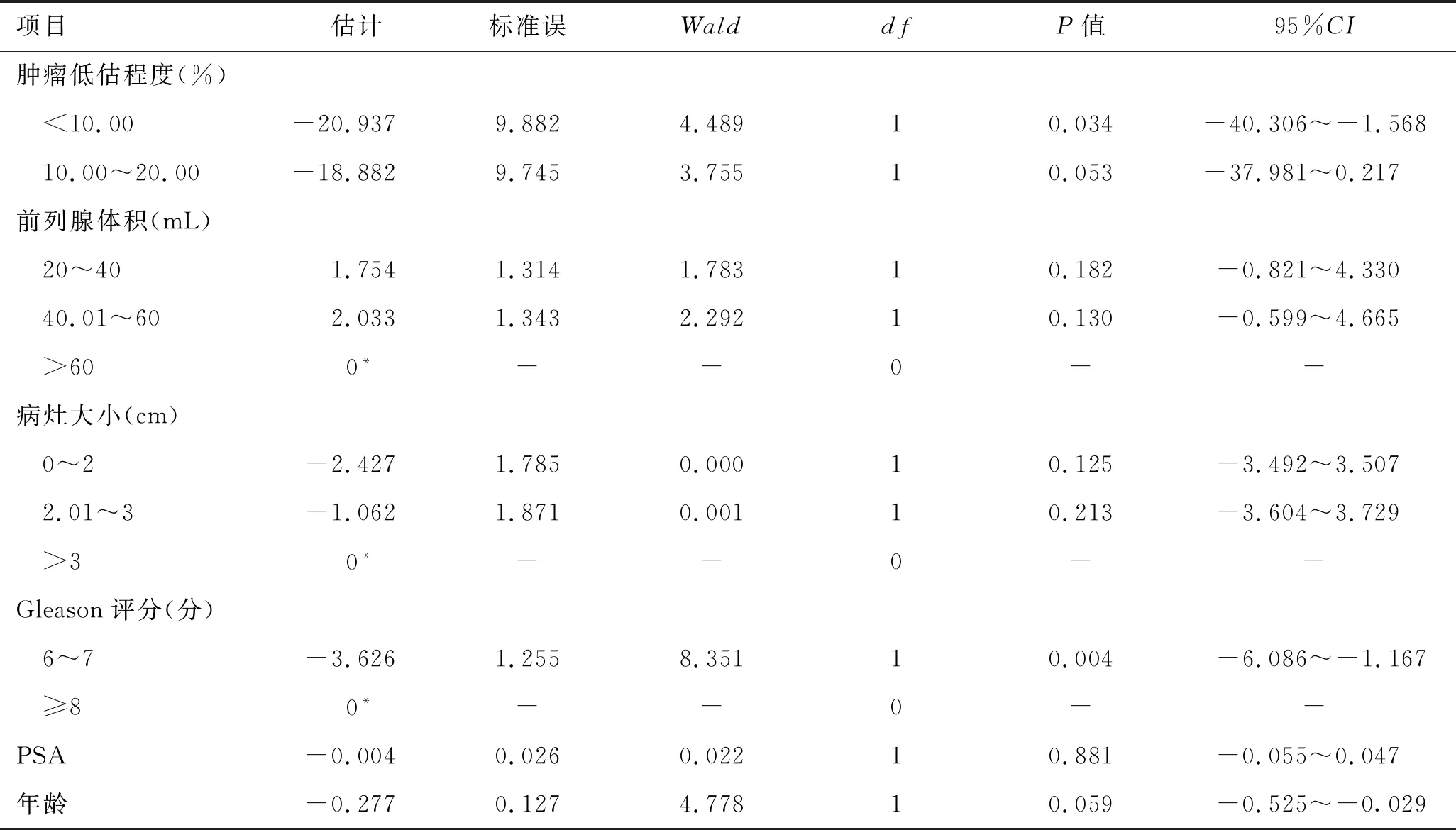
表2 有序多分类Logistic回归分析结果
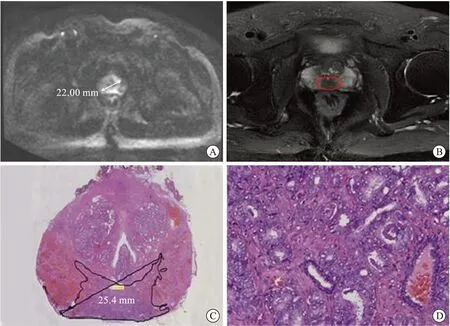
A:病灶DWI下测量MTD;B:病灶T2影像;C:病灶大组织切片结果下MTD测量;D:病灶局部示意图。图2 病灶影像学结果与前列腺全器官大组织切片结果对比示意图
3 讨 论
MRI作为前列腺癌诊断及癌灶定位的重要辅助工具之一,在前列腺癌的诊断、治疗中意义重大[3,7-8]。虽然在各个研究中均表明MRI对前列腺癌具有较好的检出及定位效果,但在一些研究中也指出MRI会大大低估前列腺癌的病灶大小[4,9]。而DWI作为MRI的重要组成部分,其信号反映了水分子的限制性扩散,并且具有快速、无创的特性,近年来受到了广泛关注,特别是高b值DWI,更是在一些研究中被认为可以提高图像质量及肿瘤检出率[10]。本研究旨在以前列腺全器官大组织切片的病理结果为金标准,评价DWI在检测前列腺癌“主要肿瘤”病灶范围上的准确性并研究其影响因素。
所谓前列腺癌的“主要肿瘤”,通常指前列腺肿瘤中组织学分级最高、最有临床意义的肿瘤[11],而肿瘤大小则被认为是生化衰竭和前列腺癌进展的重要决定因素[12]。虽然目前对前列腺癌治疗范围是否只应局限于“主要肿瘤”仍未有统一的观点,但这一概念的提出,仍为前列腺癌的局部治疗提供了一定的理论支持[13-14]。虽然通过结合MRI进行靶向穿刺可以有效地提高前列腺癌的检出率[7],并对局部治疗的患者选择提供一定的指导意见。但BONEKAMP等[15]的研究表明,由于MRI在检测前列腺癌病灶时对其存在明显的低估,即使在MRI检测结果的基础上向外延伸10 mm作为局部治疗的安全边界,仍有18%的病灶不能被有效覆盖。同样关于确定安全边界以达到对前列腺癌病灶的充分治疗也在LE等[16]的研究中被提及。
既往许多研究中大多通过各种复杂计算方法计算MRI(T2/DWI/ADC)下及病理切片下肿瘤体积并进行对比研究[4,9],但操作的复杂性及肿瘤的不规则生长通常会加大计算的难度并影响研究结果的准确性。而ENGELHARD等[17]的研究表明,MRI下“主要肿瘤”MTD是判断肿瘤体积的良好预测指标,故本研究主要通过对比DWI成像下“主要肿瘤”MTD及前列腺全器官大组织切片下的“主要肿瘤”MTD(经校正后)的结果来评估DWI检测主要肿瘤病灶范围的准确性;通过对比两者的MTD,即选取同一肿瘤病灶在两者中的最大横径进行对比,可有效避免MRI截面与离体前列腺标本截面难以一一对应的问题。由于前列腺全器官大切片制作过程中需要脱水、固定,故在扫描设备上所测得的前列腺癌病灶的MTD并不准确,需经过组织收缩校正因子校正。且由于各中心前列腺全器官大切片的制作过程不尽相同,故在各研究中关于组织收缩校正因子并不一致,其范围约在1.12~1.33不等[18-20],而本研究暂以1.25(通过10例标本测量所得)为组织收缩校正因子对前列腺全器官大组织切片下所测得主要肿瘤MTD进行校正。
本研究结果表明:DWI在检测前列腺癌主要肿瘤时对病灶大小存在明显的低估,低估程度平均值为(15.12±9.82)%,这一结果表明DWI在检测前列腺癌病灶范围上存在局限性;而通过多因素分析,我们发现前列腺癌主要肿瘤分级是检测病灶时产生低估的重要预测因子。在研究中,我们通过对前列腺癌病灶边缘进行仔细观察,发现前列腺癌的病灶边缘多由良性腺体及恶性的肿瘤组织混杂而成。这一现象也在ROSENKRANTZ等[21]的研究中被提及,认为是这些混杂密度区域在MRI成像下的不可见导致其对肿瘤实际大小的低估,而混杂密度区域的大小可能大多与前列腺癌病灶的恶性程度及侵袭性有关,即病灶等级越高,其侵袭性越高,而低估程度更高。这在LE等[9]的研究中也有所提及,在这里不多做介绍。
总体来说,虽然DWI在检测病灶范围的准确性上有所不足,但作为前列腺癌重要的辅助检查,其对于前列腺癌的诊断、活检及局部治疗仍具有重要的指导作用[15,22]。本研究主要对DWI在检测前列腺主要肿瘤范围时的准确性进行了研究,发现DWI在检测前列腺癌主要肿瘤病灶时会对其病灶范围产生明显的低估,这对局部治疗安全边界的确定具有一定的指导意义。与此同时,这也为我们下一步的研究指明了方向,可以在磁共振(T2/DWI/ADC)确定病灶初步范围的基础上,通过引入模板引导经会阴的前列腺投影穿刺活检(transperineal template-guided mapping biopsy,TTMB)等方法,利用TTMB对前列腺癌诊断更加精准的特性[21,23],对前列腺癌病灶范围进行更为精细、准确的定位,以确定肿瘤边界及局部治疗的安全范围,避免过度治疗及治疗不足等情况的发生。
本研究的局限性主要包括:①入组研究的人数较少,主要与大切片制作过程较为复杂且对切片质量要求较高有关。②由于前列腺在人体内存在角度,故MRI的扫描方向与大切片的扫描方向存在差异,这会对测量结果产生一定的影响。③磁共振由2位专业的阅片者在“盲法”的情况下进行阅片,依据PI-RADS(version 2)为标准进行评分,考虑到评分的主观性及阅片者的个人习惯,可能会对研究结果产生影响。
综上所述,我们认为,DWI在检测前列腺癌主要肿瘤范围时通常会对病灶的实际范围产生一定程度的低估,且前列腺癌主要肿瘤分级是检测病灶时产生低估的重要预测因子,即在检测高Gleason评分病灶时会产生更大的低估。本研究的样本量有限,希望其他研究中心能提供更多的样本进行进一步地评估。
