多模态影像组学预测肿块型乳腺癌术前淋巴结转移的价值
2021-07-01王祥芝张书海汤晓敏谢宗玉
王祥芝,张书海,徐 敏,汤晓敏,刘 浩,谢宗玉
乳腺癌现已成为女性最常见的恶性肿瘤,且发病率在逐年上升,严重威胁到女性生命健康[1]。淋巴结转移是乳腺癌常见的转移途径,腋窝淋巴结是最常见的转移位置[2],术前准确评估腋窝淋巴结状态对于乳腺癌的分期、术式的选择、预后的判断及放化疗的制定均具有重要的意义。钼靶和MRI是术前乳腺癌分期及淋巴结转移与否的主要影像学评估手段,然而仅根据淋巴结的大小及形态肉眼很难准确评估。影像组学可以深度挖掘影像信息,高通量地提取大量影像特征,实现病灶的分割、特征提取与模型建立,对疾病做出分析和预测,从而辅助医生做出最准确的诊断[3-4]。本研究探讨基于钼靶、MRI的多模态影像组学在肿块型乳腺癌术前淋巴结转移预测方面的价值。
1 资料与方法
1.1 一般资料 收集2018年11月至2020年5月就诊于我院同时行钼靶和MRI 2种检查的病人,入组标准:(1)所有病人检查前均未经放化疗或手术;(2)所有病人有病理结果(明确分期和淋巴结转移情况);(3)所有病人2种影像资料完整且图像质量符合要求。排除标准:(1)非肿块型乳腺癌(n=5);(2)图像质量欠佳(n=3);(3)病灶过小,无法勾画感兴趣区(n=2)。最终纳入111例符合要求的病人(共114个病灶);均为女性,年龄27~68岁;48例淋巴结阳性(LN+),63例淋巴结阴性(LN-)。
1.2 仪器与方法
1.2.1 钼靶检查 钼靶采用德国Siemens Mammomat Inspiration乳腺X线机,行双体位自动曝光装置投照:头尾位(craniocaudal,CC)和内外斜位(mediolateral oblique,MLO)。
1.2.2 MRI检查 采用荷兰Philips Achieva 3.0T双梯度超导磁共振仪,线圈为SENSE7通道矩阵线圈,常规行横断位T1WI(TR 400 ms,TE 10 ms)和抑脂T2WI(TR 5 000 ms,TE 60 ms),MRI动态增强扫描(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI),造影剂为钆喷酸葡胺,剂量0.2 mmol/kg,速率2.0 mL/s,注射对比剂后连续扫描6期,每期60 s。
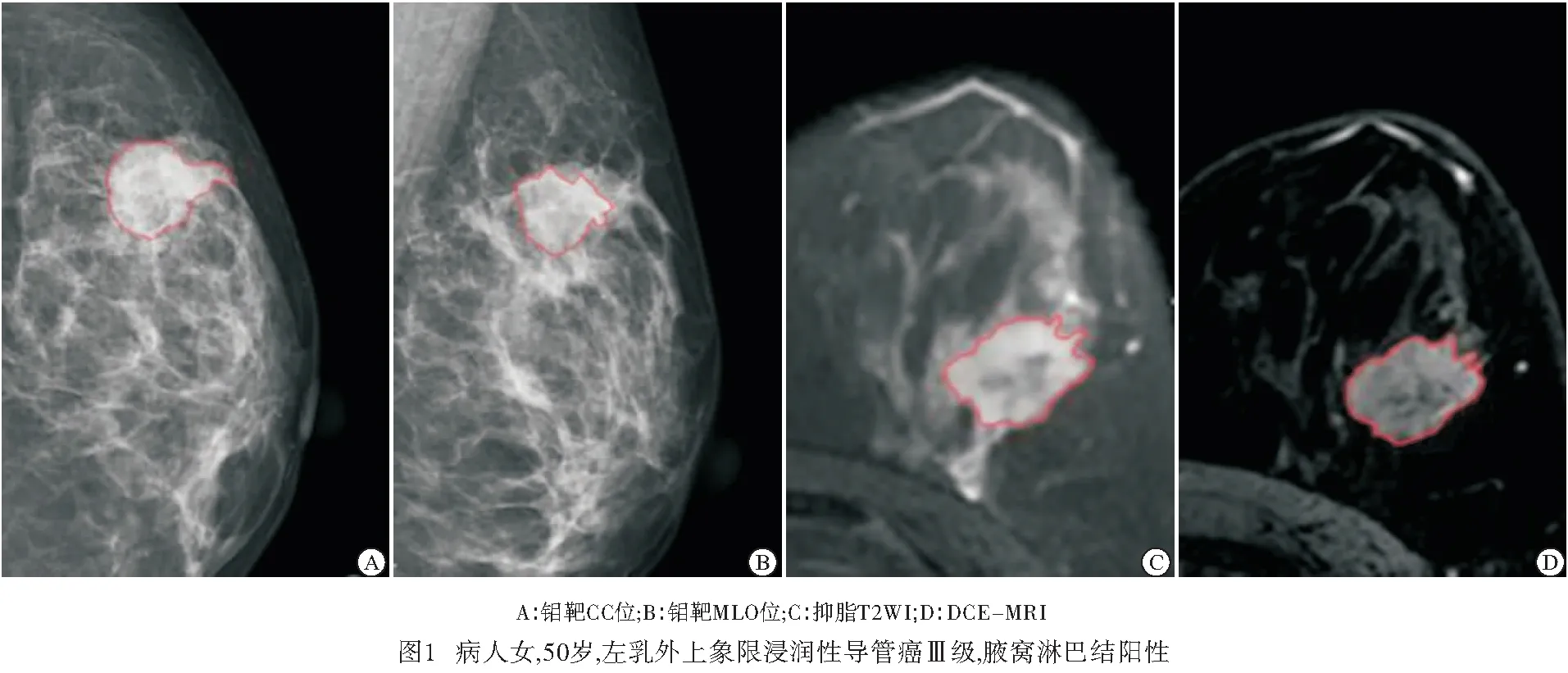
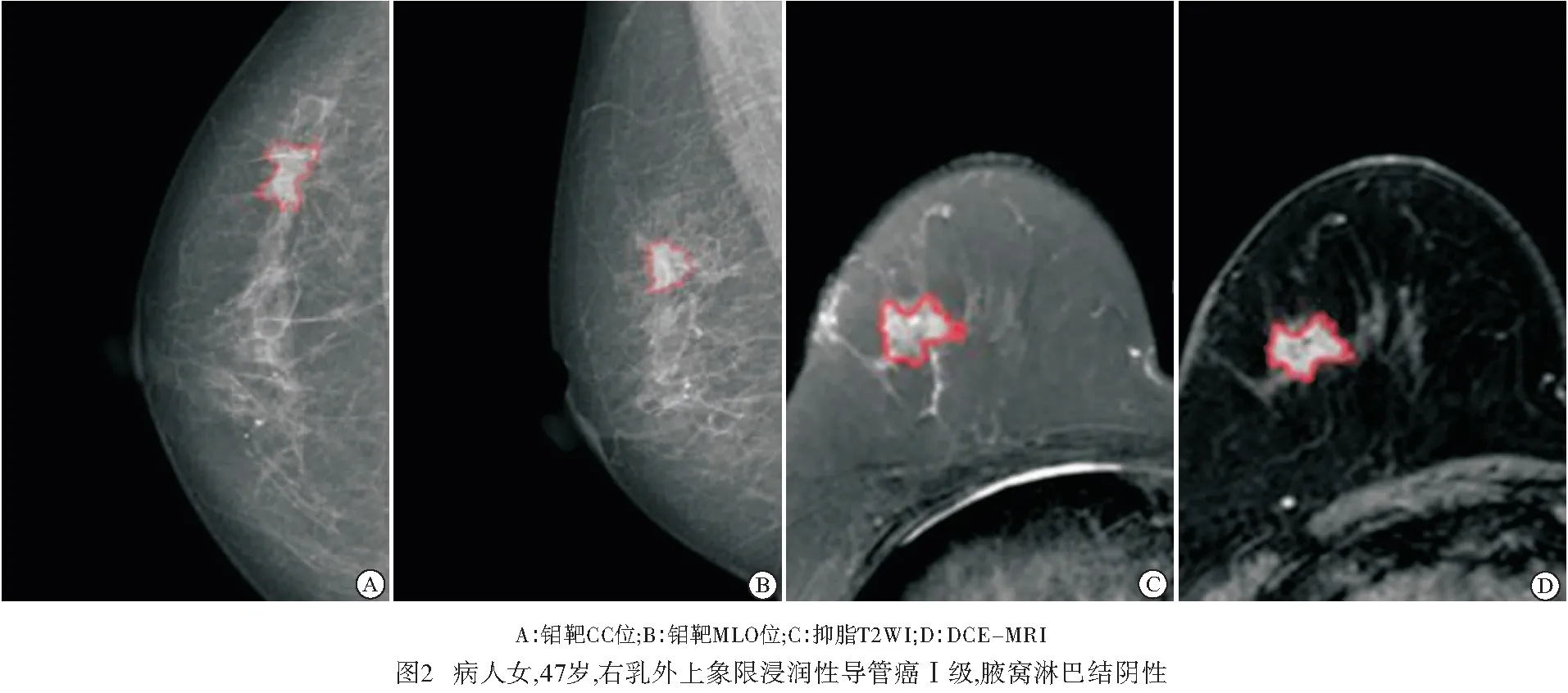
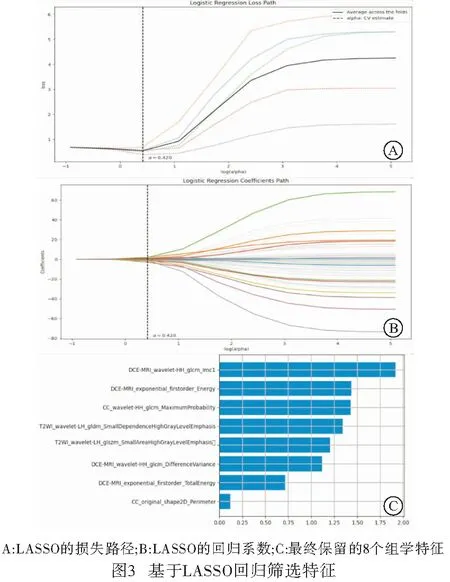
1.3 图像分割与特征提取 将所有病人的图像(CC、MLO、T2WI、DCE-MRI)导入医准-达尔文科研平台(http://www.yizhun-ai.com),CC、MLO及T2WI选取病灶最大径进行勾画,DCE-MRI选取第二期进行勾画(见图1~2)。每一个序列均提取出939个特征,包括一阶统计特征、形态特征、纹理特征及小波特征,共3 756个组学特征。
1.4 特征选择、模型建构与评估 提取出的组学特征采取最小最大值归一化法把每一维度特征线性拉伸到(0,1)之间。为了去除大量冗余特征,保留稳定性及可重复性高的特征,我们选择Select K Best筛选特征。该方法是利用方差分析首先筛选出前50个特征,然后利用最小绝对收缩与选择算子(LASSO)回归进一步筛选特征,保留相关度最高的特征。对筛选出的特征分别采用logistic回归、随机森林及支持向量机(support-vector machine,SVM)3种模型建立钼靶、MRI、钼靶联合MRI多模态影像组学模型,采用受试者工作特征曲线下面积(AUC)评价训练组与验证组模型的预测效能。
1.5 统计学方法 采用t检验和χ2检验。
2 结果
2.1 各组临床资料比较 LN+组的病灶长径明显大于LN-组(P<0.01),2组在年龄、绝经状态、病理分级方面差异均无统计学意义(P>0.05)(见表1);训练组与验证组所有临床资料间差异均无统计学意义(P>0.05)(见表2)。
表1 LN+组与LN-组临床资料比较
表2 训练组与验证组临床资料比较
2.2 预测模型特征筛选与模型评价 应用最小最大值归一化、Select K Best及LASSO回归筛选后,最终保留8个组学特征(见图3)。运用logistic回归、随机森林及SVM建立钼靶、MRI、钼靶联合MRI的多模态影像组学模型后,发现SVM性能最佳、最稳定。SVM建立的训练组钼靶、MRI、钼靶联合MRI的多模态影像组学模型预测淋巴结转移的AUC值分别为:0.76、0.82、0.89;验证组相应的AUC值为:0.74、0.81、0.88(见图4)。钼靶联合MRI的多模态影像组学模型表现出最佳诊断效能。
3 讨论
术前准确预测乳腺癌病人的淋巴结状态对病人手术计划的实施、辅助治疗和预后至关重要。最初通过腋窝淋巴结清扫判断乳腺癌病人是否存在淋巴结转移,这容易造成病人上肢肿胀、疼痛及无力,给淋巴结转移阴性的病人增加不必要的负担[5]。前哨淋巴结活检可以较准确地判断淋巴结状态,但是也存在一定假阴性[6-7],有时活检的前哨淋巴结是唯一的转移淋巴结。因此,在乳腺癌病人术前找到一种可以准确评估淋巴结状态的方法是至关重要的。相关文献单纯基于原发肿瘤的临床病理特征建立预测淋巴结转移的模型[8-9],例如:年龄、病灶大小、病灶组织学类型、激素受体等,效能欠佳。本研究发现LN+组病灶大小大于LN-组,表明原发肿瘤的大小与腋窝淋巴结存在一定相关性,与前者[10]研究一致。影像组学是一个相对较新的技术,它能够捕获肿瘤微环境的异质性和复杂性,挖掘出视觉无法识别的潜在数据[11]。例如本研究保留的8个最优组学特征中,一阶特征(firstorder)代表图像体素强度的分布情况,其中能量、总能量特征在鉴别淋巴结转移方面代表性强;灰度共生矩阵(glcm)、灰度相关矩阵(gldm)和灰度区域大小矩阵(glszm)均属于纹理特征,而纹理特征主要描述图像灰度的相关空间特性或体素强度的空间分布,从而提供图像中不同灰度级的相对位置信息;目前glcm应用最为广泛,主要描述图像灰度值的空间依赖性[12-13]。以上组学特征都是人类无法感知的,但很容易被影像组学识别,并且能够反映肿瘤的生物学行为。
影像组学在直肠癌、胃癌、乳腺癌等疾病的诊断及判断淋巴结转移方面具有可行性[14-16]。谭红娜等[17]采用LASSO回归建立基于钼靶双体位的组学预测淋巴结转移模型,在训练组及验证组下的AUC分别为0.757、0.740,效能中等。然而YANG等[18]采用SVM建立的钼靶影像组学预测淋巴结转移模型,在训练组和验证组中AUC分别为0.895、0.875,效能较好,原因可能是分类器的差异或该模型结合临床病理和超声淋巴结状态的特征。相关文章基于DCE-MRI预测乳腺癌前哨淋巴结转移的训练组AUC介于0.81~0.87,验证组AUC介于0.76~0.83[19-21]。单嫣娜等[22]基于DCE-MRI分割可疑淋巴结的影像组学预测模型获得优异的效能,在训练组及验证组中AUC分别为0.953、0.944,但是此方法需要超声引导下穿刺相应可疑淋巴结,过程较繁琐,而且本研究纳入的部分钼靶图像无法显示淋巴结,因此没采用此方法。本研究与此前仅基于单一影像学方法建立的预测模型不同,是基于钼靶联合MRI的多模态影像组学方法。MRI可以提供高时间、高空间分辨率和高信噪比的图像,其中DCE-MRI又可以反映病灶血流动力学;虽然钼靶为二维重叠图像,提取的肿瘤组学特征中可能包括正常腺体组织,但是钼靶对诊断乳腺癌特异性的微钙化[23]却能够清晰显示其分布、密度、形态,在这一方面是其他检查无法代替的。所以本研究联合钼靶和MRI,综合肿瘤细胞结构、内部密度、血供情况等各个方面,全面提取每种影像方法的组学特征,以期准确预测淋巴结状态。最终采用SVM建立的联合模型在训练组与验证组的AUC值分别为0.89、0.88,效能优异,这表明联合影像组学模型可以较准确地预测腋窝淋巴结状态,给予临床提供一种潜在的非侵入性预测方法,并且指导乳腺癌的治疗。
本研究尚存在些许的不足:(1)因为非肿块样强化的病变难以准确勾画,所以本研究仅纳入肿块型病变,可能存在数据偏倚。(2)为使数据具有可比性,MRI提取的是类似钼靶的二维图像,可能会造成MRI三维图像空间信息的缺失。(3)所纳入总样本量较小,且数据局限,缺少对结果的可重复性和泛化性的评价,需要多中心大数据的支持与研究。
综上所述,基于钼靶联合MRI的多模态影像组学模型是一种无创的可以预测肿块型乳腺癌病人腋窝淋巴结状态的新方法,指导临床制定针对肿块型乳腺癌病人的最佳治疗方案,向精准医疗迈进。
