叶酸缺乏对L02细胞增殖、凋亡及纺锤体组装检查点相关蛋白表达的影响
2021-07-01任欢欢徐洪宝王忠迈王春景廖亚平
任欢欢,杨 瑜,徐洪宝,王忠迈,程 宗,梁 猛,王春景,廖亚平
纺锤体组装检查点(spindle assembly checkpoint,SAC)是细胞周期调控中的众多检查点之一,有助于维持细胞有丝分裂期间基因组稳定性,SAC结构功能异常是导致染色体不稳定性与非整倍体的重要原因之一,Mad2、Bub1、BubR1是SAC中的关键组分。
叶酸是一碳代谢循环中重要的甲基供体,在DNA合成、稳定性及修复中起关键作用。其缺乏会导致DNA损伤、染色体和基因组不稳定等。叶酸缺乏会对损坏SAC网络,从而致使细胞发生有丝分裂异常与非整倍性[1],但是非整倍体发生的机制尚不明确且叶酸缺乏对SAC影响的报道较少。本研究通过探索不同浓度叶酸对L02细胞增殖、凋亡及Mad2、Bub1、BubR1 mRNA及蛋白水平的影响,并讨论可能的作用机制。
1 材料与方法
1.1 细胞及试剂 L02细胞(武汉普诺赛细胞库);无叶酸RPMI-1640培养基、胎牛血清(Gibco公司);叶酸粉末(Sigma公司);Annexin V-FITC/PI试剂盒、细胞周期试剂盒、BCA蛋白定量试剂盒、RIPA裂解液、PMSF(江苏碧云天生物有限公司);Mad2、Bub1、BubR1抗体(美国Bethyl公司);β-actin抗体(Cell Signaling Technology 公司);辣根过氧化物酶标记的山羊抗兔IgG抗体、辣根过氧化物酶标记的山羊抗鼠IgG抗体(武汉博士德生物工程有限公司);荧光定量PCR试剂盒(Takara公司);Mad2、Bub1、BubR1引物(上海生工生物有限公司)。
1.2 方法
1.2.1 细胞分组及处理 将L02细胞培养于含5%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO2的细胞培养箱中。将细胞分为正常对照组和不同浓度叶酸组(分别给予200 nmol/L、20 nmol/L和0 nmol/L叶酸处理2周)。
1.2.2 倒置显微镜下观察细胞形态 倒置显微镜下观察不同浓度叶酸培养2周后的L02细胞形态。
1.2.3 CCK8法检测细胞活性 将培养第12天的L02细胞按3.0×103个/孔接种于96孔板,各组3孔,过夜贴壁后,每孔加入10 μL CCK8试剂后置于培养箱中培养2 h,并于450 mm处检测吸光度(OD)值。
1.2.4 细胞周期试剂盒检测细胞周期 将培养2周的L02细胞以5×105个/mL接种于6孔板中,收集细胞;按照说明书进行PI染色,流式细胞仪上机检测。
1.2.5 Annexin V-FITC/PI试剂盒检测细胞凋亡 将培养2周的L02细胞以5×105个/mL接种于6孔板中,收集细胞;按照说明书进行Annexin V-FITC/PI进行染色,流式细胞仪上机检测。
1.2.6 qRT-PCR检测Mad2、Bub1、BubR1 mRNA的表达量 收集各组细胞,TRIzol法提取细胞总RNA,按照Takara的反转录试剂盒合成cDNA,PCR扩增Mad2、Bub1、BubR1。根据GenBank上公布的人类Mad2、Bub1、BubR1序列,应用Primer Primer5软件设计引物,由上海生工生物工程公司合成(见表1)。同一标本β-actin作为内参照,采用2-△△CT法进行相对定量分析。qRT-PCR的反应条件:95 ℃ 15 s,60 ℃ 34 s,72 ℃ 30 s,40个循环。

表1 引物序列
1.2.7 Western blotting检测Mad2、Bub1、BubR1的蛋白表达水平 收集各组细胞,用RIPA裂解液进行裂解,BCA蛋白定量后调整蛋白浓度,取适量蛋白进行SDS-PAGE电泳。电转到PVDF膜,用5%脱脂牛奶封闭室温封闭2 h。室温孵育一抗Mad2、Bub1和BubR1(1∶1 000稀释)1 h,洗膜3次,室温孵育相应二抗1 h,细洗膜3次。ECL显色后置于凝胶成像仪中曝光,Image J进行灰度值分析。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 叶酸对L02细胞形态学的影响 与正常对照组相比,20 nmol/L与0 nmol/L叶酸培养2周后,细胞体积增大、形态不规则,0 nmol/L叶酸组现象更加显著(见图1)。

2.2 叶酸对L02细胞增殖活性的影响 与正常对照组相比,200 nmol/L、20 nmol/L组与0 nmol/L细胞活性明显降低(P<0.01);与200 nmol/L相比,20 nmol/L与0 nmol/L组细胞活性明显降低(P<0.01)(见表2)。
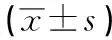
表2 不同浓度叶酸培养2周后对细胞增殖能力(OD450值)的影响
2.3 叶酸对L02细胞周期的影响 与正常对照组相比,200 nmol/L组细胞G1/G0期、S期均值差异无统计学意义(P>0.05);20 nmol/L组和0 nmol/L组细胞G1/G0期明显降低(P<0.01)、S期明显升高(P<0.01)。与200 nmol/L相比,20 nmol/L组和0 nmol/L组细胞G1/G0期明显降低(P<0.01)、S期明显升高(P<0.01)。与20 nmol/L组相比,0 nmol/L组S期明显增加、G1/G0期明显减少(P<0.01)(见表3)。

表3 不同浓度叶酸培养2周后对细胞周期的影响
2.4 叶酸对L02细胞凋亡的影响 与正常对照组相比,200 nmol/L组细胞凋亡率差异无统计学意义(P>0.05);20 nmol/L组细胞发生凋亡(P<0.05),0 nmol/L组细胞明显发生凋亡(P<0.01)。与200 nmol/L相比,20 nmol/L组细胞凋亡率差异无统计学意义(P>0.05),0 nmol/L组凋亡率明显增加(P<0.01)。与20 nmol/L组相比,0 nmol/L组凋亡率明显增加(P<0.01)(见图2、表4)。

表4 不同浓度叶酸培养2周后对细胞凋亡的影响

2.5 叶酸对L02细胞Mad2、Bub1、BubR1 mRNA的表达量的影响 与正常对照组相比,叶酸浓度为200 nmol/L时,Bub1 mRNA的表达量增加(P<0.05),Mad2和BubR1 mRNA的表达量明显增加(P<0.01);叶酸浓度为20 nmol/L及0 nmol/L时,Mad2、Bub1、BubR1 mRNA的表达量均明显增加(P<0.01)(见表5)。
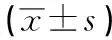
表5 不同浓度叶酸培养2周后对SAC相关基因表达的影响
2.6 叶酸对L02细胞Mad2、Bub1、BubR1蛋白表达的影响 与正常对照组相比,200 nmol/L组Bub1蛋白表达量增加(P<0.05),20 nmol/L、0 nmol/L组Bub1 蛋白表达量明显增加(P<0.01);200 nmol/L、20 nmol/L和0 nmol/L组Mad2和 BubR1蛋白表达量均明显增加(P<0.01)(见图3、表6)。

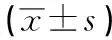
表6 不同浓度叶酸培养2周后对SAC相关蛋白表达的影响
3 讨论
相关实验研究显示[2]叶酸浓度为120 nmol/L时便可维持人淋巴细胞基因组结构稳定,因此本实验选取略高于基因组稳定的叶酸浓度即200 nmol/L、20 nmol/L、0 nmol/L作为实验组。CCK8结果显示叶酸浓度为200 nmol/L、20 nmol/L、0 nmol/L时叶酸增殖受到了明显抑制,细胞周期与凋亡结果显示,叶酸浓度为200 nmol/L时,L02细胞G1/G0期、S期及凋亡率均值与正常对照组差异无统计学意义。叶酸浓度为20 nmol/L、0 nmol/L 细胞发生S期阻滞,凋亡数量增多,且叶酸浓度越低S期阻滞越明显、细胞凋亡数量越多。COURTEMANCHE等[3]的研究显示叶酸缺乏可以降低细胞增殖,诱导凋亡和细胞周期阻滞,本研究与上述研究结果相符合。LIANG等[4-5]研究表明叶酸缺乏诱导细胞发生G1/G0期阻滞,从而导致细胞发生凋亡,在G1/G0期阻滞与凋亡之间建立了联系。HUANG等[6]研究结果显示在叶酸缺乏的培养基中HepG2细胞叶酸浓度较低,细胞在S期积累随后发生G2/M期阻滞,进而诱导细胞发生凋亡。低叶酸缺诱导的DNA的损伤程度具有凋亡反应,这是叶酸缺乏引起细胞凋亡的原因之一。本研究中,当叶酸浓度为20 nmol/L、0 nmol/L时细胞发生S期阻滞,进而诱导细胞发生凋亡。本研究与上述研究结果有所不同,本研究结果显示叶酸缺乏时细胞发生S期阻滞,我们认为差生差异的原因可能是由于所用细胞系、培养细胞时间不同造成的。
SAC作为细胞周期检查点对于维持细胞周期正常进行至关重要,Bub1参与染色体排列,Mad2和BubR1通过结合底物CDC20,阻止CDC20激活APC/C以达到抑制APC/C的效果,防止细胞提前进入后期。SAC作为细胞周期的监控机制,其某些成分的异常表达会使SAC功能发生改变,导致染色体不稳定和非整倍体。对果蝇和小鼠的研究均证实了SAC在维持染色体稳定方面的重要性[7-11],在SAC发生突变的细胞中,有丝分裂错误的发生率很高,导致非整倍体细胞的比例急剧增加[11-12]。在一项宫颈癌研究中[13]发现,下调Mad2和BubR1可以促进SiHa细胞增长,增强细胞侵袭和迁移能力,抑制细胞凋亡,降低药物治疗作用[13]。并且下调Mad2可以通过调控磷酸化survivin的活化,调控胃癌细胞周期,增加增殖,提高胃癌细胞的耐药性[14]。另一项对乳腺癌研究[15]中,与KrasG12D或Her2同时在成年小鼠乳腺中过表达有丝分裂检查点蛋白Mad2,会导致有丝分裂检查点过度激活,过早的Mad2表达会导致强烈的有丝分裂停止和细胞死亡增加。用特异性的小干扰RNA敲低纺锤体检查点蛋白BubR1或Mad2,可显著减少6,7-二甲氧基-3-(3-甲氧基苯基)异喹啉-1-胺(CWJ-082)诱导的有丝分裂细胞积累和凋亡[16]。印度的一项药物研究[17]也显示,过表达的Mad2通过恢复适当的后期启动和维持更多的细胞存活,部分地挽救了药物的有害作用。在肝细胞性癌组织和细胞中,miR-490-5p的过表达或Bub1的过表达抑制了肝细胞性癌细胞的增殖、迁移、侵袭,增加了凋亡率[18]。缺少Bub1的小鼠胚胎成纤维细胞不能使其染色体对齐或维持SAC功能[19]。本研究结果显示,叶酸浓度为200 nmol/L、20 nmol/L和0 nmol/L时Mad2、Bub1、BubR1 mRNA的表达量明显增加,Western blotting检测也显示在蛋白水平上Mad2、Bub1、BubR1表达量明显增加。
结合上述研究和实验结果我们得出这样一个结论:对于SAC来说叶酸浓度为200 nmol/L已经达到一种缺乏状态,Mad2、Bub1、BubR1的高表达用于增加SAC的活性,可以维持细胞有丝分裂进行,避免细胞发生凋亡。当叶酸极度缺乏时(20 nmol/L和0 nmol/L),SAC功能活性受到了严重损害,Mad2、Bub1、BubR1的高表达不足以维持其正常活性,有丝分裂出现异常,可能导致非整倍体及染色体不稳定的发生,使得细胞增殖受到抑制,细胞周期发生阻滞,诱导细胞发生凋亡。综上所述,本研究结果显示,对于L02细胞来说叶酸浓度为200 nmol/L时已经达到一种缺乏状态,叶酸缺乏时SAC功能异常,可能是阻碍细胞增殖、诱导凋亡的原因。
