空腹血糖水平与吉兰巴雷综合征短期预后的关系
2021-07-01郝佳妮屈洪党
郝佳妮,屈洪党,赵 亨
吉兰巴雷综合征(Guillain-Barré syndrome,GBS)作为最严重和最常见的急性麻痹性多发性神经病,全世界每年约有10万人罹患这种疾病[1]。病人临床上主要表现为四肢对称性无力,进展迅速,病情严重者可累及呼吸肌危及生命,需要辅助通气。GBS病程多为单时相自限性,一般在2周左右达到高峰。其发病机制主要与自身免疫介导的外周神经脱髓鞘有关,而高血糖也是外周神经病变的主要危险因素。有研究[2-3]表明,血糖水平与GBS之间存在潜在的关联。因此,本研究回顾性分析GBS病人的临床特征,并探讨空腹血糖(FPG)水平与GBS短期预后的关系。
1 对象与方法
1.1 研究对象 收集蚌埠医学院第一附属医院2016年1月至2020年2月收治的GBS病人,其诊断标准采用中华医学会神经病学分会2019年制定的GBS诊断标准。排除年龄<18岁、诊断为Miller Fisher综合征或慢性炎症性脱髓鞘性多发性神经病的病人以及在住院之前接受激素治疗的病人,共纳入研究对象146例。
1.2 研究方法
1.2.1 分组 根据入院第2天FPG水平(参考值3.9~6.1 mmol/L),分为正常FPG组90例和高FPG组56例。
1.2.2 资料收集 收集病人性别、年龄、神经系统体征、有无前驱感染史、是否合并颅神经麻痹、感觉障碍、自主神经受累、呼吸费力等基本资料,收集入院期间病人脑脊液蛋白水平、葡萄糖水平、有无蛋白细胞分离、潘氏试验结果等资料,收集病人神经电生理情况以及入院第2天FPG水平、达峰时血清C-反应蛋白(CRP)水平等。
1.2.3 病情等级评定 分别采用MRC总分和休斯功能分级量表(Hughes functional grading scale,HFGS)评分进行病情评估。MRC总分指6组肌群包括肩外展、肘屈、腕伸、髋屈、膝伸及足背屈肌力的总和,共0~60分。HFGS评分:0分为健康者;1分为有轻微症状,可以跑;2分为无辅助下可行走10 m;3分为可在辅助下行走10 m;4分为依赖轮椅或卧床;5分为呼吸困难,需要机械通气;6分为死亡。Hughes评分0~3分为轻型病人,4~6分为重型病人。
1.2.4 短期预后判断标准 以出院时出现严重的四肢瘫痪、呼吸肌受累和死亡(HFGS评分>3分)作为短期预后不良的判定标准。
1.3 统计学方法 采用t检验、Mann-Whitney U检验、χ2检验、Fisher′s确切概率法和logistic回归分析。
2 结果
2.1 临床资料比较 2组病人年龄、性别、前驱感染史、感觉障碍、腱反射减弱或消失、脑膜刺激征、神经电生理分型及脑脊液蛋白水平、蛋白细胞分离和潘氏试验结果差异均无统计学意义(P>0.05)。正常FPG组病人手术外伤史发生率、颅神经受累率、合并自主神经功能障碍率、呼吸困难发生率、辅助通气率、巴氏征发生率、出院时HFGS 评分为5和6、脑脊液葡萄糖浓度均低于高FPG组(P<0.05~P<0.01),高峰时MRC评分明显低于高FPG组(P<0.01)(见表1)。

表1 临床资料的比较[n;百分率(%)]
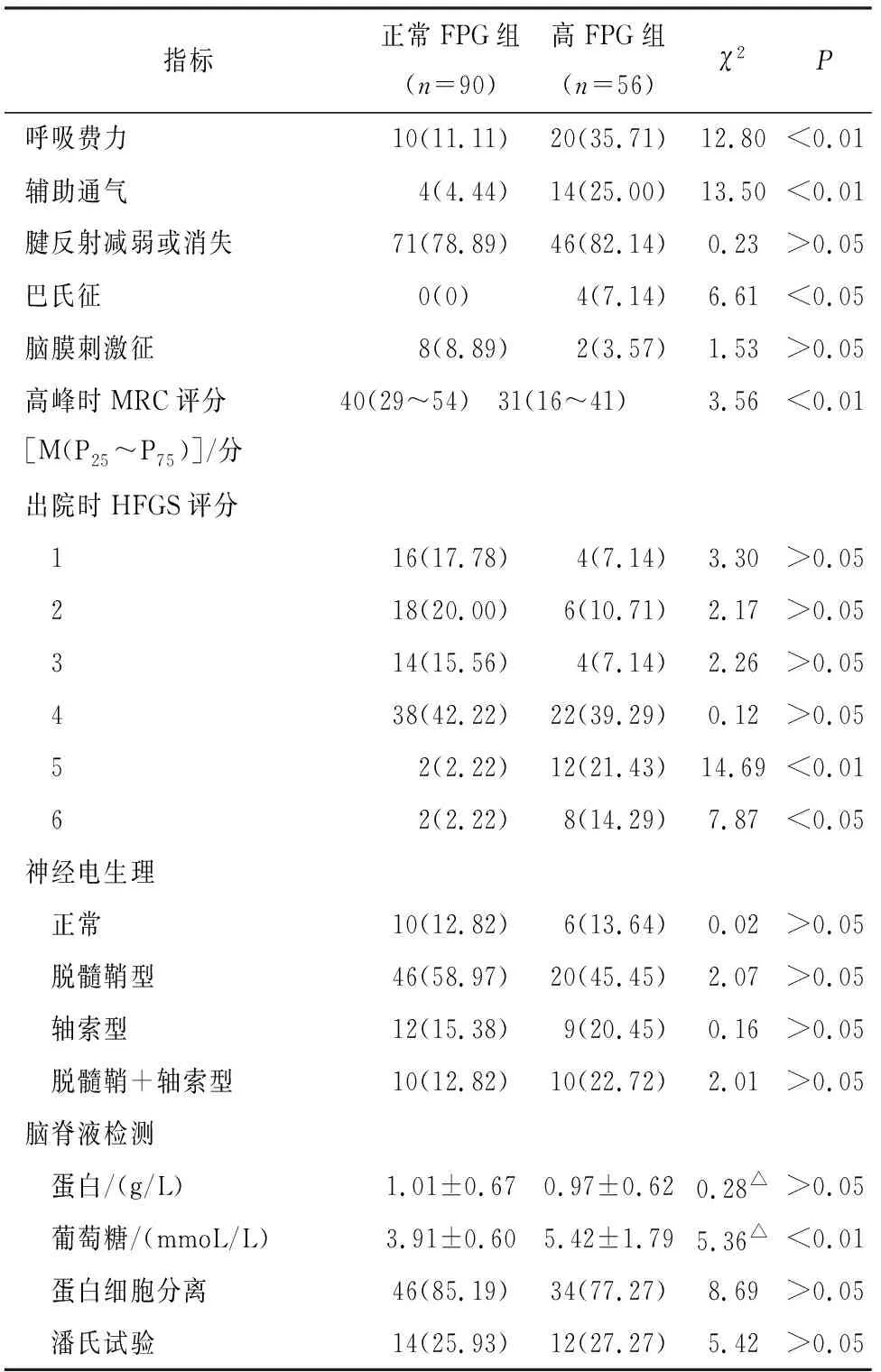
续表1
2.2 影响GBS短期预后的危险因素分析 单因素分析显示,年龄大、颅神经受累、自主神经功能障碍、脑脊液蛋白含量高、FPG水平高以及血CRP水平高均是GBS病人短期预后不良的危险因素(P<0.05~P<0.01),脑脊液细胞数与病人短期预后无明显相关性(P>0.05)。多因素logistic回归分析显示,年龄大、颅神经受累、脑脊液蛋白含量高和FPG水平高均为GBS病人短期预后不良的独立危险因素(P<0.05~P<0.01)(见表2)。

表2 GBS病人预后不良的危险因素
3 讨论
GBS是一种自身免疫介导的多发神经根炎性病,多由感染诱发,在传染病暴发期间GBS的发病率会升高,在新冠肺炎肆虐的今天更需要加强疾病管理[4,5]。其临床差异性较大,主要特征是四肢进行性无力伴有四肢末端感觉障碍[6]。急性炎症性脱髓鞘性多发性神经病的免疫损伤靶点为髓鞘和相关的施万细胞成分,而在急性运动轴突型病人中神经轴突是免疫相关损伤的主要靶点。Th细胞亚群尤其Th1和Th17细胞通过分泌细胞因子并募集和激活其他炎症细胞而参与自身免疫性神经炎的发展,这些效应T细胞利用大量的葡萄糖和高糖酵解来满足其能量需求[7]。本研究发现入院时较高的FPG水平更易合并颅神经受累,自主神经功能障碍和呼吸困难,高峰时无力症状更重,而且是GBS短期预后的独立危险因素。
糖尿病是引起周围神经病变的最常见原因之一,超过50%的糖尿病病人在其疾病发展过程中出现周围神经病变[8]。虽然糖尿病性神经病变主要累及轴索,但是施万细胞是也是糖尿病的靶点,严重病人也会出现脱髓鞘的特征[9]。糖尿病和GBS有共同的免疫途径。糖尿病与高水平的细胞因子有关,包括肿瘤坏死因子-α、白细胞介素(IL)-1β、IL-6、IL-12、IL-17、IL-18以及肿瘤坏死因子-γ,这些细胞因子同时参与了GBS的发病机制[10-12]。CRP作为反应全身炎症状况的生物标志物,在糖尿病和GBS病人中均被检测到升高[13]。神经节苷脂在胰岛及周围神经系统中均可表达,抗神经节苷脂抗体同样存在于1型糖尿病病人及GBS病人中[14]。胰岛素除增加葡萄糖的利用外,还能通过促进神经细胞产生神经生长因子诱导神经突增生[15]。研究[16]表明在背根神经节和轴突中存在胰岛素受体。已经明确诊断的糖尿病病人其GBS病情更重、短期预后更差,可能与糖尿病引起的神经病变有关。而GBS病人的全身炎症反应状态也可能导致糖代谢紊乱,高血糖又将加重GBS病人的周围神经损害。有报道[17]指出糖尿病也可引起GBS,两者之间可能互为因果关系。
GBS是一种周围神经炎性病,目前多采用静脉应用免疫球蛋白或血浆置换疗法[18]。临床上曾广泛应用糖皮质激素作为GBS的治疗,而研究表明仅给予糖皮质激素并不会显著加速GBS的恢复或影响长期预后[19]。使用糖皮质激素最常见的不良反应之一就是高血糖,结合我们研究,考虑激素对GBS的疗效不佳正是由于血糖升高会加重GBS的神经损害,使症状更为严重并影响其预后。在实验动物的模型中,已经证实了糖酵解抑制剂不仅能抑制GBS的启动,还可阻止其进展[20]。而胰岛素作为控制血糖的主要药物,可能在改善GBS症状和预后方面有一定作用。高FPG的GBS病人更易发生呼吸困难及使用呼吸机辅助通气,在临床工作中需要早期对GBS病人进行血糖检测及糖尿病筛查,并进行临床干预,以期改善GBS病人的病情及预后。
本研究FPG升高的GBS病人病情更重、更易出现颅神经受累,自主神经功能障碍,呼吸困难和依赖机械通气,短期预后更差。FPG升高是GBS病人短期预后不良的独立危险因素。由于本研究为回顾性分析,不能全面地收集资料和设计试验,具有一定的局限性。只记录了病人入院第二天的FBG值,并没有对所有病人进行动态血糖监测。未来需要前瞻性的多中心研究进一步验证。
