Comsol模拟金属离子浓度对电镀铜锌合金的影响
2021-06-30丁莉峰陈冲艳李强尚芮泽薛丁袁进霞牛宇岚
丁莉峰 ,陈冲艳,李强,尚芮泽,薛丁,袁进霞,牛宇岚
(1.太原工业学院化学与化工系,山西 太原 030008; 2.中北大学化学工程与技术学院,山西 太原 030051; 3.太原理工大学信息与计算机学院,山西 太原 030024)
Cu-Zn电镀合金在工业上应用广泛,是被研究最多的合金体系之一[1]。其氰化物电镀体系最早被工艺化,但是氰化物有毒,会污染环境,以及伤害实验人员。随着全球的环保意识逐渐增强,电镀铜锌合金逐渐转向一个无氰的时代。近年来电镀行业的无氰电镀[2]研究主要有EDTA体系[3]、山梨糖醇体系[4]、柠檬酸盐体系[5]、组氨酸体系[6]、甘氨酸体系[7]等。本文研究的是酒石酸盐体系,该体系成分简单、清洁,近年来不少学者都对该体系进行过研究。Amutha等[8]研究了该体系中电流密度、pH和温度对镀液分散能力和镀层的影响,得到一组最佳工艺参数。Rehim等[9-10]提出了另一种以氯化铵为添加剂的镀液组成与工艺技术,还研究了在直流电场上叠加正弦交流电对该电镀工艺的影响。Domínguez-Ríos等[11]通过对该体系的镀层进行分析,得出酒石酸盐浓度对铜锌离子沉积速率的影响规律。余向飞等[12]提出了一种稳定且分散能力和覆盖能力都好的酒石酸盐电镀铜锌合金的工艺。方舒等[13]研究了不同辅助配位剂对酒石酸钾钠体系电镀Cu-Zn合金的影响。肖友军等[14]讨论了甲醇、亚铁氰化钾和2,2′-联吡啶作为添加剂对酒石酸钾钠体系镀液稳定性、镀层质量和沉积速率的影响。张颖等[15]发明了一种在玻璃钢基体上进行酒石酸盐体系电镀仿金Cu-Zn的工艺。
以上研究均是在实验基础上对不同工艺结果进行分析,从而得出最佳工艺参数。这样的研究内容 过于繁琐,过程中往往有众多的不稳定因素。在研究中建立一个对照标准可以减轻工作量,节省药品,缩短实验周期。Comsol多物理场软件有基于电极过程动力学理论开发的电化学模块[16],利用计算机强大的计算能力和现有的完善理论体系,可以对实验进行仿真模拟,如用于研究复合电池[17-19]、锂电池[20-22]等不同边界结构和流场环境等条件对电池性能的影响。在电镀领域,通过建立电磁场和流场的耦合,对仿真模拟的结果进行分析,可以开发实验器械的设计方案,优化电镀工艺,得到最佳工艺参数等[23-27]。在电镀铜填充的工艺中,该软件可以直接建立硅通孔电镀铜仿真模型来直观地研究电镀填充过程,对微电子技术的发展有一定的贡献[28-29]。
本研究以酒石酸钾钠电镀铜锌合金为基础,通过实验测得不同Cu、Zn离子浓度在对应的电解液中的电导率、扩散系数等参数,对电镀过程进行Comsol建模分析,最终得出金属离子对该体系电沉积中镀层厚度和电解质浓度变化的影响,为该体系建立参照标准及优化工艺试验提供技术支持。
1 仿真模拟
1.1 仿真模拟方法
用Comsol软件模拟金属离子的浓度对镀层厚度和阴阳电极间扩散传质的影响,软件的编程思路如图1所示。首先在模型中建立等比例的几何模型;然后设置其分析条件,如所用的主配位剂、主盐中金属离子的浓度等;再进行网格划分;最后对所建立的模型进行求解。也就是将数学模型离散化为有限个单元,利用有限元分析边界条件和初始条件,求解线性或非线性微分方程[30-31]。
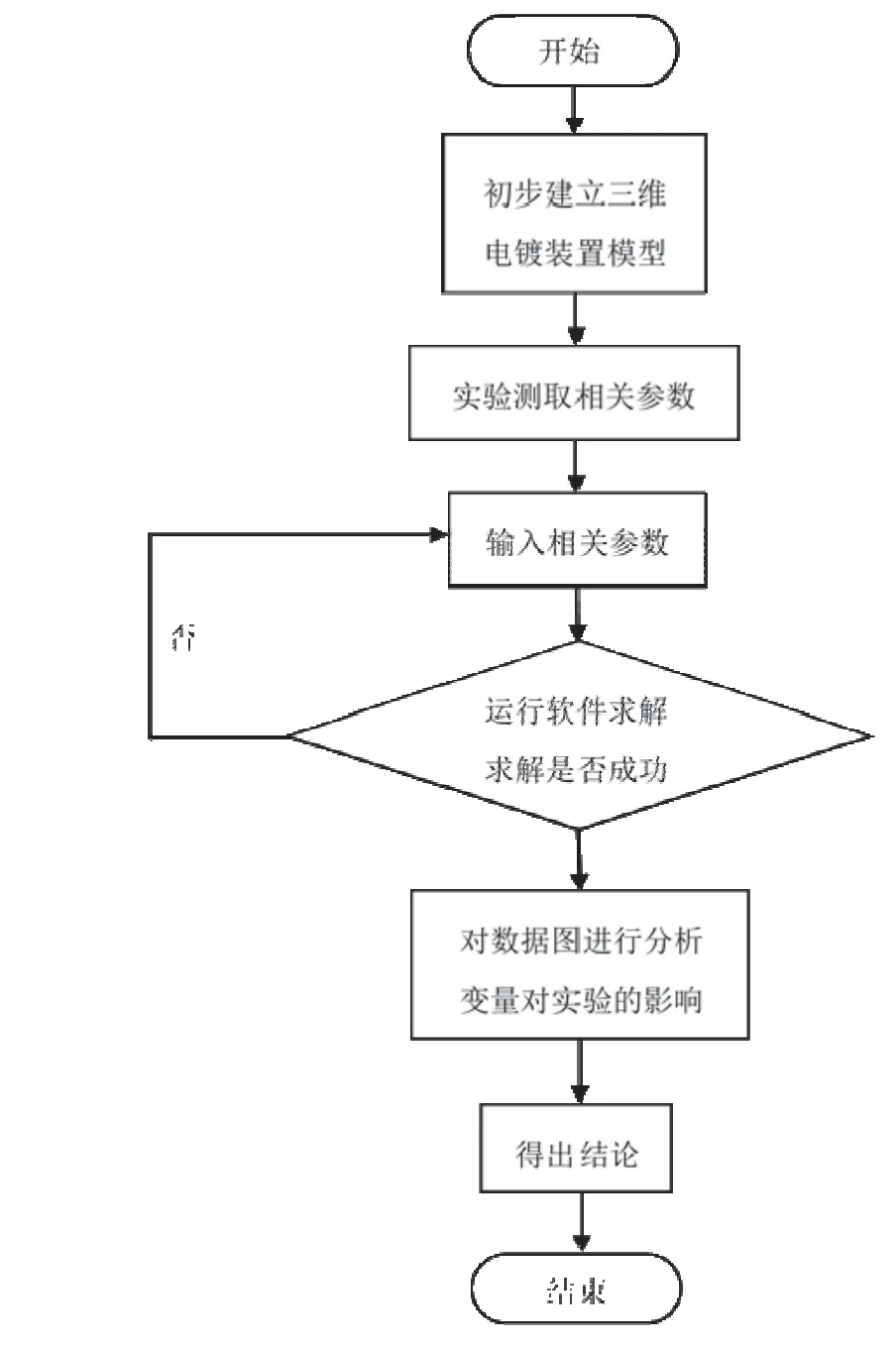
图1 模拟过程的程序框图 Figure 1 Block diagram of the simulation process
1.2 电镀仿真模型的建立
图2是利用Comsol多物理场软件建立的三维仿真物理模型,按实验室实际电镀设备1∶1建模。镀槽为圆柱形:底面半径为25 mm,高为55 mm。阳极为Cn0.7Zn0.3铜片,阴极为304不锈钢,两电极的尺寸均为46 mm × 30 mm × 1 mm,阴阳极板间距为20 mm。电解质以0.34 mol/L酒石酸钾钠为主配位剂,0.065 mol/L柠檬酸钠为辅助配位剂,0.052 mol/L硫酸铜和0.06 mol/L硫酸锌为主盐,pH为7.5。
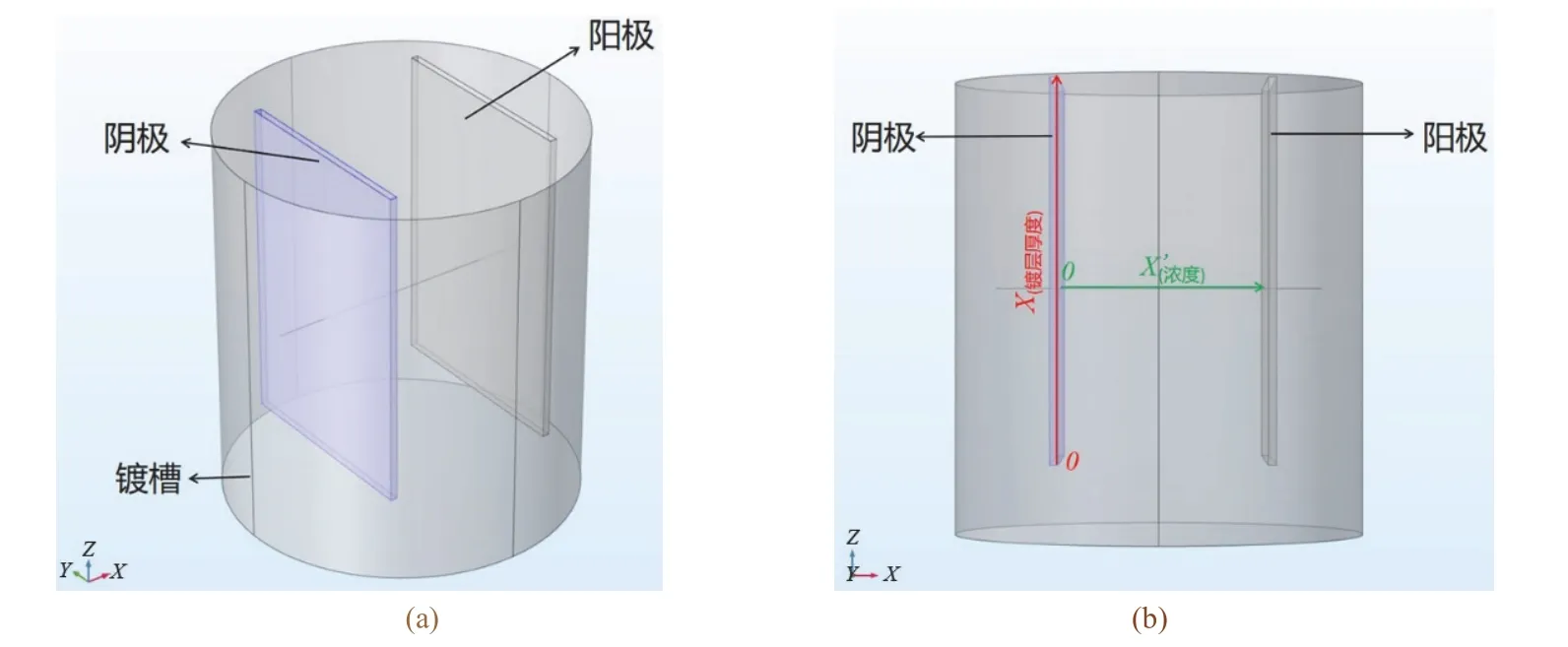
图2 电镀装置模型的立面图(a)和主视图(b)Figure 2 Elevation view (a)and front view (b)of the model of electroplating setup
1.3 镀层厚度的模拟方法
仿真以图2中主视图红线所示为零点,阴极片的长度方向为横坐标,即X轴(0 ≤x≤ 46 mm),以镀层厚度方向为Y轴,建立坐标系,以得出阴极板上的边界镀层厚度随电镀时间与离子浓度变化的曲线。电镀仿真的边界条件是通过在整个仿真区域添加电镀3次模块作为物理场约束,在阴极表面添加平均电流密度作为载荷约束,具体的边界条件如下:添加3次电镀模块作为仿真的物理场,在属性设置中建立cCu(铜离子浓度)、cZn(锌离子浓度)两个变量,设置其初始值以及两离子在模型中的扩散系数、迁移率、电导率、参与电荷数、电化学当量等相关参数。在电极表面属性中设置边缘条件为平均电流密度iavg= 2.33 A/dm2;电极反应动力学设置为阳极Tafel方程;在溶解-沉积物质中添加物质,设置其密度为8960 kg/m3,摩尔质量为0.06355 kg/mol。添加以上条件并应用阳极边缘表面、阳极边缘及铜片表面可以模拟得出仿真镀层厚度。
1.4 电解质浓度的模拟
仿真模型以图2中主视图绿线所示为零点,沿镀槽半径方向建立横坐标,即X′轴(0 ≤x′ ≤ 25 mm)。以电解质浓度(mol/m3)为Y′轴(即纵坐标)。通过模拟最终得出电极间电解质浓度随自变量(电镀时间与金属离子浓度)的变化曲线。仿真模拟采用Comsol电镀模块中的“三次电流分布”的Nernst-Planck电化学分布接口,充分考虑了物质通过扩散、电迁移和对流进行的传递,所以可得出电化学过程中电解质浓度的变化。电镀液中每种离子的流量可以由式(1)所示的Nernst-Planck方程[16]计算得出。

其中N为离子流量,D为扩散系数,c为电解质浓度,z为离子所带电荷数,u为离子迁移率,F为法拉第常数,φ为电解质电位,∇为哈密顿算子。质量守恒方程如式(2)所示。

其中t表示离子扩散的时间,电中性条件如式(3)表示。

其中i= 1或2,分别表示铜离子和锌离子。阳极和阴极边界条件通过Butler-Volmer公式给定。电镀过程可以根据以下简化机理描述。
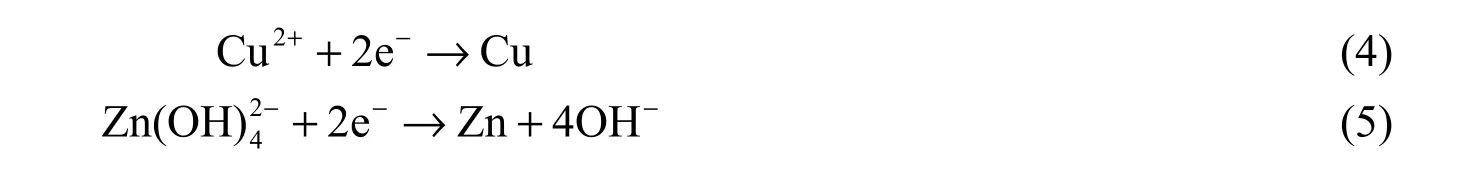
2 结果与讨论
2.1 电解液中电场和浓度场分布特征
图3a为电流密度设置为2.33 A/dm2,电镀时间为30 s时的电解质电势分布图。从中可以看出电解质电势分布呈现阳极板处电势较高,阴极板处电势较低,两极板中间区域电势分布较均匀的趋势。图3b为电镀液进行仿真电镀30 s以后的金属离子浓度分布图。从中可以看出阴极板处电解质浓度从上边界到下边界逐渐递减。呈现该趋势的原因可能是阳极板电解产生了部分铜锌离子,阴极板下边界沉积了大量的金属离子而得不到及时的补充,因此此处浓度较低。
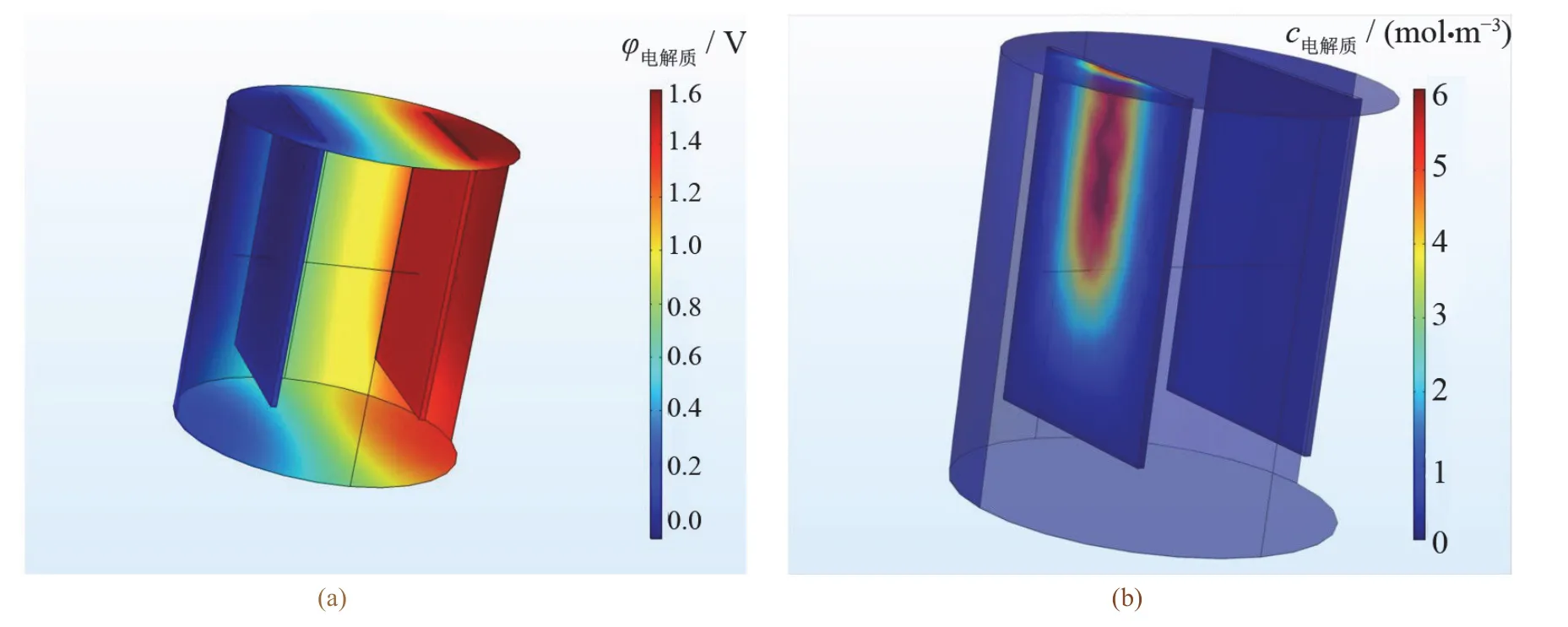
图3 电解液中电解质电势(a)和浓度场(b)分布 Figure 3 Distribution of potential (a)and concentration field (b)in electrolyte
2.2 Zn离子浓度对阴极镀层厚度的影响
从图4可以看出,在不同Zn离子浓度下,阴极边缘厚度随电镀时间延长而变化的整体趋势是:x在0~15 mm内大致呈对数型降低,在x> 15 mm时阴极边缘厚度增速基本稳定。当电镀完成,即时间达到30 s时就会有阴极边缘零点的厚度远大于阴极边缘平均厚度,且阴极厚度随x增大而降低。该结论与实验室得到的实际镀层厚度相符。该现象是由边缘效应引起的,也就是电场分布和电镀液浓度场分布的结果,这与图3中的电场和浓度场分析一致。另一个明显的现象是阴极边缘厚度相对于x的变化不是一条光滑的曲线,而是凹凸不平的。这是由于传质过程导致镀层阴极边缘厚度不均匀。上述两个现象并不随Zn离子浓度的变化而改变。
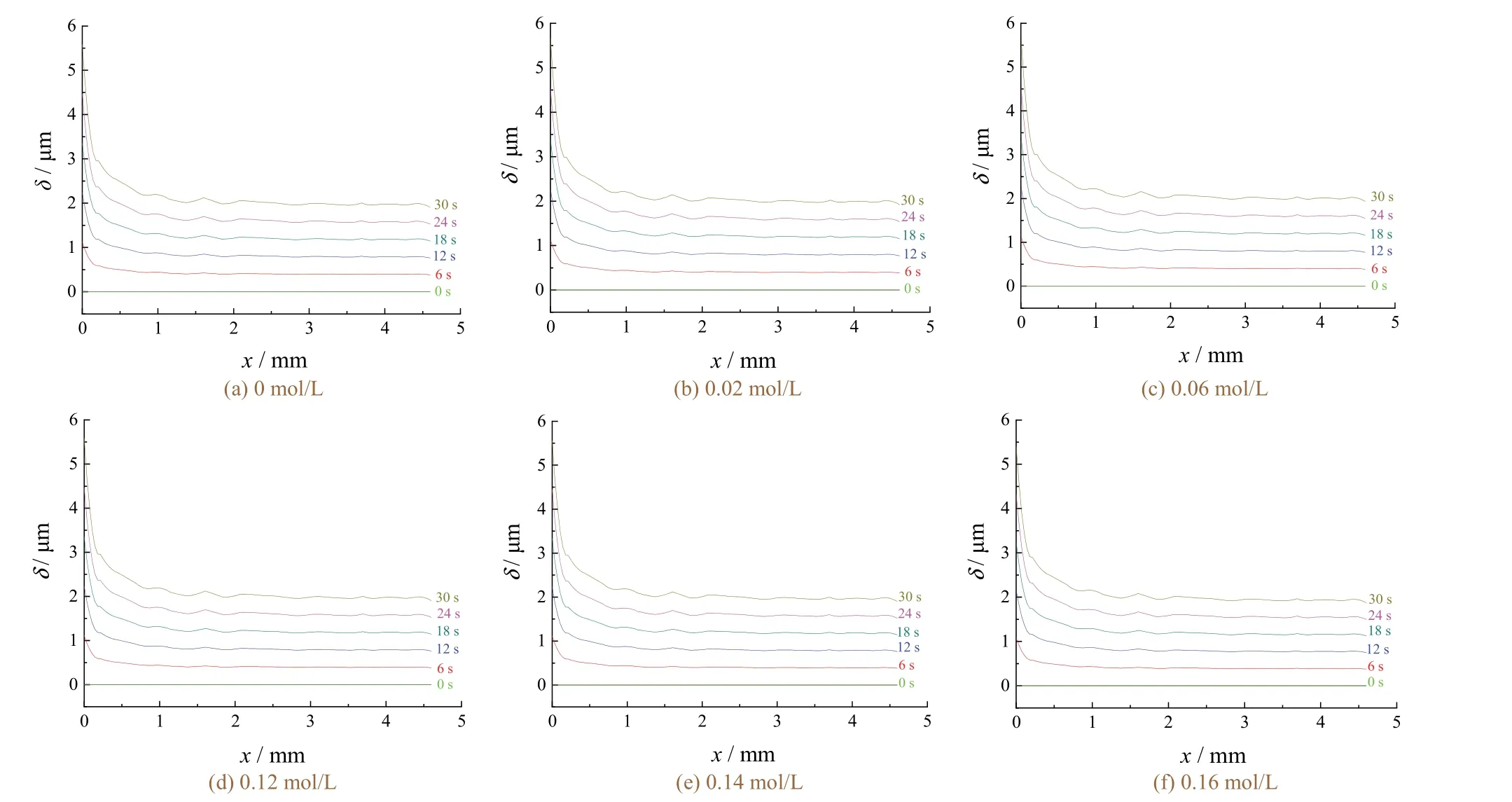
图4 不同锌离子浓度下阴极边界镀层厚度的分布 Figure 4 Distribution of coating thickness at cathode boundary under different concentrations zinc ions
图5为x= 20 mm处t= 30 s时阴极边界镀层厚度对锌离子浓度的拟合曲线。从中可知Zn离子浓度在0~0.06 mol/L的范围内阴极边缘厚度逐渐增大,0.06 mol/L时镀层最厚,随后锌离子浓度继续增大时,阴极边缘厚度逐渐减小。因此,0.06 mol/L是进行电镀的最佳Zn离子浓度。
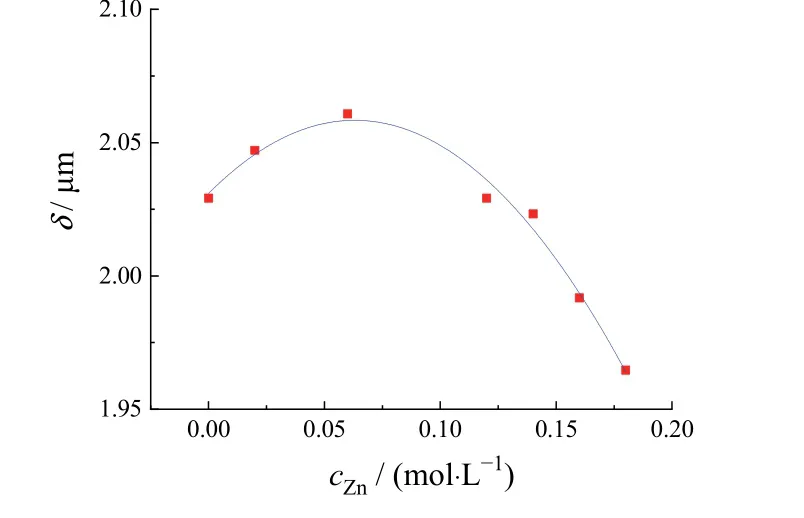
图5 锌离子浓度对镀层厚度的影响(x = 20 mm, t = 30 s)Figure 5 Effect of zinc ion concentration on coating thickness (x = 20 mm, t = 30 s)
2.3 Cu离子浓度对阴极镀层厚度的影响
图6示出了锌离子浓度为0.06 mol/L时,不同铜离子浓度对阴极边界镀层厚度的影响。可见镀层边缘厚度随Cu离子浓度变化的趋势与Zn离子梯度下的变化趋势相似。
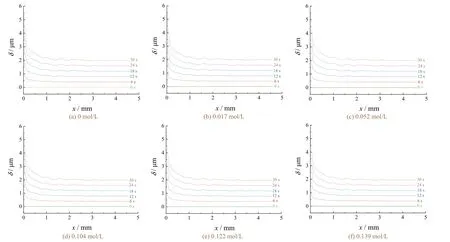
图6 不同铜离子浓度下阴极边界镀层厚度的分布 Figure 6 Distribution of coating thickness at cathode boundary under different concentrations of copper ions
图7为x= 20 mm处t= 30 s时阴极边界镀层厚度对铜离子浓度的拟合曲线。可见边缘镀层厚度随浓度的增大呈现先增加后减小的趋势,浓度为0.052 mol/L时达到最大,此为最佳Cu离子浓度。
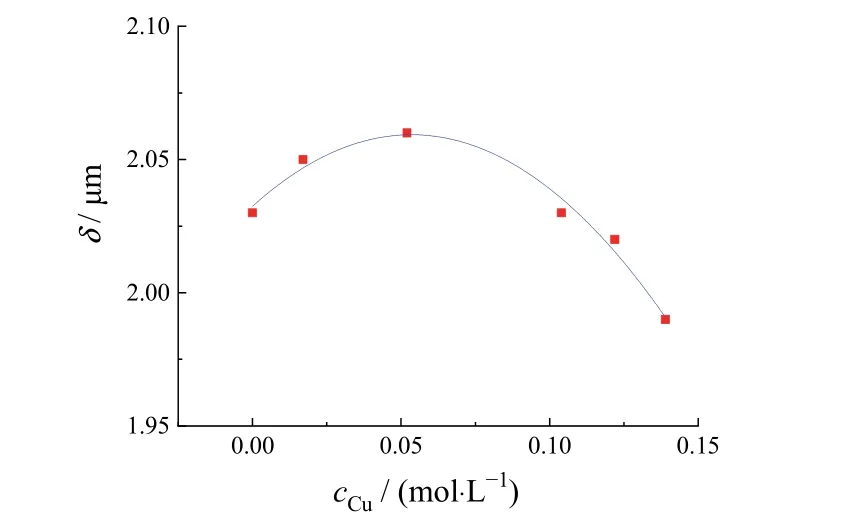
图7 铜离子浓度对镀层厚度的影响(x = 20 mm, t = 30 s)Figure 7 Effect of copper ion concentration on coating thickness (x = 20 mm, t = 30 s)
2.4 Zn离子浓度对电解质浓度变化的影响
图8是不同Zn离子浓度下的电解质浓度分布随时间变化的曲线。设置电解质浓度的正方向为阴极到阳极,反之则为负方向。选取x在7.0~7.5 mm范围内的曲线进行局部放大。
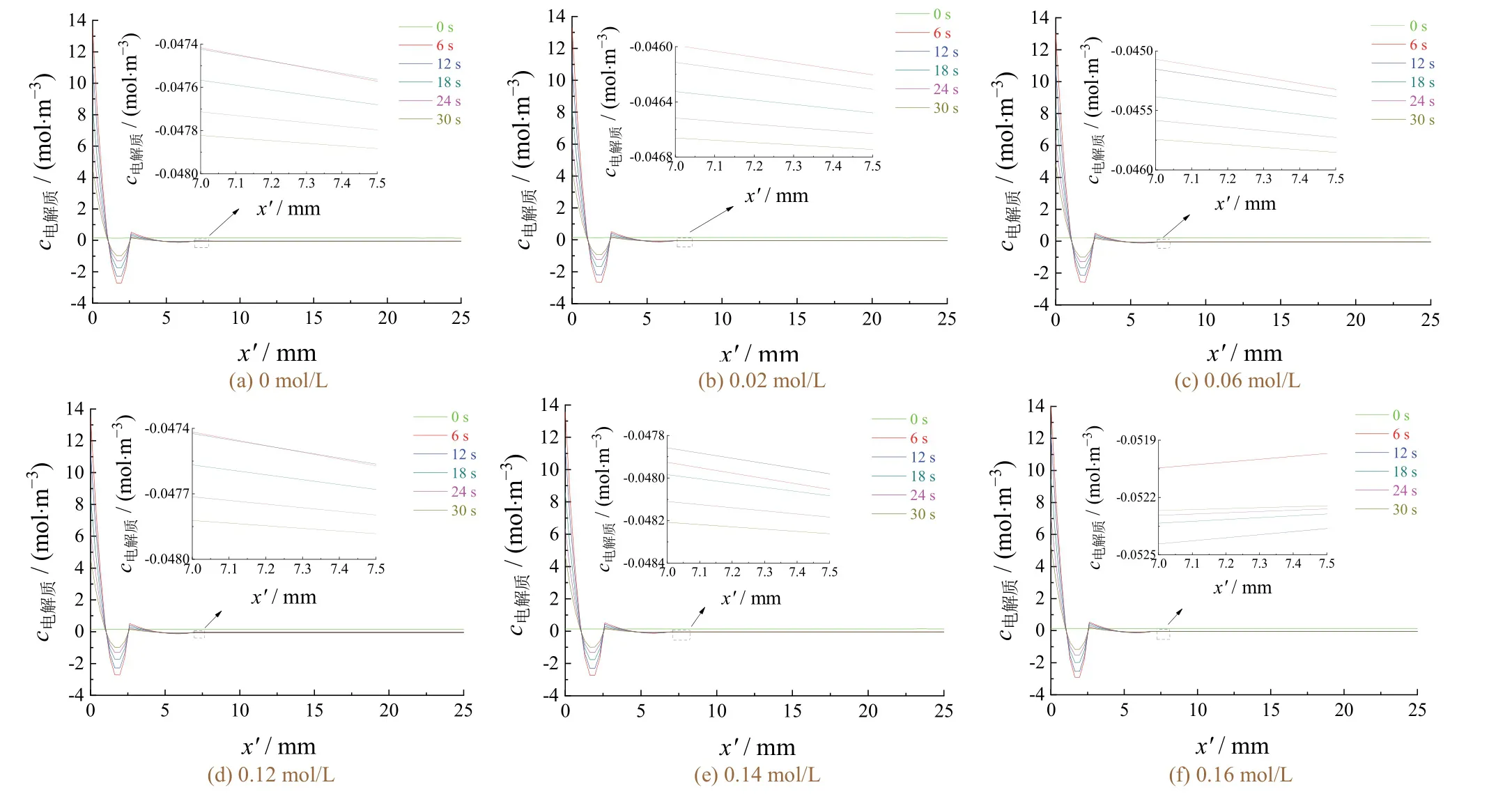
图8 不同锌离子浓度下电解质浓度的分布 Figure 8 Distribution of electrolyte concentration under different concentrations of zinc ions
从图8可以看出电极间电解质浓度分布趋势为:电镀反应开始后,x′在0~4 mm之间的电解质浓度发生明显突变,x′ = 0 mm处电解质浓度最高;随x′的增加,电解质浓度先减小后升高,再减小;而当x′ > 4 mm时,电解质浓度相对稳定。该趋势与图3b中的电解质浓度分析一致。曲线在x′轴上的第二个交点前,电解质浓度分布呈抛物线趋势,这主要是由阴极板造成的。在不同的电镀时刻,阴阳极板间电解质浓度与x′轴的交点大约处于2.6 mm和4.5 mm,这就将电极间的扩散层作了划分。
电解质浓度随电镀时间延长的分布趋势为:x′= 1.2~2.4 mm之间的电解质浓度逐渐降低。这是因为阴极附近的电解质被消耗后不能得到及时的补充,导致该处的电解质浓度呈迅速下降的趋势。而该现象会造成镀层边缘厚、中间薄的结果,与图4的分析结果一致。在x′ = 7.0~7.5 mm的范围内,0~6 s时电场力的作用导致该区间的电解质浓度不稳定,而随着电镀时间延长,电解质浓度不断趋于稳定。通过对比图8 中的局部放大图可知当电镀时间达到30 s时,在Zn离子浓度从0增加到0.06 mol/L的过程中,电解质浓度略有减小。这是由于在锌离子浓度增加的同时,沉积在阴极的金属离子增多,造成镀液中整体的电解质浓度有所减小。当Zn离子浓度从0.06 mol/L增加到0.14 mol/L时,电镀时间延长后电解质浓度略有变化,说明沉积反应不断进行。此时电解质浓度为负值,说明电解质由阳极向阴极方向迁移。电镀时间进行到30 s时,锌离子浓度从0不断增加到0.14 mol/L的过程中,电解质浓度都相差不大。
t= 30 s时x′ = 0 mm处的电解质浓度对锌离子浓度(0~0.16 mol/L)的拟合曲线(图9)显示了电镀进行到30 s时阴极表面的电解质浓度随Zn离子浓度的变化。在Zn离子浓度0~0.06 mol/L范围内,随锌离子浓度的增加,电解质浓度减小。这说明在该范围内Zn离子浓度增加有利于阴极电沉积,镀层厚度增加(见图5)。而Zn离子浓度大于0.06 mol/L时,随锌离子浓度继续增大,电解质浓度也不断增大。
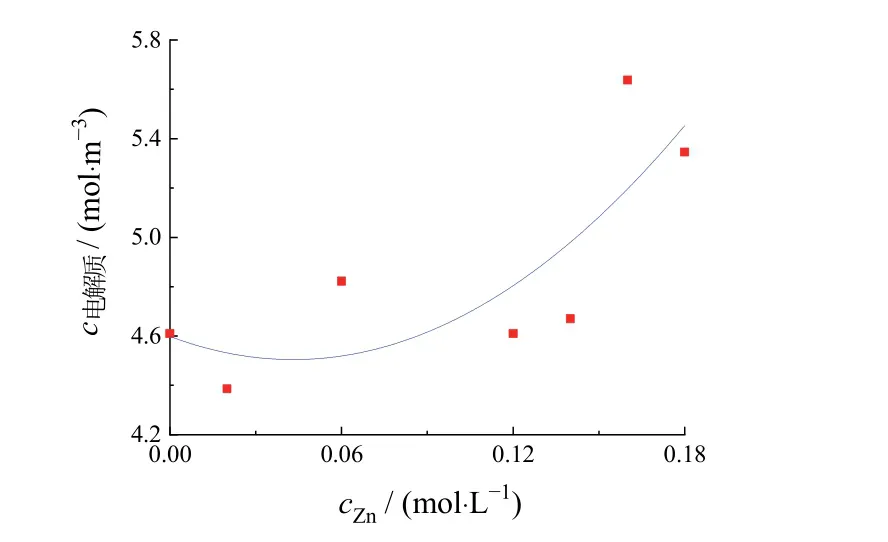
图9 锌离子浓度对电解质浓度的影响(x′ = 0 mm,t = 30 s)Figure 9 Effect of zinc ion concentration on electrolyte concentration (x′ = 0 mm, t = 30 s)
2.5 Cu离子浓度对电解质浓度变化的影响
图10示出了当电镀液中锌离子浓度为0.06 mol/L时,不同Cu离子浓度下的电解质浓度分布随时间的变化。为了更好地分析随电镀进行时电解质溶液的变化趋势,选取x在7.0~7.5 mm的曲线予以放大。
Cu离子浓度对电解质浓度的影响明显不同于Zn离子,表现在电镀前后电解质浓度在阴阳极板间的 分布有明显变化。阴极附近(x′ = 1.2~2.4 mm)的电解质浓度在t= 0 s时逐渐增大。图10a显示,在不含铜离子的情况下,电解液中的金属离子仅为0.06 mol/L的锌离子。随着电解时间的延长,阳极材料Cn0.7Zn0.3不断溶解产生铜、锌离子。在浓度差及电场的作用下,金属离子不断向阴极迁移。因此出现阴极处(x′ = 0 mm)的电解质浓度随电镀时间延长而增大的现象。阴阳极间电解质浓度分布的总趋势为:随着与阴极表面的距离x′的增大,电解质浓度由最大值以抛物线的形式先降低后升高,最后达到一个相对稳定的值。
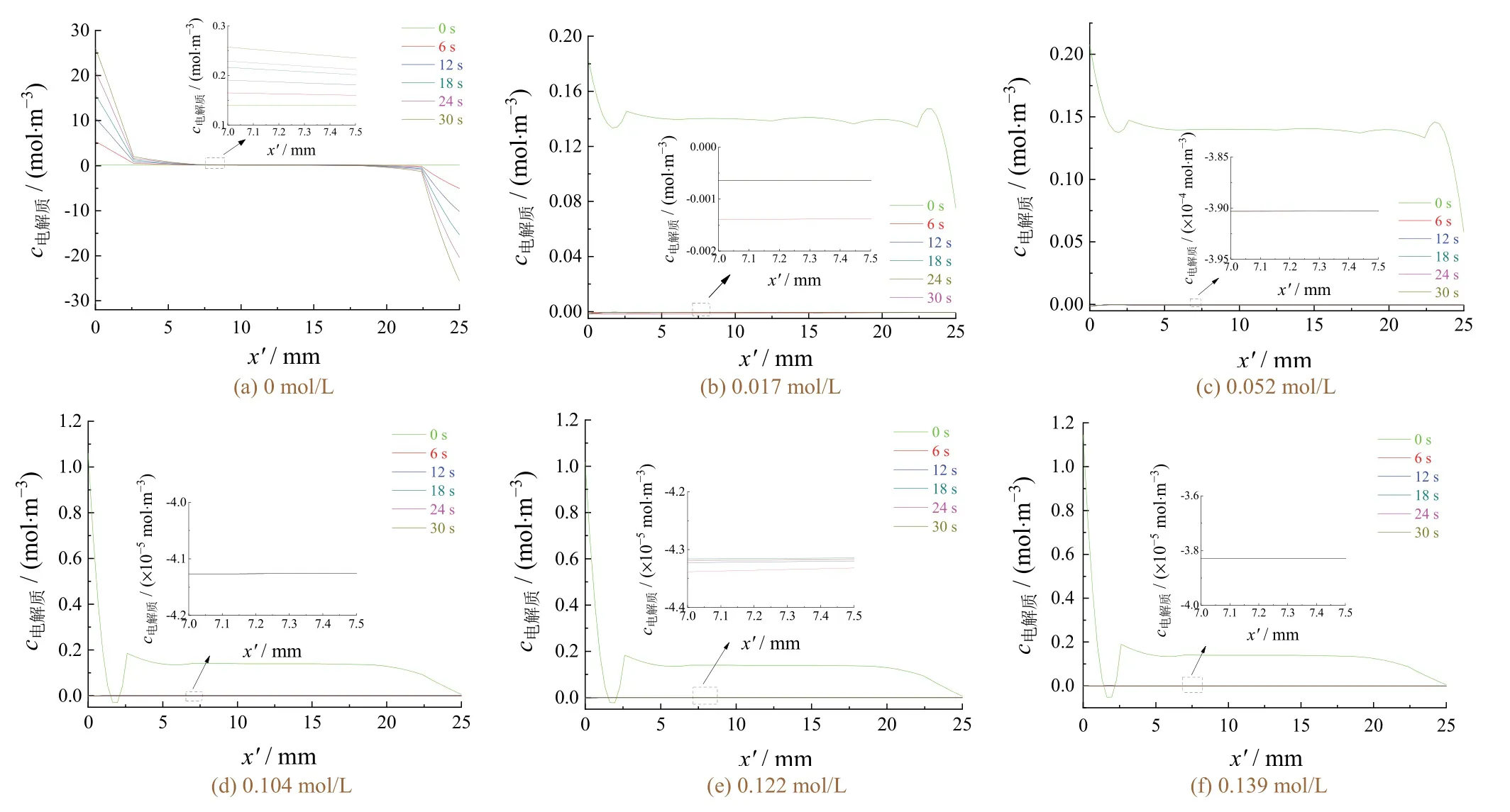
图10 不同铜离子浓度下电解质浓度的分布 Figure 10 Distribution of electrolyte concentration under different concentrations of copper ions
电解质浓度随电镀时间的延长而迅速降低,说明铜离子在该体系中的沉积速率较快,沉积量也较大。当x′在7.0~7.5 mm范围内,在铜离子浓度小于0.052 mol/L的情况下,电解质浓度随电镀的进行而快速降至零附近,说明此浓度下铜不断在阴极沉积。当铜离子浓度继续从0.104 mol/L增大到0.139 mol/L时,电镀进行到30 s时,电解质浓度在x′ = 7.0~7.5 mm内基本不变,电解质浓度无减小趋势。
图11表示了在电镀时间为30 s时,阴极表面(x′ = 0 mm)的电解质浓度随铜离子浓度增加的变化。从中可见电解质浓度随铜离子浓度增大先减小,而后逐渐趋于稳定。
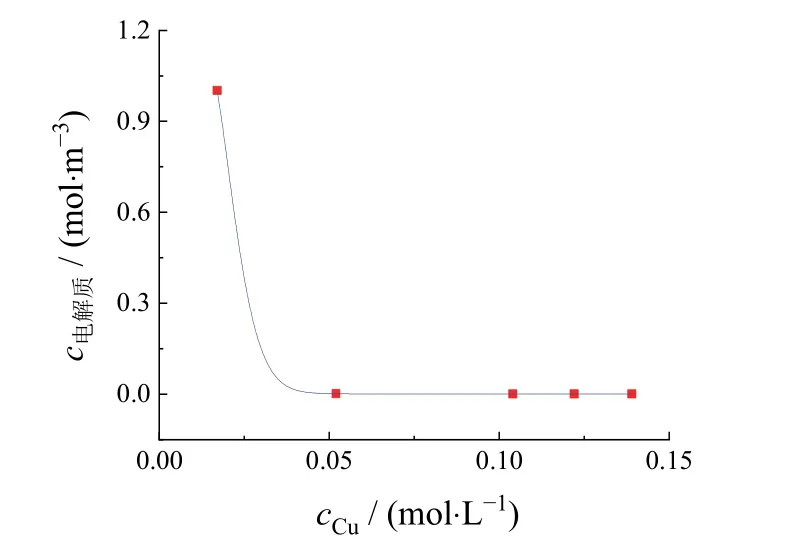
图11 铜离子浓度对电解质浓度的影响(x′ = 0 mm,t = 30 s)Figure 11 Effect of copper ion concentration on electrolyte concentration (x′ = 0 mm, t = 30 s)
对比不同铜锌离子对电解质浓度分布的影响可知,铜离子在该体系中更容易发生电沉积。在0 s时,电解液的分布趋势基本一致。在电解液中含等物质的量的铜、锌离子时,随着电镀的进行,含铜离子的电解质浓度比含锌的电解质浓度小,显然铜离子易发生沉积。电镀进行到30 s时含铜离子的电解液中离子由阳极向阴极迁移也说明了这一点。
3 结论
本研究通过Comsol多物理场软件对Cu-Zn合金电沉积过程进行微元计算和物理场耦合,模拟不同浓度Cu、Zn离子对镀层厚度及电解质浓度的影响。
分析2种离子的阴极边界镀层厚度分布曲线后发现,镀层厚度沿阴极片垂直方向自下而上呈对数型减小趋势,在阴极上呈现出边缘厚、中间薄的趋势。这是由边缘效应(即电场分布和镀液浓度场分布)所引起的。同时很明显的是模拟的镀层厚度曲线并不平滑,即镀层厚度并不均匀,这符合实际情况。
从铜、锌离子浓度增加时对应的电解质浓度变化的趋势来看,铜离子在该体系中更容易发生电沉积。
通过对模拟结果分析,结合电沉积的镀层与电解液的浓度分布数据进行统计,得出所研究的酒石酸钾钠体系中电镀铜锌合金的最佳主盐浓度为:硫酸铜0.052 mol/L,硫酸锌0.06 mol/L。
