传统发酵食品中乳酸菌的安全性评估
2021-06-30万倩李启明吴华星刘绒梅曹珺黄晓英于基成唐俊妮
万倩,李启明,吴华星,刘绒梅,曹珺,黄晓英,于基成,唐俊妮
(1.西南民族大学食品科学与技术学院,西南民族大学青藏高原动物遗传资源保护与利用教育部重点实验室,四川成都 610041)
(2.乳品营养与功能四川省重点实验室,新希望乳业股份有限公司,四川省优质乳品制备与质量控制技术工程实验室,四川成都 610023)
(3.大连民族大学生物技术与资源利用教育部重点实验室,沈阳大连 116600)
乳酸菌(lactic acid bacteria,LAB)是一类革兰氏阳性、无芽孢、厌氧或兼性需氧球菌或杆状菌,乳酸是其碳水化合物代谢的主要发酵产物之一[1]。人类日常食物中的奶类、肉类、豆类、蔬菜类等都可以利用乳酸菌进行发酵生产出具有特殊风味和益生特性的食品,同时,乳酸菌在代谢过程中会产生有机酸和细菌素等抗微生物活性物质来抑制致腐菌和致病菌的生长繁殖,对于食品的长期储存具有重要的实际应用意义。
长期以来,乳酸菌以其公认的安全(Generally recognized as safe,GRAS)微生物的地位在世界范围内被广泛应用于食品发酵[2]。然而,近年来大量研究报道显示乳酸菌也面临着一些安全问题,其中最主要的安全隐患是乳酸菌的耐药性。Sharma等[3]通过研究发现从商业益生菌制剂中分离的大多数乳酸菌菌株对一些最常用的抗生素表现为多重耐药性。Li等[4]在分离自中国不同地区发酵乳制品的保加利亚乳杆菌和嗜热链球菌中检测到磺胺异噁唑、链霉素和庆大霉素耐药基因。一些乳酸菌甚至可能通过水平基因转移将其固有的抗生素抗性基因转移到其他共生乳酸菌或病原体中[5],进一步揭示食物链是抗生素耐药性从其它生物细菌种群向人类细菌种群传播的关键途径之一[6],也意味着乳酸菌耐药性的出现可能会对人类健康造成威胁。此外,有学者对不同食物来源的乳酸菌进行了安全性评价,发现有少量乳酸菌具有溶解羊血和液化明胶的能力[7]。并且由乳酸菌引起的感染事件如新生儿菌血症等也值得关注[8,9]。因此,对于没有长期安全使用历史的乳酸菌进行安全性评估极为重要,尤其是对从传统非商业化发酵食品中分离和筛选的乳酸菌,由于其生存环境较为复杂,当要将其运用于新的食品发酵生产时,都应综合考虑其可能引发的安全性问题。
为了解中国传统发酵食品所分离的乳酸菌的安全情况,本文对从传统非商业化发酵食品中分离的38株乳酸菌进行了初步体外安全性评价试验,主要包括耐药性试验和有毒代谢产物试验。研究结果为食用菌株安全评价体系的完善提供一定的理论参考。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源
试验所用38株乳酸菌菌株均由新希望乳业股份有限公司乳品营养与功能四川省重点实验室于2019年11月至2020年7月从全国不同地区传统非商业化发酵食品中分离鉴定所得,具体菌株来源详见表1。溶血、明胶、吲哚试验阳性对照菌株金黄色葡萄球菌ATCC 43300,以及药敏试验质控菌株金黄色葡萄球菌ATCC 25923和大肠杆菌ATCC 25922均由本实验室保存。

表1 试验菌株来源及编号Table 1 Sources of the experimental strains
1.1.2 试剂与培养基
哥伦比亚血琼脂基础(Columbia Blood Agar Base)、明胶生化管、蛋白胨水(色氨酸肉汤)、Kovacs氏靛基质试剂盒,购自海博生物技术有限公司;MRS肉汤,购自广东环凯微生物科技有限公司;无菌脱纤维羊血,购自平睿生物科技(北京)有限公司;抗菌药物药敏纸片,购自杭州微生物试剂有限公司;PCR引物、Ezup柱式细菌基因组DNA抽提试剂盒,生工生物工程(上海)股份有限公司;Master Mix,北京擎科新业科技有限公司;1×TAE缓冲溶液、REGULAR AGAROSE G-10型琼脂糖,BIOWEST公司;GELVIEW核酸染料、DL2000Marker,宝生物工程(大连)有限公司。
1.1.3 仪器与设备
DYY-6C型电泳仪,购自北京六一仪器厂;WD800B型微波炉,购自顺德市格兰仕微波炉电器有限公司;PTC-200PCR仪、UniversalHoodⅡ型凝胶成像仪,均购自Bio-Rad公司;SW-CJ-2FD洁净工作台,购自苏净集团苏州安泰空气技术有限公司;UV-6100分光光度计,购自上海美普达仪器有限公司;GHP-9080水式恒温培养箱,购自上海齐欣科学仪器有限公司;AKHL-Ⅲ-24艾柯超纯水机(台湾艾柯),购自成都康宁实验专用纯水设备;MLS-3020电热自动灭菌锅,购自日本SANYO公司;5804R型Eppendorf冷冻离心机,Eppendorf中国有限公司。
1.2 试验方法
1.2.1 菌株的活化
将甘油保藏菌按2%接种量接种于MRS肉汤培养基中,于37 ℃恒温培养24 h,活化至少3代,于4 ℃保存备用。
1.2.2 有毒代谢产物检测试验
溶血试验和吲哚试验的详细操作步骤参照孟丹等[10]方法,明胶液化试验参照陈凯等[11]方法。以无菌MRS肉汤培养基为阴性对照组,溶血试验和明胶液化试验以金黄色葡萄球菌ATCC 43300为阳性对照组,吲哚试验以大肠杆菌ATCC 25922为阳性对照组。
1.2.3 药敏试验
药敏试验参照世界卫生组织(World Health Organization,WHO)推荐的K-B纸片扩散法进行操作,试验结果依据临床和实验室标准协会(Clinical and laboratory standards in stitute,CLSI)的标准进行判定[12],试验所用抗生素药物及含量见表2。
1.2.4 耐药基因检测试验
利用Ezup柱式细菌基因组DNA抽提试剂盒提取DNA。乳酸菌耐药基因的引物序列,退火温度,及扩增片段长度详见表3。

表3 PCR扩增耐药基因所用引物及扩增条件Table 3 Primers for screening antimicrobial resistance genes and PCR conditions used in this study
PCR反应体系为20 μL:Taq 1.1×T3 Super PCR Mix 17 μL,上下游引物各1 μL,DNA模板1 μL。PCR反应条件:98 ℃预变性2 min;98 ℃变性20 s,根据表2中退火温度退火10 s,72 ℃延伸30 s,共35个循环;72 ℃延伸2 min。PCR扩增产物于4 ℃保存。扩增产物利用1%的琼脂糖凝胶进行电泳,每孔加样4.5 μL。电泳条件为90 V,70 mA,45 min。最后利用凝胶成像系统观察并记录结果。
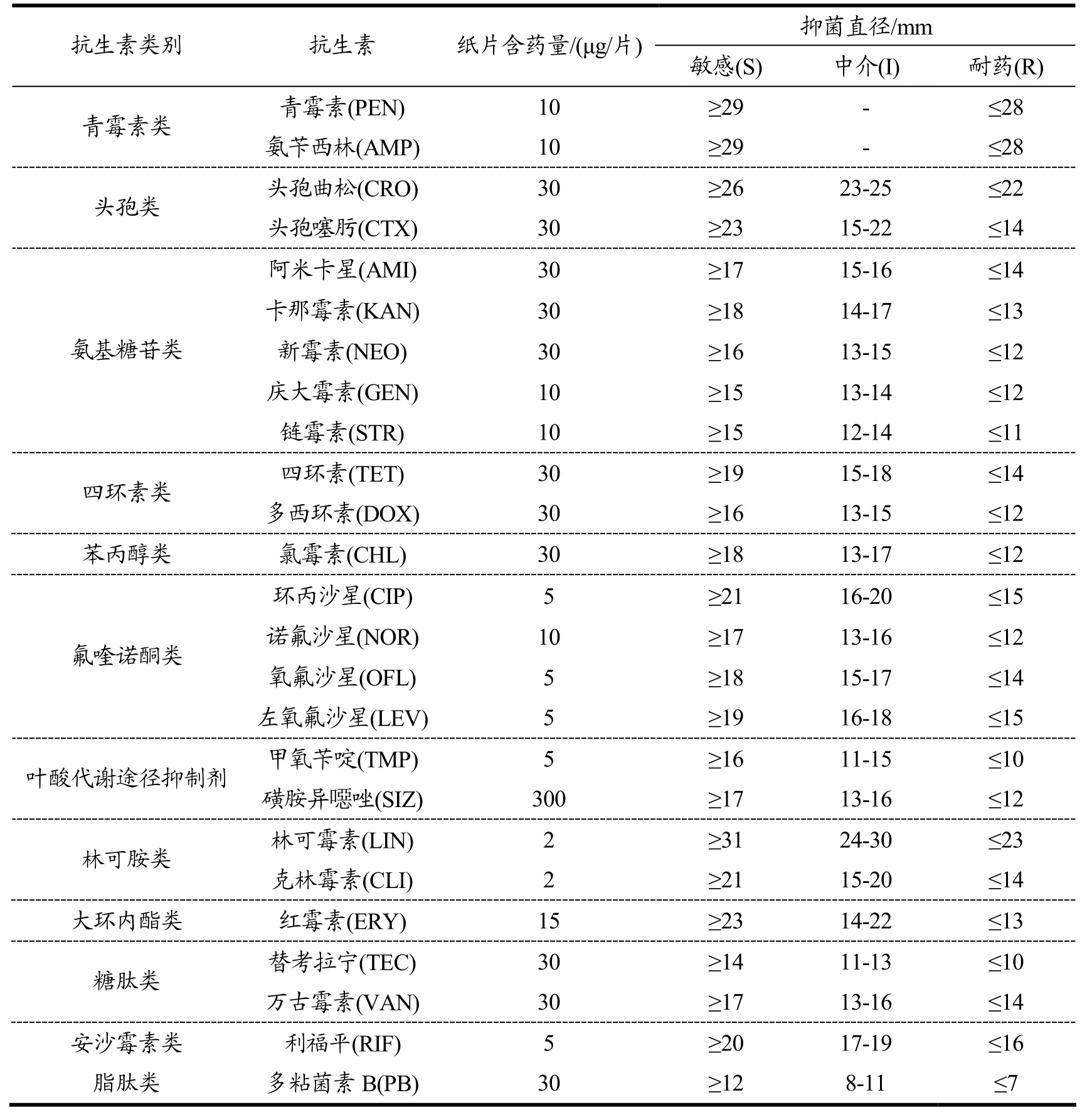
表2 本研究25种抗生素药物及其使用浓度Table 2 Antibiotic drugs used in this study and their concentrations
1.2.5 数据处理
资料录入、整理和分析釆用Excel 2019,统计学处理采用SPSS 25.0。
2 结果与分析
2.1 有毒代谢产物检测试验
2.1.1 溶血试验
如图1所示,供试菌株于血琼脂平板上37 ℃培养2 d后,阳性对照组金黄色葡萄球菌ATCC 43300菌落周围有透明环,即出现β-溶血,阴性对照组(MRS肉汤培养基)未长菌,而菌株G095、G002、Q026、Q016等菌落周围既无透明环,也未出现草绿色环(若菌落周围出现草绿色环为α-溶血),表明试验菌株没有溶血能力。本试验38株乳酸菌菌株均未出现溶血现象,说明本试验所有乳酸菌菌株均无溶血能力。

图1 溶血试验结果Fig.1 The results of hemolysis experiments
溶血活性的缺失确保了供试菌株的非毒力性质,这可以被视为潜在益生菌菌株的选择标准之一[17]。Nath等[18]对发酵乳制品中分离的一株植物乳杆菌溶血活性检测发现,菌落周围无溶血环。陈凯等[11]通过研究发现供试的两株乳酸菌(植物乳杆菌和干酪乳杆菌)在血平板上也无溶血现象。孟丹等[10]对一株乳酸乳球菌的溶血活性进行研究,结果表明其同样无溶血活性。本研究中38株乳酸菌溶血试验结果与文献中报道的结果一致。
2.1.2 明胶液化试验
供试菌株接入明胶生化管中30 ℃培养48 h后,再于4 ℃下静置2 h,阳性对照组金黄色葡萄球菌ATCC 43300呈液态,阴性对照组(MRS肉汤培养基)和38株乳酸菌仍然保持凝固状态。本试验38株乳酸菌菌株均未出现明胶液化现象,说明本试验所有乳酸菌菌株均不会产生明胶酶来分解明胶。与Goswami等[19]从印度阿萨姆邦传统油菜籽发酵食品中分离的乳酸菌明胶液化试验(结果为阴性)、Olubode等[20]从发酵牛乳中分离的乳酸菌液化明胶能力(结果为阴性)、Liu等[21]报道结果一致。进一步证实本研究从具有长期安全食用历史的传统发酵食品中分离的乳酸菌不存在液化明胶等相关安全隐患。
2.1.3 吲哚试验
供试菌株接入蛋白胨水(色氨酸肉汤)培养基中37 ℃培养72 h后,加入Kovacs氏靛基质试剂检测吲哚产生情况。阳性对照组大肠杆菌液面出现玫瑰红色,阴性对照组(MRS肉汤培养基)和38株乳酸菌仍然保持原来的颜色。本试验38株乳酸菌菌株均未产生吲哚类物质,说明本试验所有乳酸菌菌株在生长过程中不会代谢产生色氨酸酶分解蛋白胨中的色氨酸生成吲哚。Lin等[22]从台湾新竹县户口镇传统发酵芥菜制品中分离出来的乳杆菌属吲哚试验结果为阴性,即不产生吲哚类物质。王梦姣等[23]通过发现传统自然发酵马奶制品中分离的肠球菌属乳酸菌不会分解代谢色氨酸产生吲哚。本研究中38株乳酸菌吲哚试验现象和阴性对照组相同,与Lin[22]和王梦姣[23]对传统发酵食品中乳酸菌吲哚试验研究结果相一致。这说明本研究从传统发酵食品中分离的乳酸菌不会分解代谢色氨酸产生吲哚。
2.2 耐药性评估试验
2.2.1 药敏试验
如表4所示,38株乳酸菌对磺胺异噁唑(20/38,52.63%)耐药率最高,其次是卡那霉素(13/38,34.21%)、诺氟沙星(12/38,31.58%)、左氧氟沙星(12/38,31.58%)、替考拉宁(12/38,31.58%)、万古霉素(12/38,31.58%)、阿米卡星(10/38,26.32%)和林可霉素(10/38,26.32%)。相较之下,对环丙沙星(7/38,18.42%)、多粘菌素B(7/38,18.42%)、新霉素(6/38,15.79%)、链霉素(6/38,15.79%)、氧氟沙星(5/38,13.16%)、庆大霉素(3/38,7.89%)、氨苄西林(2/38,5.26%)、甲氧苄啶(2/38,5.26%)、利福平(1/38,2.63%)和青霉素(1/38,2.63%)抗性较低,所有乳酸菌菌株对头孢曲松、头孢噻肟、四环素、多西环素、氯霉素、克林霉素和红霉素敏感。

表4 本研究中38株乳酸菌对25种抗生素的耐药率Table 4 The resistance rates of 38 Lactic acid bacteria strains against 25 antibiotics in this study
Sharma等[24]对从商业益生菌制剂中分离的30株乳酸杆菌进行耐药性检测,研究发现乳酸菌对万古霉素、卡那霉素、替考拉宁、磺胺异噁唑、阿米卡星、链霉素和诺氟沙星具有较高的抗性,而对青霉素、四环素、左氧氟沙星、氯霉素、头孢噻肟、苯唑西林、氧氟沙星、环丙沙星、头孢曲松和氨苄西林耐药水平较低,且所有菌株均未对克林霉素、红霉素和多西环素耐药。Comunian等[25]对分离自意大利发酵食品中121株乳酸菌耐药性评估试验表明,70%以上乳酸菌对红霉素和四环素表现为敏感。董春阳等[26]从广州市售酸奶中分离得到48株乳酸菌,药敏试验结果显示乳酸菌对卡那霉素、链霉素和磺胺异噁唑的耐药率达到80%以上,对庆大霉素、环丙沙星和万古霉素耐药率为54.17%~35.42%,对四环素、氨苄西林、青霉素、氯霉素、氨苄西林、头孢噻肟、红霉素和利福平的耐药率较低或没有耐药性。许女等[27]的研究也表明乳酸菌对万古霉素、庆大霉素、卡那霉素、链霉素和替考拉宁的耐药率较高,对红霉素和甲氧苄啶较敏感。本研究中乳酸菌对磺胺异噁唑、卡那霉素、诺氟沙星、替考拉宁和万古霉素的高耐药率与先前的文献报道[24,26,27]相一致,而对左氧氟沙星的高耐药率与Sharma等[24]的研究结论相反,这可能主要与三大因素有关:其一是菌株来源的不同,本研究是从传统发酵食品中分离所得,而Sharma等是从商业益生菌制剂中分离所得;其二是乳酸菌的耐药性具有菌株特异性;其三是后天获得性耐药,具体作用机制还需要进一步探索。
植物乳杆菌对替考拉宁和万古霉素为完全耐药,对诺氟沙星耐药率为80%,对磺胺异噁唑和林可霉素耐药率为60%,对环丙沙星耐药率为40%,对卡那霉素和链霉素耐药率为30%,对左氧氟沙星耐药率为20%,对氧氟沙星和多粘菌素B耐药率为10%,对其余抗生素均表现为敏感。Turchi等[28]研究了从不同意大利食品来源(牛奶,奶酪,发酵肉制品)中分离出的42株植物乳杆菌耐药表型,所有菌株均对氯霉素、红霉素和四环素敏感或中度敏感,而对庆大霉素的耐药率为20.9%。许女等[27]对分离自传统发酵食品中的27株植物乳杆菌药敏结果显示,对庆大霉素的耐药率高达88.89%。本研究中植物乳杆菌对氯霉素、红霉素、四环素和庆大霉素均表现为敏感,前三种抗生素耐药表型和Turchi等[28]的研究结果相一致,而庆大霉素与上述文献报道[27]均存在差异,这说明植物乳杆菌对庆大霉素的耐药表型与食品来源及加工方式密切相关。
保加利亚乳杆菌对磺胺异噁唑耐药率最高(92.31%),其次依次是左氧氟沙星(61.53%)、卡那霉素(46.15%)、阿米卡星(30.77%)、氧氟沙星(30.77%)、多粘菌素B(30.77%)、新霉素(23.08%)、诺氟沙星(23.08%)、庆大霉素(15.38%)和环丙沙星(15.38%),对其余抗生素均表现为敏感。Guo等[29]对分离自传统乳制品的保加利亚乳杆菌进行耐药性研究,结果显示所有保加利亚乳杆菌对庆大霉素、红霉素、克林霉素、新霉素、四环素、氯霉素、利福平表现为敏感,而对卡那霉素、环丙沙星、链霉素、甲氧苄啶、氨苄西林和万古霉素产生不同的抗性。本研究中所有保加利亚乳杆菌对红霉素、克林霉素、四环素、氯霉素、利福平的耐药表型和Guo等[29]的研究结果相一致,前四种抗生素的作用机制主要是与抑制微生物蛋白质合成有关[30,31]。而本次试验对庆大霉素、新霉素、链霉素、甲氧苄啶、氨苄西林和万古霉素的耐药情况与Guo等报道结果差异较大,再结合石磊等[32]对保加利亚乳杆菌的药敏试验结果,可以推测保加利亚乳杆菌对万古霉素可能并不是固有耐药。此外,本研究中乳酸杆菌对磺胺异噁唑耐药严重,可能与缺少叶酸代谢途径有关。
嗜热链球菌对阿米卡星的耐药率是62.50%,对卡那霉素的耐药率是50.00%,对新霉素和链霉素的耐药率是37.50%,对氨苄西林、左氧氟沙星、甲氧苄啶、磺胺异噁唑、替考拉宁、万古霉素和多粘菌素B的耐药率为25.00%,对青霉素、庆大霉素、环丙沙星、诺氟沙星和氧氟沙星耐药率为12.50%。石磊[32]和Temmerman[33]的研究发现,嗜热链球菌对卡那霉素的耐药率极高,本研究中的嗜热链球菌对卡那霉素同样表现为较高的抗性,可能由于细菌过度表达氨基糖苷修饰酶进而诱发对氨基糖苷类药物的抗性机制。
乳酸乳球菌对林可霉素的耐药率最高(66.67%),对阿米卡星和利福平的耐药率为16.67%,对其它抗生素为完全敏感。乳酸明串珠菌对25种抗生素均表现为敏感。Singh等[34]从奶酪、生牛乳、当地市场牛奶等乳制品中分离出65株乳球菌菌株,药敏试验观察到所有菌株对氨苄西林和万古霉素敏感(除一株),而对其余抗生素表现为不同程度的耐药性,对链霉素、甲氧苄啶、卡那霉素、替考拉宁、诺氟沙星、阿米卡星和利福平的耐药频率最高,而对青霉素、头孢唑林、庆大霉素、四环素、克林霉素和诺维菌素等抗生素的耐药水平中等,对阿莫西林、氨苄西林、红霉素、万古霉素、氧氟沙星和氯霉素的耐药水平最低。除此之外,乳酸乳球菌对氯霉素、四环素、克林霉素、阿米卡星、诺氟沙星、利福平和红霉素等呈现出不同程度的耐药水平也有在Devirgiliis[35]和Khemariya[36]的文献中被报道过。本次试验中乳酸乳球菌呈现的耐药情况良好,说明不同来源的乳酸乳球菌耐药性差异比较大,但具体的作用机理还需未来进一步研究。
如表5所示,38株乳酸菌菌株对25种抗生素具有不同的耐药谱。16株(16/38,42.11%)乳酸菌具有多重耐药性(抗3类及以上抗生素),其中,7株植物乳杆菌(7/38,18.42%)均表现为抗3类及以上抗生素,即植物乳杆菌耐药性较强,这与许女等[27]从传统发酵食品和Lavilla-Lerma等[37]从西班牙农家山羊奶酪中分离的植物乳杆菌多重耐药现象严重等结果相符。保加利亚乳杆菌和嗜热链球菌不同菌株之间的耐药谱差异较大,如G018(只对一类抗生素耐药)和Q024(对所有抗生素敏感),而G097和Q019能够耐受5类及以上抗生素。而所有乳酸乳球菌和乳酸明串珠菌均未表现出多重耐药现象。本试验中不同乳酸菌的耐药谱差异较大,其中以植物乳杆菌的多重耐药现象较为严重,分析可能原因是植物乳杆菌大多分离于农家泡菜,由于操作和环境等间接导致植物乳杆菌获得性耐药。

表5 不同乳酸菌的多重耐药率Table 5 Multi-drug resistance rates of lactic acid bacteria strains
2.2.2 耐药基因检测试验
如表6所示,在38株乳酸菌菌株中,tetS和tetM两种四环素耐药基因的检出率为0;有1株嗜热链球菌携带氯霉素耐药基因catA,检出率为2.63%;有1株乳酸乳球菌和1株乳酸明串珠菌检出携带万古霉素耐药基因vanA,检出率为5.26%;利福平耐药基因rpoB检出率最高(16,42.11%);其中乳酸明串珠菌同时携带vanA和rpoB两种耐药基因。检出结果显示乳酸菌携带rpoB耐药基因的比率较高。于涛等[38]对分离自市售酸奶中乳酸菌的耐药基因进行检测,结果显示56株乳酸菌菌株均未检测到tetS和vanA耐药基因,仅有3株保加利亚乳杆菌检测到tetM基因,tetM基因的检出率较低。Li等[4]通过调查中国发酵乳制品中的87株乳酸菌耐药基因携带情况,结果显示仅有两株保加利亚乳杆菌和两株嗜热链球菌携带tetM基因,并且采用滤膜结合试验证明了tetM基因不会发生转移。然而,Nawaz等[39]的研究发现植物乳杆菌NWL22和短乳杆菌NWL59中的tetM基因可通过过滤器交配成功转移至粪肠球菌181。此外,由于不同乳酸菌中许多抗性基因中的核苷酸序列差异,利用PCR技术可能无法在该属不同物种之间检测到这些基因[40]。综合上述文献报道分析,本研究中所有乳酸菌菌株虽未检测到tetS和tetM两种四环素耐药基因,与于涛[38]和Li[4]的研究结果存在相似性,但仍需要结合全基因组序列分析,以进一步阐明抗性机制。
Campedelli等[41]的研究结果显示,161株乳酸菌中有34株携带氯霉素耐药基因。张丹青[42]等对五株嗜热链球菌的氯霉素耐药基因cat进行检测,结果表明嗜热链球菌基因组DNA上不存在cat耐药基因。Rojo-Bezares等[15]对从葡萄酒中分离出的乳酸菌菌株进行耐药性评估,发现乳酸菌株中不存在catA基因。本研究中耐药基因catA的低检出率(2.63%)与上述文献报道相一致。于涛[38]和Liu[43]分别对奶源和牛源乳酸菌进行耐药基因检测,结果表明两种不同来源乳酸菌中均未检测到耐药基因vanA。而本次试验中耐药基因vanA的检出率较低,仅有1株乳酸乳球菌和1株乳酸明串珠菌携带基因vanA,与之前报道结果略微不同,可能与乳酸菌获得万古霉素抗性有关[44]。Guo等[29]对分离自传统乳制品中的20株保加利亚乳杆菌进行耐药性评估试验,结果显示有7株乳杆菌携带利福平耐药基因rpoB,并且通过使用滤膜结合试验发现检测到的抗生素抗性基因不会转移到受体细菌。本研究中耐药基因rpoB的高检出率与Guo等的研究结果相似,并且本试验中绝大多数保加利亚乳杆菌都能检测出利福平耐药基因rpoB(除1株外),这个现象应引起注意,未来可以在这方面进一步开展相关机制研究。
结合表4和表6,菌株携带的耐药基因tetS、tetM和catA与耐药表型之间呈现一定的对应关系,如,38株乳酸菌菌株均对四环素表现为敏感,且不携带四环素耐药基因(tetS和tetM);所有乳酸菌菌株均对氯霉素表现为敏感,而乳酸菌均未检测出携带基因catA(除1株嗜热链球菌Q027外)。但也有部分菌株的耐药表型与基因型不存在对应关系,如植物乳杆菌均对万古霉素耐药,但植物乳杆菌中并未检测出vanA基因;多数乳酸菌对利福平表现为敏感(除1株乳酸乳球菌外),却在16株乳酸菌检测出基因rpoB基因,这表明万古霉素和利福平耐药菌株还存在其它耐药机制,也意味着乳酸菌对某些抗生素耐药的遗传基础和机制尚不清楚,未来还需要进一步加强乳酸菌耐药表型及耐药机理等方面的深入研究。

表6 38株乳酸菌菌株来源及耐药基因检出情况Table 6 Source information of 38 lactic acid bacteria strains and detection of drug resistance genes
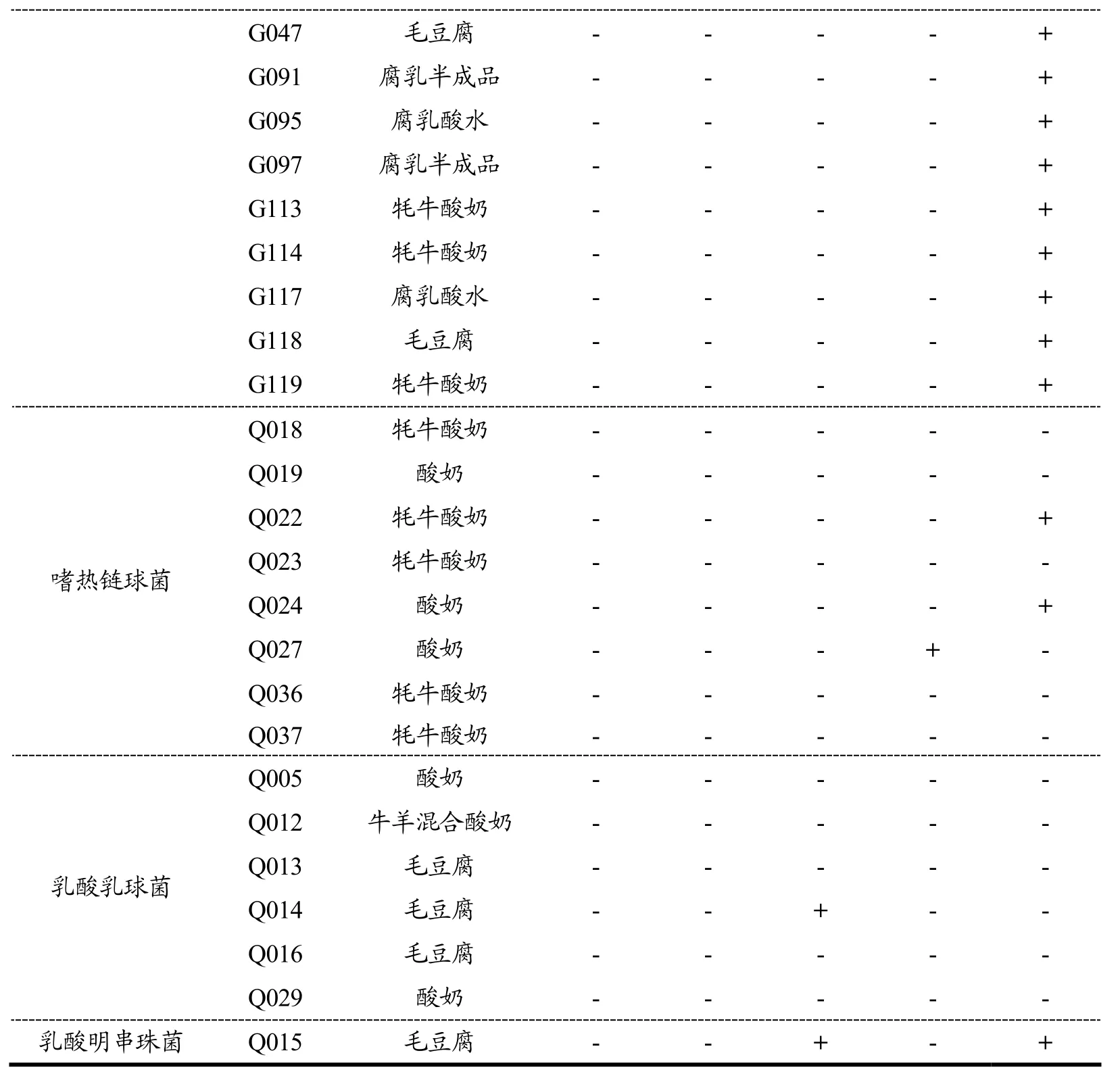
注:表中“+”表示阳性,即存在该耐药基因,“-”表示阴性,即不存在该耐药基因。
3 结论
长期以来,乳酸菌以其公认的安全(Generally recognized as safe,GRAS)微生物的地位在世界范围内被广泛应用于食品发酵。然而,随着抗生素滥用现象的不断发生,越来越多的乳酸菌具有耐药性或者携带耐药基因,给人类的健康带来安全隐患,因此需要对其进行安全性评估。本研究中38株乳酸菌对25种抗生素呈现出不同的耐药谱,以及携带部分耐药基因,结合先前的文献报道微生物可以利用乳酸菌作为耐药基因储存库,将其耐药基因转移给肠道致病菌,说明存在一定的安全隐患,需要引起重视。未来的研究应确定发酵产品制造过程中导致乳酸菌获得性耐药的因素,从而能够针对这一问题制定有效的预防策略。
