横梗霉产酯化酶的纯化及酶学性质
2021-06-30钟利明曹新志李书源张锴正胡琴
钟利明,曹新志,李书源,张锴正,胡琴
(1.四川轻化工大学生物工程学院,四川自贡 6430001)(2.宜宾五粮液股份有限公司,四川宜宾 644007)
大曲中的微生物的种类非常多,在其中有许多重要的产酯化酶的菌其中包括霉菌,在乙醇和己酸反应时的时候使用酯化酶进行催化合成己酸乙酯[1]。乙酸乙酯、乳酸乙酯、乙酯[2]都是呈香物质。酯类物质在窖内发酵过程中生成所需要的时间较长[3],所以我们使用酶法发酵就可以使得反应的转换率更高,还可以使得反应的副产物更加的少[4]。通过筛选代谢活力高的产酯化酶菌株,提高己酸乙酯的生成,进而达到优化酒质、缩短发酵周期的目的[5]。现在的大多数的实验数据是研究的红曲霉、酵母的使用以及各种条件的优化和其他应用。研究表明,可以产生酯化酶的微生物有霉菌、酵母、细菌中均有存在。来源不同的酯化酶其性质不同,会被浓度,反应的底物影响[6]。因此,探索纯化酯化酶的分离纯化及酯化酶的酶学性质,就能有针对性让酯化酶技术更好的为白酒生产服务[7]。
在中国的白酒市场上销量以及产量浓香型白酒占据了70%左右。由于在浓香型白酒的生产过程中需要窖泥中许多的微生物参与其中并且相互作用,在酿造浓香型白酒的过程当中使用固态、厌氧半自然发酵进行生产[8]。浓香型白酒在窖内发酵进行的时候,生产周期较长的酯类[9],由于产生酯类的转化率高,所以酯化酶有着广泛的运用[10]。研究酯化酶在浓香型白酒中的应用可以提升白酒品质为其他研究奠定基础[11]。
本实验选取在五粮液大曲中经过严格筛选得到的一株高产酯化酶的横梗霉进行研究,研究该横梗霉发酵液产生的酯化酶,对发酵液进行分离纯化得到高纯度的酯化酶,纯化过程首先进行硫酸铵盐析沉淀,然后是透析之后在离心,最后进行离子交换层析和凝胶过滤层析,经过这一系列的纯化步骤之后得到纯度较高的酯化酶,对纯化以后的酶进行酶学性质的研究,为酯化酶在浓香型白酒的研究应用当中提供一定的理论基础。
1 材料与方法
1.1 材料
横梗霉:从五粮液大曲中分离筛选,结合霉菌的菌落的形态特征以及分子生物学鉴定得到产酯化酶的菌株为横梗霉。
发酵培养基(g/L):橄榄油1.0,蛋白胨1.0,KH2PO40.2,MgSO4·7H2O 0.05,KCl 0.05,FeSO40.001,(NH4)2SO40.2。
1.2 方法
1.2.1 横梗霉发酵
使用优化后的发酵培养基发酵培养12 h的菌株,恒温培养,温度为28 ℃、转速为180 r/m,96 h后过滤发酵液,得到发酵酶液。
1.2.2 硫酸铵沉淀
饱和条件下,于10 mL粗酶液中分别加入(0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%)的硫酸铵,冰浴条件下辅以磁力搅拌[12]。将盐析后的发酵液,在转速5000 r/min的转速下低速离心15 min,取沉淀将沉淀置于pH为7.0的PB缓冲液(20 mmol/L)中反应,反应后测量酶活大小。在所有浓度的硫酸铵反应之后,使用最优的浓度进行硫酸铵盐析,并取盐析后的酶液进行下一步的纯化。
1.2.3 透析
盐析以后的酶液加入到处理好的透析袋当中,加入缓冲液在冰浴条件下复议磁力搅拌进行透析,在透析的时候需要每2.5 h更换一次缓冲液,在7.5 h后停止透析[13]。
1.2.4 透析袋的处理
裁剪透析袋,在Na2HCO3(10 mmol/L)和乙二胺四乙酸二钠(1 mmol/L)放入裁剪好的透析袋煮沸,15 min后,用蒸馏水清洗干净。
1.2.5 粗酶液的浓缩
取15 mL透析之后的酶液倒入超滤离心管(截流量5000 u),在转速为4000 r/min低速离心25 min后,继续使用截流液,继续进行离心,到截流液的体积为最小的时候停止[14]。
将得到的最后的截流液经过滤膜(0.45 μm)过滤去除一部分的杂质。
1.2.6 离子交换层析
选用DEAE纤维素-52层析柱进行阴离子层析,来分离酯化酶粗酶,280 nm波长检测吸光光度,步骤如下所示:
a平衡:平衡液流速为1 mL/min,8倍柱体积的平衡缓冲液冲洗,直到紫外和导电的基线稳定为止。
b上样:柱子平衡后用Loop自动进样,上样前样品需经0.22 μm滤头过滤除杂。为了使样品能够与填料充分融合,样品上柱前需要进行盐析处理并降低上样流速至0.5 mL/min。
c洗脱:上样完后,继续洗脱,到基线稳定,以上过程流速皆为1 mL/min。
d清洗:每次使用完后,使用1 mol/L的NaOH溶液洗脱5~10倍柱体积,去除结合牢固的杂质,再使用去离子水洗脱至基线平稳,用2 mol/L的NaCl溶液冲洗10倍柱体积对Q柱进行复性处理,去离子水冲洗至电导平稳后即可用20%的乙醇冲洗。
1.2.7 凝胶过滤层析
凝胶过滤层析Sephadex G-75(Φ1.6×50 cm)在加入酯化酶样品以前使用Tis-HCl缓冲液(0.05 mol/L pH 8.2)流速为0.3 mL/min进行平衡。将处理平衡好的层析柱中加入2 mL含酯化酶样品经过超滤浓缩以后倒入层析柱,用0.05 mol/L pH 8.2的Tis-HCl缓冲液洗脱,并测定其酶活,合并活性洗脱峰后备用[15]。
1.2.8 酶活测定-紫外分光光度法
缓冲液:在0.02 mol/L的Na2HPO4-柠檬酸缓冲液中加入0.001%阿拉伯胶混合溶解。
底物溶液:3 mg棕榈酸对硝基苯酯加入到1 mL异丙醇搅拌溶解,再进行超声溶解1 min。
测定方法:将50 μL底物溶液和400 μL缓冲液搅拌混合均匀,温度为50 ℃下预热5 min,然后再加0.5 mL 0.5 mol/L碳酸钠溶液,空白对照组加入失去酶活的酶液。测量三次取平均值。
定义:1 min、1 mL的底物溶液释放1 μmol对硝基苯酚,为一个酶活单位,计算方法如下[16]:
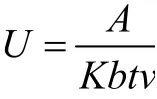
式中:U:酶活力;K:摩尔吸光系数;b:吸收层厚度;t:反应时间;v:反应体系体积。
1.3 酶学性质的研究
1.3.1 酯化酶最适温度
分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃,pH 7.0的条件下测定其反应活力,比较得出最适的酯化酶反应温度。
1.3.2 酯化酶的温度稳定性
分别将酶液(45 μg/mL)在20~60 ℃温度范围内放置反应一定的时间,一定时间内保温后测定残留的酯化酶活性,测定方法同上。
1.3.3 酯化酶的最适pH
选择pH 3.0~8.0(3、4、5、6、7、8)Na2HPO4-柠檬酸缓冲溶液,50 ℃预热5 min后测定反应混合物中的酶活,比较得出最适的酯化酶反应pH。
1.3.4 酯化酶的pH稳定性
将酶液置于20 mmol/L Na2HPO4-柠檬酸缓冲溶液(pH 3.0~7.0)中,均匀混合,50 ℃恒温保存一定时间后测定残留活性。
1.3.5 金属离子对酯化酶的影响
分别用pH 5.0 20 mmol/L的Na2HPO4-柠檬酸缓冲溶液配制2 mmol/L金属离子(Fe2+、Mg2+、Zn2+、Mn2+、Cu2+、Ni2+、Co2+、Ca2+),再将酶液与缓冲液混合,50 ℃保温30 min检测酶活,不同金属对活力的影响。对照组不加入金属离子。
1.3.6 数据处理
实验结果通过Excel 2013对数据进行统计分析,将各个指标用SPSS进行方差分析(ANOVA),用多重比较法分析差异显著性,其中p<0.05表示差异显著。使用Origin 2018软件作图。
2 结果与分析
2.1 纯化
2.1.1 硫酸铵沉淀
于50 mL的发酵液中添加不同饱和度的硫酸铵,结果如图1所示。
由图1可知,进行盐析沉淀,将发酵液与硫酸铵溶液混合。将反应后的反应液进行离心,将离心后的溶液去除上清液,加入磷酸缓冲液,计算测量酶活。在酶的纯化过程当中其他的杂蛋白会对酯化酶的纯化造成影响,所以本次实验将采用分级沉淀的方法进行盐析。由图1可知上清液的酶活力最适宜的是范围是20%~40%,由此可以推断杂蛋白开始发生沉淀是在浓度为20%时的硫酸铵溶液,随着硫酸铵的浓度不断变大杂蛋白的不断析出。将杂蛋白析出后继续进行反应。硫酸铵的浓度不断升高,析出目的酶,导致了酶活力降低。因此选择40%进行后续的研究。由于在发酵液当中有着很多其他的杂蛋白,这些杂蛋白对之后的酯化酶的纯化会产生影响,需要使用分级沉淀,由于前期杂蛋白被析出之后,后期的酶活力取出来杂蛋白的影响,所以酶活力才会保持在较高的值,但是过高的饱和度在将杂蛋白析出之后,会继续将目标的酯化酶也析出,所以选取过大的饱和度并不适宜,因此选择40%的饱和度为最适宜的盐析浓度,再后续研究中使用。
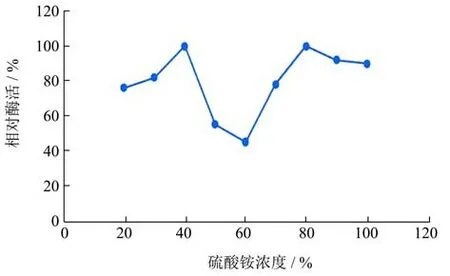
图1 硫酸铵沉淀最适饱和度Fig.1 Optimal saturation of ammonium sulfate precipitation
2.1.2 DEAE-纤维素52
将100 mL浓缩液中的不溶物离心去掉,再进一步纯化。离子交换柱:DEAE-Sepharose Fast Flow。绘制层析曲线如图2。
由图2可知,Tris缓冲洗脱液(0.01 mol/L)能洗脱多于或为一种的微量蛋白组分。使用0~1mol/L NaCl溶液洗脱出来两种蛋白。通过对洗脱出的蛋白酶活检测得到,除第二洗脱峰外均没有活性,即DEAE-52离子交换色谱介质能有效吸附酯化酶,使其与杂蛋白分离。两吸收峰能基本重叠,且峰型达到对称状态,基线约为0,及此时的目标蛋白具有较高的纯度。刘瑞娟[17]等人研究碱性脂肪酶时发现使用DEAESepharose Fast Flow离子交换层析的时候具有三个洗脱峰且第三个洗脱峰具有活性并且与280 nm吸收峰是重合的。所以得出使用DEAE-52进行酯化酶的纯化是可行的。
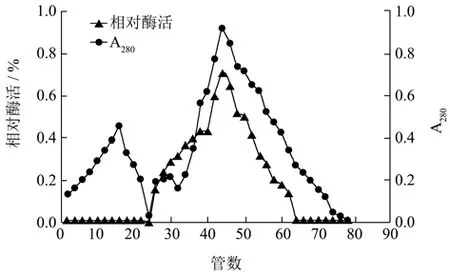
图2 离子交换层析洗脱曲线Fig.2 Ion exchange chromatography on DEAE-52
2.1.3 Sephadex G-100
将进行了离子层析后的反应液继续进行纯化。使用缓冲液进行纯化,并且每4 mL为一组进行测量280 nm的数值,绘制出图3。由实验数据可得,洗脱的过程当中出现了两个洗脱峰,经过测定第二个是目标酶,洗脱峰的峰型对称且基线接近0,可以将其与其他的杂蛋白区别开,所以可以使用Sephadex G-100凝胶进行进一步的纯化。

图3 SephadexG-100凝胶曲线Fig.3 Gel filtration chromatography on Sephadex G-100
在洗脱过程中发现,酯化酶出现了2个蛋白峰,且第二个的峰型呈对称状态,基线基本为零,与另一蛋白组分能有效分离,经酶活性检测可知,其为活性组分。说明Sephadex-100能有效分离纯化经DEAE-52离子交换后的酯化酶。
2.1.4 酯化酶纯化回收情况
通过分析检测横梗霉发酵液所产生的酯化酶在纯化过程中的总活力值、总蛋白值、活力比值、活力回收率及纯化倍数等指标,得到酯化酶的纯化表。见表1。
由表1可知,横梗霉发酵液通过不断的纯化之后,其纯化结果得到明显的优化。总活力由6426.6 U/mg降低至172.16 U/mg,总蛋白降低到0.02 U/mg,比活力由241.32 U/mg上升至8608.06 U/mg,回收率达到2.54%,纯化倍数优化至35.66。

表1 横梗霉所产脂肪酶纯化结果Table 1 Purification results of lipase produced by Lichtheimia
2.1.5 SDS-PAGE凝胶电泳
横梗霉酯化酶发酵上清纯化步骤后,其纯化倍数达35.66倍,活性回收率为2.54%比中DEAE-纤维素-52离子交换层析结果最佳,纯化效果见表4,纯化后的是单一条带,见图4,相对分子质量43000 u。

图4 12 g/dL SDS-PAGE电泳图谱Fig.4 12 g/dL SDS-PAGE of enzyme solution
2.2 酶学性质
2.2.1 酯化酶的最适温度
为得到,在pH 7.0的条件,温度分别为20 ℃~100℃(每10 ℃设置一个实验组),检测酯化酶的活力。结果如图5。

图5 酯化酶的最适作用温度Fig.5 Optimum temperature of esterification enzyme
实验的数据分析之后得到,该酯化酶在25 ℃~ 40℃温度范围内酶活较高,在30 ℃时的相对酶活为67.92%比20 ℃的48.89%有了明显的上升,而且在40℃时相对酶活最高。50 ℃后相对酶活为75.31%开始急剧下降,60 ℃的时候只有43.98%的相对酶活,在70 ℃的时候更是下降到了27.96%的酶活,当80 ℃时仅有7.65%,由此可知酯化酶最适反应温度40 ℃。刘光[18]等人研究发现在脂肪酶的生产过程中通常的温度不高于40 ℃,最适宜的反应温度是30 ℃左右,他筛选得出的是低温的脂肪酶,没有很好的耐热性。与本实验得到的酯化酶的反应最适宜温度类似,表明了酯化酶的不耐热性。
2.2.2 温度对酯化酶稳定性的影响
20~60 ℃保温,检测残留的酯化酶活性。结果如图6。
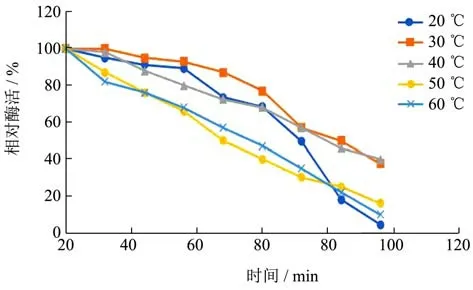
图6 酯化酶的温度稳定性Fig.6 Temperature stability of esterase
在酯化酶的最适温度的研究时发现,酯化酶没有很好的耐热性,温度过高会使酯化酶的失去活性。将横梗霉所产生的酯化酶在相同时间下,横梗霉所产酯化酶的相对酶活随温度的增加相对降低;同温度下,随着时间的延长,酶活性呈降低趋势。在20 ℃时,保温0~30 min,酶活力降低不明显(p>0.05),12 min时的相对酶活为94.97%,在24 min后仅降低到了91.12%,活性并没有很大的变化,在36 min后酶活为89.31%,在36 min的时间内酶活力都保存90%左右,36 min后酶活开始下降,48 min的酶活73.31%,60 min降低到68.31%,72 min后明显的下降49.49%,在84 min后,失去酶活的活性82.09%。在30 ℃的温度下0~36 min内的酶活力的降低比较小维持在92%,在24 min后酶活为94.98%,36 min后的酶活92.98%,48 min后的酶活开始有了明显的下降,在60 min的时候酶活76.96%,到72 min后的酶活下降到了56.97%,在96 min后的酶活为37.43%。在40 ℃时,保温36 min~96 min,酶活力下降显著(p<0.05),12 min后的酶活力97.97%而24 min后酶活就降低至87.86%在36 min保持79%的酶活力,在72 min的时候酶活下降至56.98%,96 min时的酶失活。在50 ℃下,酶活在12 min后酶活86.97%,24 min后的酶活仅75.97%,在36 min的酶活力65.97%酶活力由显著降低至84 min的24.98%。60 ℃时,12 min后的酶活就只有81.97%在36 h后仅有67.97%,72 min后的酶活下降至34.86%。表面了该酯化酶没有很好的耐热性。刘光[18]等人研究发现在通常的产业当中的酶在50 ℃就会丧失活性,而在他的实验中所得到的脂肪酶是低温的脂肪酶具有适用于洗涤剂以及其他添加剂的能力并且与本实验得到的酯化酶的不耐热性相似。
2.2.3 酯化酶的最适pH
选择20 mmol/L Na2HPO4-柠檬酸缓冲溶液(pH 3.0~8.0)(3、4、5、6、7、8)为缓冲体系,反应混合物50 ℃预热5 min后测定酶活,比较得出酯化酶反应中的最适pH值,结果如图7所示。

图7 酯化酶的最适作用pHFig.7 Optimum action of esterification enzyme pH
实验得出,在pH 5.0~10.6范围内,酯化酶均有活性呈先增大后降低的趋势。且在pH为7.5时,酶活性达到最高为100%。pH 3~pH 7.5的时候酶活呈上升趋势,pH 3的时候相对酶活为3.01%,上升至pH 4.0的时候相对酶活为8.97%,pH 5.0时的酶活15.95%上升到pH为6.5时,保持57%的酶活,pH 7.0时,保持88%的酶活,pH 8~9的时候酶活力开始下降,pH 8的时候下降至酶活力77.86%,pH 9.0的时候酶活力仅有63%。吕梅[19]等人研究的酯酶在pH改变的条件下,酯酶的活性也发生改变,在pH为6的时候酯酶的活性只具有60%左右,在酸性的条件下不适合酯酶保持活力,得出在碱性条件下更加的适合酯酶生长。所以得出结论酯化酶在碱性条件下更加的适合。研究发现主要可能是因为介质的酸碱度会被pH的改变而影响,导致酶活性中心的基团解离的程度有了改变,进而导致底物与酶的结合状态发生了改变,使得酶的催化发生了改变。酯化酶在酸性的条件下酯化酶的活性中心的基团发生解离,使得底物与酶的结合发生了改变,影响了底物的结合,说明pH的改变对酶的影响显著,且酯化酶适合在碱性条件下发生反应,且最适的反应pH为7.5。
2.2.4 pH对酯化酶稳定性的影响
分别将1 mL酶液与19 mL的不同pH磷酸缓冲液(pH 5.0~9.0)均匀混合,25 ℃恒温保存96 h,5 min取一次样测定其酶活。结果如图8。
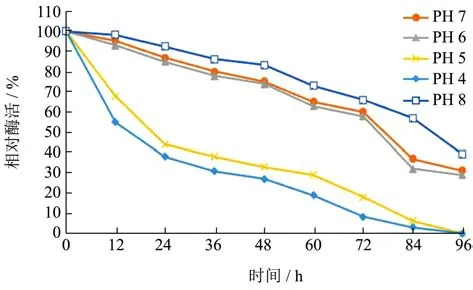
图8 酯化酶的pH 稳定性Fig.8 pH stability of esterase
如图8所示,由图可知碱性范围内,酯化酶能具有良好的稳定性。在pH 4 12 h后的活性仅剩下54.97%,24 h后的酶活为38.02%,36 h后下降至30.86%,72 h后仅仅保持了8.21%的相对酶活。在pH 5 12 h后的相对酶活为67.83%,24 h后下降至43.92%,72 h后的酶活仅剩下17.91%。但是在pH 6 12 h后酶活还有93.01%,24 h后还有84.94%的相对酶活,72 h后任然具有57.81%的相对酶活,84 h后酶活降低至32.01%。在pH 7 12 h后的酶活为95.31%,24 h后的酶活为86.96%,36 h后的酶活依旧还有80.05%,48 h后的酶活为75.1%,96 h后还具有31.09%的酶活,pH 8.0 84 h时仍具有可保持56%的活性。pH 5.0保存84 h下,活性降低94%。刘瑞娟[17]筛选出的菌株所产的酶具有良好的耐碱性,84 h时,分别在pH 8.0及9.0条件下保持55%、42%的酶活,pH 5.0时仅保持活性值为6%。与本实验研究酯化酶的pH稳定性所得到的结论在碱性的环境下更加适合酯化酶的生长结论相似,表明酯化酶具有良好的耐碱性,酸性条件下不适合酯化酶的生存。
2.2.5 金属离子对酯化酶稳定性的影响
为探究金属离子对酯化酶的影响,用20 mmol/L pH 5.0 Na2HPO4-柠檬酸缓冲溶液分别配制2 mmol/L金属离子(Fe2+,Mg2+、Zn2+、Mn2+、Cu2+、Ni2+、Co2+、Ca2+)。如图9所示。

图9 金属离子对酯酶活性的影响Fig.9 Effects of metal irons on the esterase activities
研究表明,酶的活性中心的改变会被金属离子所影响,导致酶的活性受到促进或者会抑制酶的活性,实验数据表明,加入了Mg2+、Ca2+后的相对酶活无明显的变化,说明Mg2+、Ca2+对酶活性无显著影响,而在加入了Fe2+后的相对酶活为76%,加入Zn2+后的相对酶活为65%,加入Mn2+后的相对酶活为86%,加入Cu2+后的相对酶活为19%,所以得出结论Fe2+、Zn2+、Mn2+、Cu2+抑制作用不同,其中Cu2+的抑制效果最显著,酶活性丧失80%以上。这可能是由于Cu2+影响了酯化酶催化活性中心。这与王春雨[20]研究低温脂肪酶受金属离子影响的结果相似。表明了实验结果Cu2+影响了酯化酶的活性中心。
3 结论
使用横梗霉进行发酵产生酯化酶,并对酯化酶发酵液进行分离纯化,纯化步骤首先使用40%饱和度的硫酸铵盐析沉淀,然后进行透析,之后进行离心,最后使用DEAE-纤维素-52离子交换层析和Sephadex G-100凝胶过滤层析。较粗酶液增加了35.66倍,而活性回收率由100%降低至2.54%,相对分子质量为43000 u。使用纯化后的酯化酶用于酶学性质的研究,得出酯化酶的最适宜的反应温度为40 ℃,耐热性不好,60 ℃处理30 min仅残留67.97%酶活性。酯化酶在碱性条件下比较适合生长,最适pH是7.5。以及对酯化酶有抑制作用的金属离子有Mn2+、Fe2+、Cu2+、Zn2+。所以该酯化酶具有高产、耐碱、热敏性高的特点,在食品、酿酒、洗涤等产业有着很好的应用前景。
致谢
感谢五粮液股份有限公司给本项目(CXY2019 ZR012)提供的经费。
