分子动力学模拟研究壳寡糖与脂肪酶相互作用机制
2021-06-30杨宝燕郑敦锦何康平江文豪沈锐锋吕咏锶罗幸林罗佳伟陈胤熹郑少鹏郝锦亨陈梓诗曹诗林
杨宝燕,郑敦锦,何康平,江文豪,沈锐锋,吕咏锶,罗幸林,罗佳伟,陈胤熹,郑少鹏,郝锦亨,陈梓诗,曹诗林,3,4
(1.佛山科学技术学院食品科学与工程学院,广东佛山 528000)(2.暨南大学理工学院,广东广州 510632)
(3.华南理工大学食品科学与工程学院,广东广州 510640)
(4.可持续生物化学与合成生物工程中心,佛山无远生物科技有限公司,广东佛山 528000)
近年来,蛋白质-多糖相互作用的研究引起了人们的关注。多糖可以通过共价交联[1]和非共价相互作用[2]包裹蛋白质。多糖可作为蛋白质和酶的载体,促进蛋白质药物治疗[3]和提高酶的催化性能[4]。
壳聚糖是由D-glucosamine(D-氨基葡萄糖)为单位,以β-(1-4)连接组成的一种阳离子多糖,并广泛应用于生物医学和生物催化。但由于其结构特点,传统壳聚糖的溶解需要溶解在稀酸水溶液中,因此其进一步的应用受到限制。壳聚糖低聚物(OCTS)是由2~50个残基组成,具有良好的水溶性。南极假丝酵母脂肪酶B(CaLB)是应用最广泛的脂肪酶之一。CaLB具有很多特性,例如,有比较严格的底物选择性、底物特异性,较宽的pH稳定范围等特点。该酶在生物合成[5]、生物柴油[6]、生物制药[7]等领域具有广阔的应用前景。游离脂肪酶不稳定,易失活。研究表明壳聚糖和甲壳素类材料作为载体固定化酶可以提高酶的稳定性和催化性能[8,9]。了解酶与壳聚糖的相互作用对设计高性能的酶-壳聚糖生物催化剂具有重要意义。目前,酶与壳聚糖衍生物相互作用的研究主要集中在实验领域,仍然缺乏在原子水平上的相互作用机制研究。分子动力学模拟是以经典力学、量子学为基础,利用计算机得到分子轨迹的过程,并分析其结构性质,简单来说,分子动力学模拟是将肉眼能见宏观上的生物大分子变成动态,由此我们可以观察到分子在不同时间分子里的变化过程,同时能够提供生物大分子动态变化的数据。分子动力学模拟是研究分子间相互作用的有效方法。然而,对壳聚糖与蛋白质相互作用的分子动力学模拟,特别是对壳聚糖与酶相互作用的分子动力学模拟研究较少。
本文通过分子模拟研究了南极假丝酵母脂肪酶B(CaLB)与壳聚糖低聚物(OCTS)装配体的结构与构象,考察CaLB与OCTS之间的相互作用对脂肪酶结构的影响规律。CaLB-OCTS与底物分子(4-硝基笨对棕榈酸酯)进行分子对接分析,根据酶与底物的反应机理结合形成酶-底物复合物,对该复合物进行构象评分,获得构象较合理的对接模型,分析比较合理的对接结果中酶蛋白与底物相互作用力,从而更加深入地了解酶蛋白与催化底物的结合方式。本文所建立的模拟方法,不仅可以用于酶与壳聚糖衍生物的相互作用研究,也可为蛋白质-多糖相互作用研究提供更多的借鉴。
1 材料与方法
1.1 试验材料
1.1.1 结构数据
南极假丝酵母脂肪酶:来源于Protein Date Bank数据库(ID:1TCA),壳寡糖、4-硝基对棕榈酸酯:通过作图软件获得。
1.1.2 分子动力学模拟工具以及分析工具
Gromacs 4.5.3[10,11]、Pymol(三维结构显示软件)、Autodock-Vina[12](酶分子与底物分子进行分子对接)、蛋白质配体相互作用分析器(Protein-ligand Interaction Profiler,PLIP)[13]。其中AutodockVina与PLIP模块经本课题组二次开发,分别部署在https://atomevo.com/autodock-vina与https://atomevo.com/plip[18]。以上两个模块均免费开放给公众使用。
1.2 试验设计
南极假丝酵母脂肪酶B(Candida antarctica Lipase B,CaLB)的FASTA序列来源于蛋白数据库(PDB代码:1TCA)。
使用Gromacs 4.5.3软件包进行分子动力学模拟[10,11]。在分子动力学模拟过程中,将1TCA置于一个立方体盒的中心,其中1TCA与OCTS距离盒边缘1 nm。体系中含有1个1TCA脂肪酶分子和一定数量的OCTS。首先,将整个系统在303.15 K下进行50000步的能量最小化(EM)。然后,通过位置约束的MD模拟,通过NVT系综(粒子数量、体积和温度恒定),再通过NPT系综(粒子数量、压力和温度恒定)来平衡溶剂和蛋白脂肪酶分子周围的离子。经过平衡后,在303.15 K下进行40 ns的分子动力学模拟,模拟后输出数据进行分析。
1.3 数据处理
1.3.1 南极假丝酵母脂肪酶(CaLB)与低聚壳聚糖组装(OCTS)分析
势能分析:分析了0~40 ns模拟中CaLB与OCTS之间的库仑相互作用和L-J相互作用。氢键分析:对0~40 ns范围内的CaLB-溶剂对和CaLB-OCTS对进行氢键数分析,并分别计算了CaLB-溶剂对和CaLBOCTS组装体在前0.10 ns和后0.10 ns的平均氢键数。溶剂可达面积(SASA)分析:计算0~40 ns时CaLB和CaLB-OCTS的疏水性、亲水性和总溶剂可达面积。CaLB与14个OCTS分子质心(COM)的平均距离分析:首先计算各OCTS分子质心与CaLB在0~40 ns模拟时间内的距离,然后计算平均值。
1.3.2 南极假丝酵母脂肪酶总体构象变化
均方根波动(RMSF)分析:对CaLB和CaLB-OCTS的每个残基对计算平均RMSF。均方根(Root-mean-square deviation,RMSD)分析:计算部分区域的RMSD,包括helix区域(Lys13-Gly19),(Val139-Leu147),(Gly226-Arg242),loop区域(Gly95-Pro100),(Gly217-Ala225)。用Pymol软件计算了CaLB和CaLB-OCTS的二级结构。然后分别计算游离CaLB和CaLB-OCTS中α-helix、Sheet和loop的数量。
1.3.3 CaLB和OCTS之间接触位点分析
用Pymol法计算并鉴定了与OCTS结合的CaLB的氨基酸组成和残基数。
1.3.4 CaLB活性位点OCTS分析
活性中心入口开放状态分析:0~40 ns计算片段质心(Val139-Leu147)与片段质心(Leu277-Gly288)之间的距离。活性口袋结构分析:分别测定Ser105残基与中结合口袋(Gly39、Thr42、Ser47、Trp104、Ala225)、大结合口袋(Ala141、Leu144、Val154、Ile285、Pro289、Lys290)和酰基结合口袋(Asp134、Thr138、Gln157、Ile189、Val190)之间的距离。并在此基础上,研究了游离CaLB和CaLB-OCTS口袋结构的差异。
1.3.5 CaLB与底物4-硝基笨对棕榈酸酯分子对接分析
通过阅读文献找出脂肪酶的活性中心以及活性口袋,用Pymol软件打开经过40 ns模拟的CaLB-OCTS的PDB,并建立活性中心盒子,记录盒子参数。用ChemBraw绘出脂肪酶催化反应底物4-硝基笨对棕榈酸酯,进行能量最小化后以PDB文件输出,运用Pymol软件对其进行加氢等操作。将CaLB的PDB文件、4-硝基笨对棕榈酸酯PDB文件以盒子参数上传至Autodock-Vina,以CaLB为受体,底物为配体进行分子对接,结合能小于0表示受体和配体能自由结合,分析结果显示结合能越小则表示对接得越好。将对接后模型进行XScore评分,评分显示的结果越高表示对接越好。随后,将对接后评分较好的受体-配体模型以PDB文件输出并上传至PLIP,进行对接结果作用力(氢键作用力、疏水作用力)的分析。
1.3.6 数据分析与作图
以上所得数据使用WPS进行归纳汇总与分析,并使用python的matplotlib模块,编写画图脚本将所得数据作图。
2 结果与讨论
2.1 CaLB和OCTS自组装过程分析
2.1.1 L-J势能和库伦势能分析
图1 展示了CaLB与OCTS之间库仑相互作用和L-J相互作用的能量变化。如图1所示,模拟过程的库仑势能和L-J势能均显著降低,在4 ns模拟时达到-1200 kJ/mol左右。随后,这两种能量继续下降,但库仑相互作用下降趋势更加明显,在12 ns左右达到-2100 kJ/mol左右,而在6 ns左右,L-J势能下降到-1400 kJ/mol左右。在6~40 ns时,L-J势能在-1230~-1800 kJ/mol之间变化,而在12~40 ns时,静电势能在-2200~-2820 kJ/mol之间。在40 ns模拟过程中,L-J势能和库仑势能分别降低了约1480 kJ/mol和2324.0 kJ/mol。这些结果表明,CaLB和OCTS之间的静电和L-J相互作用在自组装过程的初始阶段(0~4 ns)起着重要的作用。随着OCTS接近CaLB,静电相互作用增强,并成为组装的关键驱动力。

图1 模拟过程中脂肪酶和OCTS相互作用的能量分析Fig.1 Energy analysis of the interaction between lipase and OCTS during simulation
2.1.2 氢键分析
如图2a所示,分析40 ns模拟过程中的氢键数。在前0.10 ns脂肪酶蛋白与溶液的初始氢键数约为368。随后,氢键数在模拟过程中逐渐减少,在模拟结束时(后0.10 ns),脂肪酶蛋白与溶液的氢键数约为335。此外,在模拟期间,脂肪酶蛋白和OCTS之间的平均氢键数从0增加到约17。这些结果表明OCTS可以与脂肪酶形成氢键并取代脂肪酶和溶剂之间的部分氢键。这有助于增加脂肪酶的结构稳定性。

图2 模拟过程中氢键分析(图a)、脂肪酶和OCTS在40 ns模拟过程中的溶剂可及面积分析(图b,c)Fig.2 Hydrogen bond analysis during simulation (a), the solvent accessible surface (SASA) analysis of CaLB and OCTS during 40 ns simulation (b, c)
2.1.3 CaLB和OCTS溶剂可及面积及质心距离的分析
图2 b、c显示了脂肪酶和OCTS的溶剂可及面积(SASA)分析。结果表明,在0~4 ns时,脂肪酶和OCTS的SASA均显着下降。脂肪酶的SASA从约130 nm2减少到约110 nm2,而OCTS的SASA从115 nm2减少到95 nm2。在4~40 ns期间,脂肪酶和OCTS的SASA分别在110~100 nm2和100~90 nm2之间变化。该结果同样表明,在0~4 ns时,OCTS与脂肪酶相互靠近,因此SASA同步下降并降幅较大,而4~40 ns时,脂肪酶和OCTS主要进行自组装过程的结构调整和平衡。
为了进一步阐明这种观点,本研究对模拟时间内脂肪酶和OCTS分子的质心(COM)的平均距离进行了进一步分析(图3)。该分析结果表明,在0~4 ns期间,COM的平均距离显著下降了0.50 nm。随后,在随后的12~40 ns期间,COM的平均距离在2.70和3.10 nm之间波动,以进行结构重新调整。
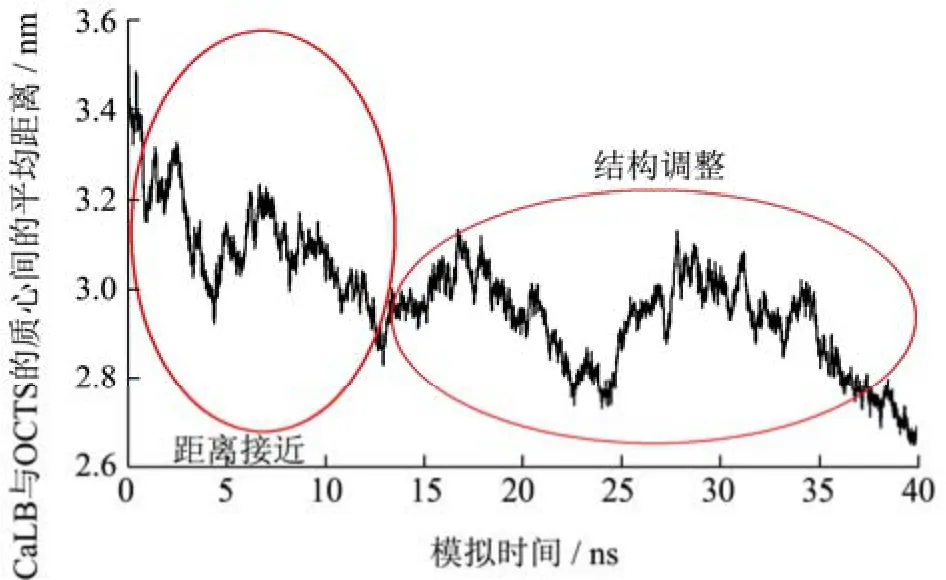
图3 脂肪酶和OCTS质心之间的平均距离Fig.3 The average distance between the COM of CaLB and OCTS
酶与多寡糖之间存在非共价相互作用,包括静电相互作用、疏水相互作用、氢键相互作用等。结果表明,装配过程可以描述为:OCTS与CaLB之间的距离越来越近,因此CaLB和OCTS之间的可及面积明显降低以及CaLB-OCTS之间的平均COM显著降低。除此之外,CaLB与OCTS之间的氢键数量随着CaLB与溶剂之间氢键数量的减少而增加。在这个自组装过程的初始阶段,CaLB和OCTS之间的静电和L-J相互作用起着重要的作用。随后,静电相互作用成为主导。以往的文献表明,当蛋白质与带电荷的多糖类相互作用时,静电作用占优势[14]。自组装后,可以观察到CaLB和OCTS组装的结构调整过程。
2.2 CaLB与OCTS组装体的整体构象
2.2.1 均方根偏差和原子波动分析
均方根偏差(RMSD)分析可以揭示OCTS对脂肪酶的结构稳定性的影响。CaLB-OCTS的RMSD的平均值约为0.22 nm,脂肪酶的RMSD的平均值约为0.18 nm。该结果表明,在模拟期间内,OCTS存在下脂肪酶的RMSD无明显变化,脂肪酶与OCTS相互作用后保持其原始构象。
为了考察OCTS对CaLB柔韧性的影响,图4对比分析了游离CaLB和CaLB-OCTS的均方根波动(RMSF)分析。一般来说,残基的RMSF在CaLB和CaLB-OCTS组装体中表现出相同的趋势。在有OCTS存在的情况下,helix(α-螺旋)区域(Lys13-Gly19)的波动更大,说明该区域在CaLB-OCTS组装体中比游离CaLB具有更大的柔韧性。此外,CaLB-OCTS组装体的loop(无规卷曲)区域(Gly95-Pro100)和(Gly217-Ala225)以及helix区域(Val139-Leu147)和(Gly226-Arg242)比游离CaLB的波动更小。

图4 脂肪酶和CaLB-OCTS的原子波动值(RMSF)Fig.4 RMSF analysis of the CaLB and CaLB-OCTS
研究表明,蛋白质的稳定性与结构的柔韧性呈负相关[15]。表1分析了上述区间的RMSD。结果显示CaLB-OCTS组装体酶中α1区域的平均RMSD为约0.17 nm,而游离CaLB的该数据为0.12 nm。这表明CaLB-OCTS组装体酶中α1(13-19)的RMSD值的增加归因于RMSF值的增加。此外,CaLB-OCTS组装体酶的loop(95-100)、loop(217-225)、α5(139-147)、α9(226-242)区域的RMSD值都低于游离脂肪酶模拟体系。这表明这些区域RMSF值的降低导致了CaLB-OCTS组装体酶种这些结构区域的RMSD值的降低。

表1 脂肪酶在α1、α5、α9、loop95-100、loop217-225区域的均方根偏差(RMSD)分析Table 1 The RMSD data of the helix region α1, α5, α9, and loop region (Gly95-Pro100), (Gly217-Ala225)
2.2.2 CaLB-OCTS和游离脂肪酶的二级结构分析
进行游离CaLB和CaLB-OCTS的二级结构含量分析。如图5所示,脂肪酶与OCTS组装后,CaLB-OCTS的α-螺旋含量从41.00%略微上升至41.32%,而β-折叠含量从9.78%增加至12.62%,无规卷曲loop从49.21%下降至46.50%。对β-折叠的进一步分析表明,脂肪酶中的β-折叠Leu20-Cys22在CaLB-OCTS结构中延长至Leu20-Gln23,同时β-折叠Pro33-Pro38延长至β-折叠Lys32-Pro38(图6)。此外,CaLB-OCTS出现了两个新的β-折叠结构,分别为β-折叠(Gly307-Thr310)和β-折叠(Gly313-Val315)(图7),而根据pymol软件的分析,游离CaLB在这些结构区域中未发现β-折叠结构。

图5 CaLB-OCTS组装体和游离CaLB的二级结构分析Fig.5 Secondary structure analysis of the CaLB-OCTS and CaLB

图6 CaLB-OCTS(b)和游离CaLB(a)中β-折叠(Leu20-Cys22,Pro33-Pro38)二级结构变化Fig.6 Secondary structure change of the Sheet (Leu20-Cys22,Pro33-Pro38) in CaLB-OCTS (b) and CaLB (a)

图7 CaLB-OCTS(b)和游离CaLB(a)中β-折叠(Gly313-Val315,Gly307-Thr310)二级结构的变化Fig.7 Secondary structure change of the (Gly313-Val315,Gly307-Thr310) in CaLB-OCTS (b) and CaLB (a)
该结果表明CaLB和OCTS之间的相互作用促进了无规卷曲结构向β-折叠结构的转化。这个结果与之前的实验研究是一致的[16]。这些研究表明,蛋白质与壳聚糖/壳聚糖衍生物之间的相互作用改变了蛋白质的二级结构,尤其是环状结构。
2.3 CaLB与OCTS接触位点分析
CaLB的FASTA序列表明,在脂肪酶表面存在许多酸性氨基酸残基,包括带负电荷的4个谷氨酸残基(Glu81、Glu188、Glu269、Glu294)以及14个天冬氨酸残基(Asp6、Asp17、Asp49、Asp74、Asp126、Asp134、Asp145、Asp187、Asp200、Asp223、Asp252、Asp257、Asp265、Asp296)。由于OCTS带有正电荷,因此,脂肪酶和OCTS之间存在静电相互作用。分子模拟40 ns后,14个OCTS分子与CaLB组装。如图8a所示,分析了CaLB与OCTS发生接触的氨基酸残基。有7个Asp残基和2个Glu残基分别附着在8个OCTS分子上,这些氨基酸残基与OCTS电荷相反。该残基分别为Asp17、Asp134、Asp145、Asp187、Asp252、Asp257、Asp265、Glu269、Glu188。在本文中,CaLB和OCTS分别带1个负电荷和5个正电荷。因此,CaLB-OCTS组装体为69个带正电的净电荷。由此,CaLB-OCTS组装体可能在溶液中是可溶的复合物。
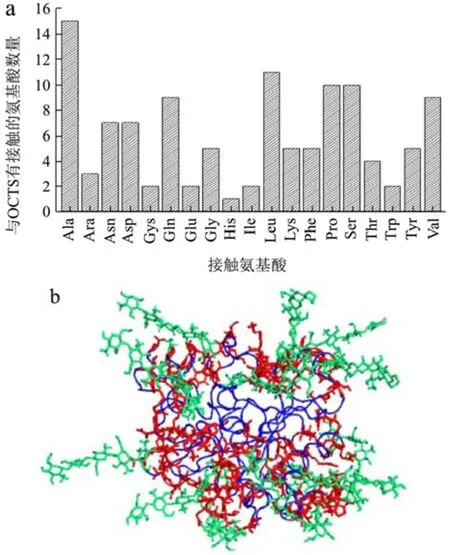
图8 CaLB中与OCTS发生接触的残基数目(a)、OCTS与14个CaLB组装体示意图(b)Fig.8 The number of the residues attached with OCTS (a), The scheme of the CaLB assembled with 14 OCTS (b)
2.4 OCTS对CaLB活性位点可及性的影响
脂肪酶的底物可及性可以通过Val139-Leu147和Leu277-Gly288(图9)两组螺旋结构的构象变化来表征。因此计算了Val139-Leu147的质心与Leu277-Gly288质心的距离(COMAccess)。研究表明,活性位点入口可以定义为COMAccess<1.5 nm的封闭状态,中间状态和开放状态分别为1.5

图9 脂肪酶的活性位点入口示意图Fig.9 The scheme of active site entrance of CaLB

图10 CaLB-OCTS组装体与游离脂肪酶活性位点入口的质心距离Fig.10 Distance between the COM of CalB-OCTS and CalB
为了表征底物结合口袋的构象变化,计算丝氨酸Ser105残基与下面的口袋之间的距离,如图11显示,大尺寸醇(图11a)结合口袋(含有Ala141、Leu144、Val154、Ile285、Pro289、Lys290);中尺寸醇(图11b)结合口袋(含有Gly39、Thr42、Ser47、Trp104、Ala225);酰基(图11c)结合口袋(由Asp134、Thr138、Gln157、Ile189、Val190组成)。对比CaLB-OCTS和游离CaLB的底物口袋表明,两者的底物口袋的距离差值均低于0.31 nm,表明底物结合口袋的结构基本保持一致。

图11 Ser105残基与结合口袋的距离Fig.11 Distance between the C-a atom of the catalystic site Ser105 and the binding pocket
2.5 CaLB与底物4-硝基笨对棕榈酸酯分子对接
2.5.1 CaLB-OCTS与底物(4-硝基笨对棕榈酸酯)对接以及评分(XScore)

图12 底物与脂肪酶对接后的模型Fig.12 A model of substrate docking with lipase
将文中经0~40 ns模拟后CaLB-OCTS组装体进行加氢等处理,然后将底物对接到CaLB的活性部位,表2显示的是其对接结果,对接软件自动对接出9种配体-受体复合物对接结果,并分别对这9中复合物进行XScore评分,评分是对对接的配体-受体的复合物的构象或其匹配程度进行评价,以判断对接结果的合理性,表3为评分结果。结果表明配体(4-硝基笨对棕榈酸酯)与脂肪酶分子形成稳定的复合物,它们的结合能均为负值,符合理论情况,且并具有良好的结合亲和性,其中最稳定的复合物的结合能为-6.1 kcal/mol。在XScore评分中,评分最高的是Mode 5的底物-酶蛋白复合物,如图5,结合能为-5.1 kcal/mol,该复合物的VDW即范德华相互作用能为699.3,HB即配体与蛋白的氢键相互作用为1.7,最终评分为5.89,表示了该底物-酶蛋白的构象具有合理性以及可靠性。为分析底物-酶蛋白复合物之间的相互作用力,故将Mode 5复合物进行PLIP作用力分析。

表2 Vina对接结果Table 2 Docking results

表3 XScore评分结果Table 3 XScore results
2.5.2 CaLB与底物对接后的作用力分析(PLIP)
表4 是模拟后的CaLB-OCTS蛋白酶与底物对接后评分最高的底物-酶复合物的相互作用力分析,查阅文献可知,CaLB的催化活性中心是由一个三联体(由Ser105、Asp187和His224构成)、一个氧负离子洞(Thr40和Gln106)以及活性口袋(醇结合口袋(含有Gly39、Thr42、Ser47、Trp104、Ala225、Ala141、Leu144、Val154、Ile285、Pro289、Lys290);酰基结合口袋(由Asp134、Thr138、Gln157、Ile189、Val190组成)构成,结果显示,底物对接进入CaLB活性口袋,其中残基Trp104、Asp134、Ala141、Ile189、Val190、Ala281、Ile285与底物分子存在着疏水作用,残基Thr40作为氢键供体与底物分子的氧原子形成氢键相互作用。此外,活性中心残基His224与底物之间直接形成盐桥和π-阳离子效应。由此表明,底物4-硝基笨对棕榈酸酯分子可在CaLB的催化活性位点处结合,彼此在结合过程中所产生的疏水作用是维持底物-酶分子复合物构象稳定性的要作用力。

表4 疏水效应、盐桥、π-阳离子相互作用Table 4 Hydrophobic Interactions, Salt Bridges, pi-Cation Interactions
2.5.3 讨论
目前,壳聚糖、甲壳素及其衍生物与蛋白间的相互作用的分子动力学模拟研究相对较少。仍有待进一步拓展。
Safoura Salar通过分子动力学模拟手段研究了离子交联法制备的壳聚糖纳米颗粒与胰蛋白酶(trypsin)的相互作用,由于其仅仅研究了相互作用后的RMSD、Rg以及二级结构组成,得到的结构信息相对有限,建模过程并不清晰。该研究表明,相互作用后,trypsin的天然结构并未有明显改变[18]。
Mohammad Yahyaei对比研究了壳聚糖与甲壳素与促卵泡激素蛋白(follicle-stimulating hormone,FSH)的相互作用。该研究以长度为10单元的甲壳素或者壳聚糖寡糖链作为长链甲壳素或壳聚糖的模型来进行研究。通过RMSD、RDF(径向分布函数分析)、RMSF分析与相互作用能分析表明,糖类与蛋白间的相互作用对蛋白结构稳定性有所提升,但该提升的机制仍有待进一步研究[15]。
相比之下,本文从蛋白骨架结构分析、相互作用能量分析、活性中心分析、原子波动分析出发,并进一步通过分子对接等手段,分析并提出了,相互作用对酶催化性能及稳定性的影响机制:当OCTS与CaLB之间的距离越来越近时,CaLB和OCTS之间的可及面积明显降低以及CaLB-OCTS之间的平均COM显著降低。除此之外,CaLB与OCTS之间的氢键数量随着CaLB与溶剂之间氢键数量的减少而增加。在这个自组装过程的初始阶段,CaLB和OCTS之间的静电和L-J相互作用起着重要的作用。随后,静电相互作用成为主导。相互作用主要由静电相互作用、疏水相互作用、氢键相互作用等构成,所形成的组装体将蛋白封装在寡糖保护层之中,该保护层在一定程度上替代了水分子与蛋白之间的相互作用,使得蛋白结构更加稳定。
3 结论
本研究采用分子动力学模拟方法研究南极假丝酵母脂肪酶B与低聚壳聚糖的相互作用和组装。势能分析表明,CaLB与OCTS之间的静电和L-J相互作用在自组装过程的初始阶段起着重要的作用。静电相互作用增强,成为下一阶段的关键驱动力。在模拟过程中,14个OCTS分子与1个CaLB分子组装形成CaLB-OCTS组装体。证实了CaLB与OCTS之间的静电相互作用和氢键相互作用。且OCTS可以与CaLB形成氢键,取代了部分CaLB与溶剂之间的氢键。二级结构表明,CaLB-OCTS与游离酶(CaLB)对照相比,CaLB-OCTS组装体具有更高的sheet含量(12.62%vs 9.78%)和更低的loop含量(46.50% vs 49.20%)。此外,CaLB-OCTS组装体保留了其固有的主干以及活性位点口袋的构象。将模拟后的CaLB-OCTS酶分子与4-硝基笨对棕榈酸酯进行分子对接,在分子水平上揭示了酶与底物的相互作用。验证了底物4-硝基笨对棕榈酸酯分子可结合于CaLB的活性位点,疏水作用在维持酶蛋白-底物复合物发挥着极为重要的作用。总的来说,低聚壳聚糖具有稳定南极假丝酵母脂肪酶结构的潜力。由于低聚壳聚糖可在CaLB-OCTS组装体表面提供丰富的氨基和羟基,这种蛋白-低聚壳聚糖组装体在设计和制备相对高性能的固定化酶方面具有很大的潜力。
