化学交换法分离锂同位素的理论及新技术研究进展
2021-06-30崔莉樊宇亨李莎莎白瑞兵郭彦霞程芳琴
崔莉,樊宇亨,李莎莎,白瑞兵,郭彦霞,程芳琴
(1山西大学资源与环境工程研究所,国家环境保护煤炭废弃物资源化高效利用重点实验室,山西太原030006;2中国科学院过程工程研究所,中国科学院大学中丹学院,北京100049)
引 言
随着人口增长和经济的高速发展,能源短缺和生态环境问题日益凸显,核能等新能源开发日趋重要。锂(Li)是重要的能源战略金属,在自然界有6Li、7Li两个稳定同位素,它们具有完全不同的核反应性[1]。其中6Li受中子轰击可产生氚(6Li+n→T+4He),是核聚变反应必不可少的燃料,而氚是地球上最稀有的元素之一,其在自然界的丰度仅为0.004%。核聚变是一种更为清洁的核能源,是未来核能发展的趋势,该过程要求6Li的丰度>30%。7Li俘获中子的截面小,高纯度的7Li(>99.995%)可作为核电站压水堆的pH调节剂以及钍基熔盐堆的冷却剂。2012年,美国市场核电站压水堆每年对7Li的需求量为400 kg,装机容量为109W的钍基熔盐反应器需要21~56 t的高纯度7Li[1]。核能作为清洁新能源,我国早在2011年就启动了战略性先导科技专项“未来先进核裂变能”,如果可控核聚变得以实现,未来6Li、7Li需求量巨大[2]。6Li、7Li的天然丰度仅为7.42%和92.55%,因此,锂同位素的分离和富集是核能开发必须解决的关键技术。
6Li、7Li具有完全相同的核外电子排布,化学性质非常相似,分离难度极大。自20世纪30年代以来,全球的科研工作者围绕着6Li/7Li的分离问题,开展了大量的研究工作,发展了系列的锂同位素分离方法,如锂汞齐法[3]、离子交换色层法[4]、溶剂萃取法[5-6]、激光分离法[7]、电沉积法[8]等。其中锂汞齐法是目前唯一实现工业化的方法,其同位素分离因子为1.020~1.056。虽然锂汞齐法分离因子高,相间传质速度快,但生产过程中需要大量的剧毒物质——汞。据报道[1],截至2012年,美国已经使用10886 t的汞用于6Li/7Li的分离,而汞的泄漏可能带来灾难性的环境和安全问题,美国国家环境保护局(EPA)已禁止采用锂汞齐法生产锂同位素。因此开发一种安全、高效的锂同位素分离技术成为研究热点。
化学交换法分离锂同位素工艺简单、连续操作性强,受到研究者的广泛关注。自Pedersen[9]发现了冠醚以及Lehn等[10]发现穴醚化合物以来,冠醚、穴醚及其衍生物用于锂同位素分离得到了广泛的研究[5-7]。由于其特殊的空穴结构和尺寸效应,其对锂同位素的分离因子可以和汞齐法相媲美,是目前研究和报道最多的锂同位素分离体系,其对于锂同位素的分离是基于6Li、7Li在两相中形成锂配合物的离子交换反应。我国兰州大学、原子能研究院、上海有机所开展了不同结构的冠醚对锂同位素分离的研究,证实锂同位素效应与两相化合物种的键强差有关,冠醚空穴的大小、结构及边环上的取代基、有机溶剂的类型、锂盐阴离子等影响锂同位素在两相中的分配[11-13]。日本Nishizawa课题组[14-16]开展了大量冠醚萃取分离锂同位素的研究,综合6Li/7Li的分离因子和锂离子的分配系数,确定了苯并15-冠-5-LiI/H2O是最佳的锂同位素分离体系。韩国Kim课题组[4,17-18]考察了大环聚醚固载的离子交换树脂制成的色谱柱对锂同位素的分离效应,获得了较高的6Li/7Li分离因子。以上代表性的结果如表1所示。近年来,随着新技术、新介质和新材料的层出不穷,冠醚分离锂同位素的离子交换体系又取得了长足的进展。目前关于锂同位素分离的综述多是围绕传统锂同位素分离方法展开的[19-21],缺少对近年来新材料和新介质的总结,且少有关于同位素分离理论的研究报道。为了进一步推进锂同位素分离技术的发展,有必要总结近年来锂同位素分离取得的新发展和新突破。

表1 冠醚/穴醚离子交换体系分离锂同位素Table 1 Separation of lithium isotopes by crown ether/cryptand ion exchange systems
本文通过Web of Science工具对1966—2020年发表的锂同位素分离的相关文章进行分析。首先对现有的化学交换法分离锂同位素的理论进行介绍。针对目前冠醚分离锂同位素存在的锂离子分配系数低,不利于锂同位素多级分离和富集的问题,总结了近年来在强化冠醚和锂离子络合方面的研究进展,重点综述了冠醚膜材料、冠醚硅材料、离子液体强化冠醚分离锂同位素的体系。最后对锂同位素分离未来的发展方向进行了展望,以期为国内外相关的科研工作者提供参考和指导。
1 文献统计分析
以“lithium isotope separation”为关键词,采用Web of Science工具对1966—2020年期间发表的489篇论文进行统计分析。如图1(a)所示,在2000年、2018年左右分别出现锂同位素分离研究的热潮。前一个关于锂同位素分离的研究探索主要集中于离子交换色层法,离子交换剂包括有机离子交换剂和无机离子交换剂,有机离子交换剂主要是冠醚螯合树脂,无机离子交换剂包括锰氧化物离子交换剂、钛基离子交换剂、锆基离子交换剂等,此外还有激光分离法、石墨插层法、电化学法、气相沉积法等。随着膜分离技术、材料科学的发展以及离子液体等新介质的出现,锂同位素分离出现了新的研究热潮,这一阶段开展的锂同位素分离研究主要集中在冠醚固载聚合物如膜材料、硅材料和纤维材料以及离子液体和冠醚组成的分离体系。如图1(b)所示,从论文数量上来看,锂同位素分离研究主要集中在日美中三国,说明这三国的科研人员投入了相对较大的精力,具有较高的论文产量。

图1 Web of Science中“lithium isotope separation”为主题的论文分布Fig.1 Publications on Web of Science about the separation of lithiumisotopes
2 锂同位素分离理论
2.1 Urey模型
20世纪40年代,美国的Urey[22]和Biegleisen等[23]最早提出利用量子化学的观点以同位素分子简谐振动频率来估算同位素交换平衡常数(K)的方法(Urey模型或Bigeleisen-Mayer公式)。该模型是稳定同位素地球化学的基石,认为同位素分馏的本质是同位素间质量上的差异,质量上的不同决定了同位素交换反应达到平衡时生成物和反应物的能量差别。对于同位素交换反应:

式中,X、X'分别代表轻、重质同位素,同位素分离因子α与同位素交换平衡常数K的关系为α=K1/n,其中n为交换的原子数。对于锂同位素交换反应,即α=K。同位素交换平衡常数K又可以表示为:

式中,Q为分子配分函数,求出了同位素交换反应反应物和生成物分子配分函数的比值,就可得到α。根据统计力学,粒子的配分函数可表示为:

式中,Ei是粒子的能级,gi是对应于能级Ei的简并度,T为热力学温度,k为Boltzmann常数。其中的能量项包括核自旋运动能Enuc、电子能Telec、平动能Etran、转动能Erot、振动能Evib。因此分子的配分函数可以表示为各种运动形式配分函数的乘积:

其中分子振动能配分函数Qvib在同位素在两相的分配中起主要作用,可以表示为:
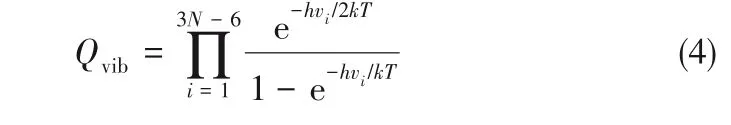
式中,h是Planck常数,为6.626×10-34J·s;k是Boltzmann常数,为1.38×10-23J/K;T是热力学温度,K;N是锂配合物的原子个数(对于非线性分子来说,i=3N-6);vi为振动频率,Hz。Urey模型引入了约化配分函数比率的概念,用β表示,6Li/7Li同位素分离因子α就可表示为两相中锂配合物约化配分函数比率的比值:

式中,下角标o和w分别代表有机相和水相。
根据Teller-Redlich乘法定则和对分子转动的近似处理,β可简化表示为:
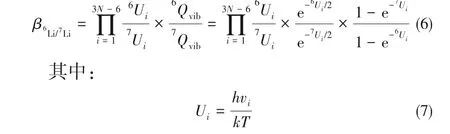
因此,确定了两相中同位素配合物分子的简谐振动频率,就可以计算离子交换反应的锂同位素的分离因子,Urey模型的更多的信息和公式推导可参考文献[23-24]。
该模型主要用来预测地球化学领域同位素的分馏现象。由于早期缺乏对液相和固相体系分子内部信息的了解,该模型最先用于预测气体同位素分子的分馏机制。随着溶液化学、量子化学计算、晶体测试技术等的发展,Urey模型在地球化学领域研究稳定同位素分馏有了很多应用[25-31]。Liu等[27-29]采用Urey模型和量子化学方法成功地预测了各种地质体系Ge、Se、Si同位素的分馏平衡。Anbar等[26]和Jarzecki等[30]基于Urey模型研究了水溶液中[Fe(H2O)6]2+和[Fe(H2O)6]3+之间的Fe的同位素分馏。关于6Li/7Li的同位素分馏也有报道[32-34],Jahn等[32]采用Urey模型和从头算法,预测了6Li/7Li在水溶液或在含锂矿物及流体之间的平衡分馏系数,但研究主要基于高压和高温的地球和地幔条件下。Cui等[35]采用Urey模型和量子化学计算成功预测了溶剂萃取体系冠醚-有机相/锂盐-水相的锂同位素效应,并从化学键、振动频率等微观尺度揭示了化学交换过程中6Li/7Li分离的影响因素及其机制。结果表明冠醚的空腔尺寸是影响锂同位素分离的主要因素,冠醚屏蔽水相中与Li+络合的水分子能力越强,6Li/7Li的分离因子越大。通过削弱锂-冠醚络合物的Li—O键有助于提高6Li/7Li分离因子,例如,使用强极性有机溶剂、选择软碱阴离子的锂盐开展同位素的分离研究。
2.2 键的力常数理论
1977年,Betts等[36]根据萃取过程中同位素交换反应平衡常数K与配分函数相关,借助一级量子修正和忽略矩阵元素G、F推导出K的简单表达式:
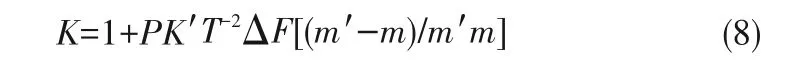
式中,P为金属离子的配位数,K'=(h/2πk)2/24,T为热力学温度,m'和m分别为重同位素和轻同位素的质量,ΔF是有机相和水相中金属-配体键的力常数之差。从式(8)可以得出同位素分离因子取决于两相络合物中金属-配体化学键的力常数之差(∣ΔF∣),∣ΔF∣越大,K越大;因此,配体的选择对于同位素的分离至关重要。另外,金属离子的配位数(P)越大,K越大;其中重同位素富集在强键相,轻同位素富集在弱键相。
对于锂同位素萃取分离的离子交换体系,锂离子在水相中以水合形态[Li(H2O)4]+存在(Li—O的键长约为1.9~2.0Å[35],1Å=0.1 nm),锂同位素的分离主要与锂在有机相中的络合形态及键合强度有关。当有机相为冠醚螯合体系时,由于锂离子和冠醚的结合是离子-偶极作用(Li与冠醚O原子形成的化学键键长为2.1~2.7Å)[图2(a)、(b)],与水相相比,属于弱键相,易富集6Li(表1)。对于酸性螯合剂如偶氮萘酚/羟基喹啉/双酮类和中性配体或离子液体组成的协萃体系,Li+与配位O或N原子形成较强的配位键(Li—O/N化学键的键长在1.9~2.1Å)[图2(c)、(d)],与水相相比,属于强键相,易富集7Li(表2)。

表2 酸性螯合/中性配体或酸性螯合/胺类萃取剂协萃体系的锂同位素效应Table 2 Lithium isotopic effect of acid chelating agent/neutral ligand or acid chelating agent/amine extractant co-extraction systems
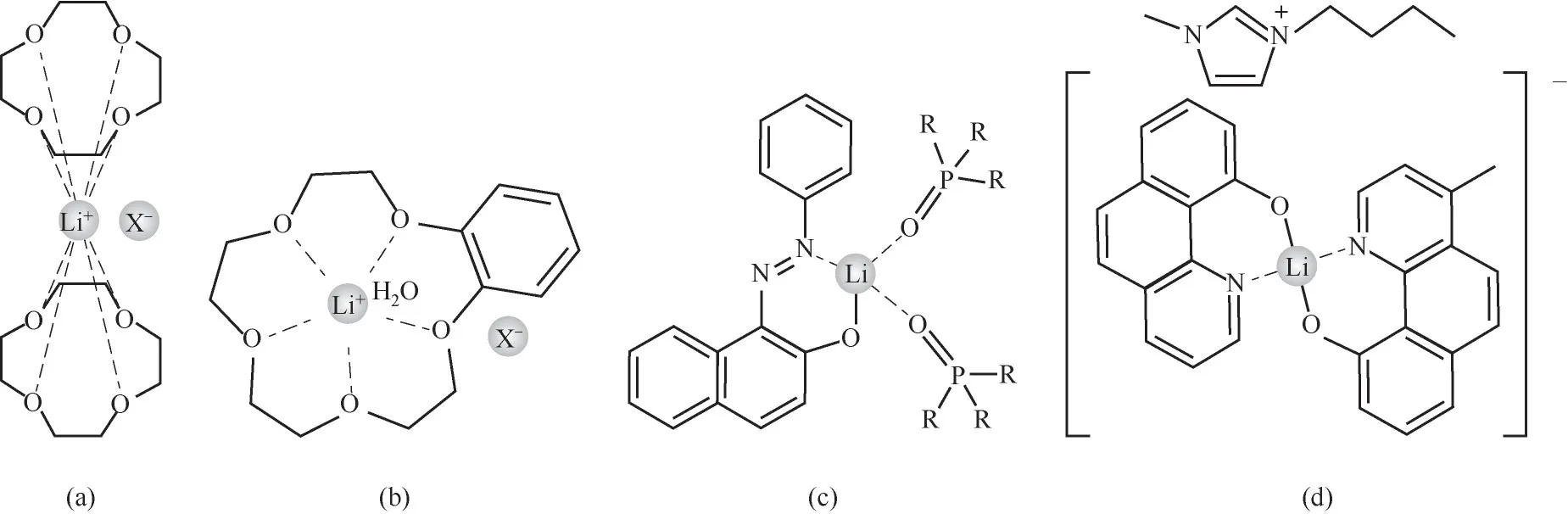
图2 冠醚和酸性螯合体系与Li+形成的配合物结构:(a)12-冠-4与Li+形成的配合物(X为I时,Li—O的平均键长为2.43Å)[35];(b)苯并-15-冠-5与Li+形成的配合物(X为I时,Li—O的平均键长为2.24Å)[35];(c)1-苯基偶氮-2-萘酚/TOPO与Li+形成的配合物[37](R=C8H17);(d)4-甲基-10羟基苯并喹啉/1-甲基3-甲基咪唑氯化物与Li+形成的配合物[38]Fig.2 The complex structures of crown ether or acidic chelating agent with Li+:(a)the complex of 12-crown-4 with Li+(the average bond length of Li—Ois 2.43Åwhen X is I)[35];(b)the complex of benzo-15-crown-5 with Li+(the average bond length of Li—Ois 2.24Åwhen X is I)[35];(c)the complex of 1-phenylazo-2-naphthol/TOPOwith Li+(R=C8H17)[37];(d)the complex of 4-methyl-10 hydroxybenzene quinoline/1-methyl 3-methylimidazole chloride with Li+[38]
2.3 热力学理论
严峰等[19]从热力学角度解释了冠醚分离锂同位素的机制。他们认为,同位素分离效应的本质是冠醚对6Li、7Li络合自由能变的差异引起的,由式(9)、式(10)两个平衡式获得:

式中,L代表冠醚配体,X-是锂盐阴离子。式(9)与式(10)的自由能变差异越大,6Li/7Li分离因子越大。冠醚络合Li+的净自由能变ΔGӨ由体系焓变ΔHӨ和熵变ΔSӨ共同组成,具体表示为冠醚-锂络合的焓与游离溶剂分子增加所获得的熵的和,减去冠醚与锂离子去溶剂化以及冠醚构象重排引起焓的损耗。因此,任何影响该过程的自由能变的因素都影响到锂同位素效应,包括冠醚的分子结构、给体原子的种类、溶剂类型、反配阴离子等。在各种过程的互相影响下最终形成冠醚在某一体系的锂同位素效应。
理论上,式(9)和式(10)中的ΔGӨ、ΔHӨ、ΔSӨ需要纯6Li、7Li与冠醚的热力学实验,难以获得。所以在锂同位素交换体系中,ΔGӨ、ΔHӨ、ΔSӨ主要通过式(11)得到:
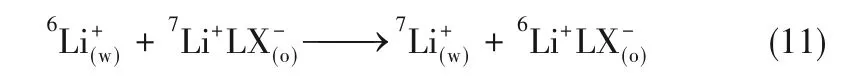
Nishizawa等[16]研究了不同空穴尺寸冠醚的锂同位素效应,从热力学角度阐述了冠醚空穴尺寸对6Li/7Li分离因子的影响。表3为冠醚-氯仿/LiIH2O离子交换体系在0℃的热力学函数和分离因子,发现随着冠醚空穴尺寸的增大,同位素交换反应的焓变、熵变绝对值降低,对应的α6Li/7Li也降低,推测这是由于冠醚尺寸的增大增加冠醚构象重排时焓损耗[19],自由能变降低,从而降低分离因子。

表3 不同尺寸冠醚分离锂同位素的热力学函数[19]Table 3 Thermodynamic analysisof 6Li/7Liseparation by crown ethers with different sizes[19]
3 锂同位素分离研究新进展
由于冠醚显著的锂同位素效应,近年来,锂同位素分离的新材料和新体系的研究基本上都是围绕冠醚展开的。Li+分配系数和6Li/7Li分离因子对于锂同位素分离来说是两个重要的指标,但两者是不同过程的结果,Li+分配系数对应于溶剂萃取或者吸附过程Li+在两相分配达到平衡的结果,而6Li/7Li分离是6Li、7Li在两相中锂配合物之间离子交换达到平衡的结果。如何平衡两者之间的关系是锂同位素分离的一个关键科学问题。理想的化学交换法分离锂同位素既要求有较高的Li+分配系数,又有适宜的锂同位素分离因子。单从分离因子上看,冠醚是最有前途实现工业化锂同位素分离的离子交换剂,但Li+在冠醚和水溶液两相的分配系数低,不利于锂同位素的多级分离和富集,这是限制同位素分离工业化应用的主要原因。除此之外,溶剂萃取过程中冠醚小分子易流失也是分离的一个弊端。为了解决上述问题,科研工作者做了一系列的研究探索。
3.1 离子液体强化冠醚分离锂同位素
离子液体(ionic liquids)作为一种绿色的反应和分离介质,有可忽略的蒸气压、不易挥发、不易燃烧、热稳定性好等优点。离子液体作为稀释剂取代溶剂萃取过程中挥发性有机溶剂以及离子液体作为分离介质参与分离过程已有很多应用[42-44]。研究表明,在有中性配体如磷酸三丁酯(TBP)、三烷基氧化膦(Cyanex 923)、三辛基氧化膦(TOPO)、冠醚等存在的条件下,[PF6]-和[NTf2]-基疏水性离子液体可显著提高中性配体对金属离子的分配系数[45-48],萃取分离机制为阳离子交换。以[OHEmim][NTf2]强化Cyanex 923从锂盐水溶液中萃取Li+为例[49]:

Xiao等[50-53]在研究离子液体强化冠醚提锂和分离锂同位素方面开展了大量研究,考察了不同锂盐类型、咪唑基离子液体烷基链长度、水相pH、不同空穴的冠醚等对Li+分配系数和6Li/7Li分离的影响。结果表明,降低烷基链的长度有利于Li+分配系数的提高,在最佳pH=6的条件下,离子液体的加入可使Li+在相间的分配系数从10-3~10-5[14-15]提高到10-2~10-1数量级[50],形成了(LiLn)+Y-复合物(L表示冠醚,Y表示离子液体阴离子),同时也在一定程度上改善了锂同位素的分离因子[52],尤其对于阴离子为硬碱的氯化锂盐体系,在[C6mim][PF6]存在的条件下,20℃时B15C5对LiCl-H2O体系中6Li/7Li的分离因子为1.032[50]。他们认为,阴离子的核外电子云密度越低,锂同位素的分离效果也越好,对不同的锂盐体系,6Li/7Li单级分离因子从大到小的顺序为:CF3COOLi>LiI>LiBr>LiCl,符合软硬酸碱理论。Cu等[54-56]也尝试将阴离子为[PF6]-、[BF4]-和[NTf2]-的[C8mim]基离子液体作为溶剂强化冠醚体系提锂以及6Li/7Li的分离。为减少冠醚的水溶性,他们设计合成了含有萘环的2,2'-联萘二基-17-冠-5醚(BN-17C5),发现[C8mim][NTf2]对冠醚提锂的强化作用较好,25℃时BN-17C5-[C8mim][NTf2]从CF3COOLi-H2O溶液中获得1.046的6Li/7Li分离因子,Li+的分配系数为0.06[54]。为了解决由于离子液体高黏度度带来的传质速率慢的问题,他们将离子液体和冠醚通过溶胶凝胶法固定在介孔硅材料[55]或者浸渍法固载在树脂材料[56]。
离子液体和冠醚组成的离子交换体系和单纯冠醚相比,可提高Li+的分配系数。同时在萃合物中引入离子液体的阴离子[PF6]-或[NTf2]-作为平衡电荷,由于较大的阴离子体积和较小的电子云密度,削弱了与(LiLn)+之间的静电作用,增强了水相和冠醚相Li—O键的力常数之差。基于2.2节键的力常数理论,有利于同位素效应的改善,但离子液体阳离子的损失是该方法的弊端。
3.2 冠醚固载材料分离锂同位素
鉴于冠醚在溶剂萃取过程中小分子易流失的问题,研究者将冠醚通过化学接枝的方法固载于介孔二氧化硅、膜材料以及其他高分子聚合物上,采用固-液萃取法分离锂同位素。该方法使得冠醚不需要溶解在溶剂中,锂盐的溶剂也不再局限于水,可以溶于比水极性低的有机溶剂中,如乙腈(C2H3N)、丙酮(C3H6O)等,避免了Li+的水合作用带来的负面影响,使Li+去溶剂化过程焓损耗减少,有利于Li+和冠醚的结合[57-58]。另一方面,也避免了冠醚和Li+相互作用过程中配位水分子的引入,这对基于冠醚体系的锂同位素分离是有利的。
3.2.1 冠醚固载硅材料 过去20年里,有序介孔二氧化硅(OMS)为功能化纳米材料的研究带来了巨大活力,其高比表面积、均匀的通道结构、可调的孔道大小和形状为引入特定的有机配体创造了条件,功能化后的OMS可以有效吸附和分离金属离子[59]。Ye等[60]首先合成一系列含有不同取代基(—NH2、—NO2、—C4H9)的B15C5衍生物,在液-液萃取体系中考察了B15C5及其衍生物的锂同位素效应,结果表明供电子效应强的—NH2取代的B15C5具有较好的和Li+结合以及6Li/7Li分离性能,—C4H9取代的B15C5次之,—NO2取代的B15C5和Li+结合以及6Li/7Li分离性能最差。他们采用导入接枝(postgraft)法[60]和连续活化剂再生引发剂引发的原子转移自由基聚合(ICAR ATRP)技术[61]将NH2-B15C5固定在SBA-15硅基介孔材料上(图3),研究其在固-液萃取条件下的提锂效果和锂同位素分离效应。结果表明,在具有较软锂盐阴离子的体系以及将锂盐溶于较低介电常数的溶剂中时,可获得较大的同位素效应。热力学研究表明,上述B15C5衍生物和Li+的结合以及锂同位素的离子交换反应均为放热反应,降低温度有利于提锂和6Li/7Li的分离,该材料在288.15 K、CF3COOLi-C2H3N体系中获得最高6Li/7Li分离因子1.049[60],此时Li+的吸附容量约为4.0~5.0 mg/g。

图3 氨基-苯并-15-冠-5接枝SBA-15材料的结构[60]Fig.3 The illustration of amino-benzo-15-crown-5 grafted SBA-15 material[60]
3.2.2 冠醚固载聚合物材料 将大环聚醚通过化学反应接枝在聚合物材料上也有大量的报道。严峰课题组[19,62-69]在冠醚功能化的膜材料分离锂同位素方面开展了大量研究,通过缩醛化[67]、亲核取代[69]等合成方法将甲酰基、胺基等功能基团取代的B15C5或氮杂15冠5醚接枝在聚乙烯醇(PVA)、聚砜(PSF)等聚合物材料上(图4),考察了其在固-液萃取条件下的锂同位素效应,研究了冠醚固载量、锂盐阴离子、反应温度、锂盐溶剂等对锂同位素分离的影响。结果表明,冠醚的固载量对Li+的分配系数和锂同位素分离因子影响较大,提高负载量有利于Li+的分配系数和同位素分离因子的提高,具有较软阴离子的锂盐以及采用较低介电常数的溶剂制备锂盐相时可获得较高的Li+分配系数和锂同位素分离因子。如对于4'-甲酰基苯并15-冠-5接枝聚乙烯醇(PVA-g-FB15C5)和无纺布形成的复合材料从LiI的水溶液中提锂和分离锂同位素,当冠醚的接枝量从0.76 mmol/g提高到2.13 mmol/g时,Li+的分配系数可从136 ml/g提高到175 ml/g,锂同位素的分离因子从1.013提高到了1.065,大于4'-甲酰基苯并15-冠-5和锂盐-水溶液组成的液-液萃取体系(α=1.022)以及PVA-g-FB15C5和锂盐-水溶液组成的固-液萃取体系(α=1.046)的锂同位素效应,Yan等[62]认为,同位素分离因子的显著改善与复合材料的孔结构有关。

图4 PVA-g-FB15C5的结构[62]Fig.4 The structure diagram of PVA-g-FB15C5[62]
也有研究者将B15C5通过化学反应接枝到纤维材料上用于锂同位素分离。Zhai等[58]通过γ射线辐射诱导乳液接枝技术制备了具有4-氨基苯并15-冠-5活性单元的纤维素微球(MCM-g-AB15C5)。Ye等[57]通过ICAR-ATRP技术将—NH2取代的B15C5固定在玻璃纤维上并研究了其对Li+的吸附和锂同位素的分离行为。尽管目前有大量的冠醚固载材料分离锂同位素的报道,但受到冠醚接枝量的限制,普遍存在吸附容量低的问题。
3.3 含氟溶剂萃取体系
胡金波课题组[41,70-71]在锂同位素分离方面做了大量的研究工作,建立了锂同位素多级富集分离的成套装置,国际上首次实现利用有机萃取法富集分离得到丰度为99.992%的7Li样品。他们先后公开了可有效富集7Li的萃取剂,分别是含氟的偶氮萘酚萃取剂[70][图5(a)]和苯并喹啉类萃取剂[41][图5(b)]。其中含氟萃取剂萘环上的—OH基团具有较高的质子酸性,在碱性条件下可以失去质子,在偶氮基团和季铵盐协萃剂的共同作用下,可与Li+形成稳定的螯合物((SF-Li-SF)-L+,SF为去质子的含氟萃取剂,L为协萃剂),具有较高的萃取率和锂同位素分离因子。同时含氟基团的存在也改变了偶氮基团中氮原子对锂的配位性能,产生显著的同位素分离效应,反萃后,萃取剂和协萃剂可循环使用。在5-氟-9-甲氧基-10-羟基苯并喹啉/N263/二氯苯/LiCl体系中,Li+的分配系数为1.5,7Li/6Li的最大单级分离因子为1.028,采用(NH4)2SO4作为反萃剂,三次反萃率达99%,实现了锂同位素多级分离和富集。该课题组还公开了一类含氟的冠醚萃取剂[图5(c)]用于锂同位素分离[71],由于含氟基团的引入,使该类冠醚疏水性强,分相快、效率高,锂同位素的单级分离因子为1.033~1.041,其中冠醚相富集6Li。由于含氟基团的吸电子效应,削弱了锂-冠醚配合物中的Li—O键,根据Urey模型和键的力常数理论,有利于6Li/7Li分离。

图5 含氟萃取剂结构示意图:(a)偶氮萘酚萃取剂[70](R1为氢、溴、氯、氟或C1~6氟代烷烃,且至少有一个为氟或C1~6氟代烷烃;R2为氢、卤素、硝基、氰基或C1~6氟代烷烃);(b)苯并喹啉萃取剂[41](Z为氧、硫或氮原子;R9为氢、磺酰基;R1~8为氢、卤素、苯基等);(c)含氟冠醚萃取剂[71]Fig.5 The structures of the fluorine-containingextractants:(a)azo-naphthol extractant[70](where R1 is hydrogen,bromine,chlorine,fluorine or C1—6 fluoroalkane,and at least one is fluorine or C1—6 fluoroalkane;R2 is Hydrogen,halogen,nitro,cyano or C1—6 fluoroalkane);(b)benzoquinoline extractant[41](Zis oxygen,sulfur or nitrogen atom;R9 is hydrogen,sulfonyl group;R1—8 are hydrogen,halogen or phenyl,etc.);(c)fluorine-containing crown ether[71]
综上所述,无论是溶剂化萃取体系还是固-液萃取体系,冠醚是目前研究和报道最多的锂同位素分离体系。但冠醚作为活性单元,普遍存在Li+的分配系数低的问题,且Li+的分配系数和6Li/7Li的分离因子受锂盐阴离子的影响较大,只有阴离子半径大、变形性强的阴离子如CF3COO-、SCN-、I-等存在时才可获得较高的Li+分配系数,冠醚与Li+的结合一般服从Hofmeister序列;对于广泛存在的亲水性的氯盐和硫酸盐体系,冠醚和Li+的结合性能很差,且6Li/7Li的分离因子也不高。这主要由Li+的电子结构决定,Li+具有1s2的惰性电子结构,无d轨道,化学性质稳定;离子势小,配位能力差;通过单一的相互作用很难将Li+从高价离子共存的体系中选择性分离出来,提取难度很大。针对冠醚和Li+结合性能差,研究者通过构建质子化的冠醚或者在大环聚醚体系中引入氢键供体、Lewis酸等阴离子识别位点可以显著改善Li+的分配系数,这些研究有望为锂同位素分离新体系和新方法的建立提供思路。
4 新型冠醚离子对体系
4.1 质子化冠醚
研究表明,相比中性冠醚,在碱性条件下,侧链带有质子化基团(—COOH、—PO3OH等)的冠醚分子(图6)容易脱去质子,生成共轭碱,与Li+络合时可形成更加稳定的配合物。Torrejos等[72]合成了侧臂具有羧酸基团的二苯并14-冠-4(DB14C4-C18-COOH),以离子液体三己基十四烷基双(三氟甲基磺酰基)酰胺(CYPHOSIL 109)为稀释剂,在pH=12.8、冠醚浓度为0.025 mol/L时,DB14C4-C18-COOH对Li+的分配系数为6.6,大于DB14C4-C18和DB14C4为萃取剂时Li+的分配系数(<0.21)。将—COOH基团固定在接枝了冠醚环的多壁碳纳米管上也观察到相同的趋势[73]。Habata等[74]将可电离的磷酸官能团(—PO3OH)与冠醚结合,在pH=11时,含磷酸官能团的DB14C4与羟甲基二苯并-14冠-4相比,Li+的萃取率提高了约270倍,且具有较高的Li+/Na+和Li+/K+选择性。

图6 侧链带有质子化基团(—COOH、—PO3OH等)的冠醚分子的结构:(a)DB14C4-C18-COOH[72];(b)含烷基磷酸官能团的二苯并-14冠-4[74];(c)羟甲基二苯并-14冠-4[74]Fig.6 The structure of crown ether molecules with protonated groups(—COOH,—PO3OH,etc.):(a)DB14C4-C18-COOH[72];(b)dibenzo-14-crown-4 with alkyl phosphate group[74];(c)hydroxymethyl dibenzo-14 crown-4[74]
4.2 双功能离子对受体
在大环化合物结构中引入脲键,形成双功能离子对受体。由于脲键(—NH—CO—,—NH—CS—)可以与F-、Cl-、Br-、NO3-等阴离子形成氢键,可用于阴离子的识别,冠醚作为阳离子的识别位点,通过控制冠醚环的大小能选择性地结合Li+。因此,在大环化合物上引入脲键作为氢键供体可实现锂盐分子的高效提取和特异性识别。如Smith等[75]报道了一个可用于固-液萃取分离过程选择性提取锂盐分子的双功能配体(图7)。通过单晶衍射仪测试配合物的结构发现,LiCl和LiBr以离子对的形式进入配体,水分子也参与配位反应;核磁表征显示,在LiCl/NaCl/KCl-CDCl3三种固体盐的混合体系中,该双功能配体对不同盐的络合比例为94∶4∶2(摩尔比),表明该配体对Li+有明显的选择性。

图7 双功能配体与Li+的配位反应[75]Fig.7 The coordination reaction of a ditopic salt receptor with lithiumion[75]
在大环化合物中引入金属作为Lewis酸性位点,形成双功能离子对受体。Lewis酸位点作为电子对接受体可用于阴离子的识别,通过和冠醚环的协同作用,能选择性地结合锂盐离子对。如Wendji等[76]合成了含有Lewis酸性基团的二茂铁13-冠-4醚离子对接受体,其和LiCl能形成稳定的配合物,其中冠醚部分选择性的络合Li+,Sn起到选择识别Cl-的作用;通过制备单晶,得到了含Sn的二茂铁13-冠-4醚与LiCl形成配合物的分子结构,结果表明,LiCl的Li+和Cl-分别和冠醚以及路易斯酸性中心Sn络合,Li-Cl之间的距离为2.329Å(图8)。

图8 含Sn的二茂铁冠醚分子与LiCl形成离子对[76]Fig.8 The complexation of tin-containing crown ether with LiCl[76]
5 结论与展望
6Li、7Li是核能发展重要的原材料,其分离和富集已列为国家科技发展的重大专项。我国从20世纪80年代研究锂同位素分离以来,已经取得了显著的进展和突破,其中化学交换反应分离锂同位素是一个主要的研究方向。溶剂萃取法和吸附法是目前文献报道最多的锂同位素分离方法,冠醚是主要的活性单元,与已工业化的锂汞齐法相比,技术尚未成熟,仍处于实验室研究阶段,但不存在汞泄漏的风险。溶剂萃取法传质速率快、可连续操作性强,但萃取过程中冠醚小分子易流失是该方法的弊端。将冠醚共价接枝到固相材料虽然可以克服冠醚小分子流失的问题,但由于受到冠醚接枝量的限制,普遍存在吸附容量低的问题,且固-液两相传质慢,达到平衡时间长。总之,不管是溶剂萃取法还是吸附法,冠醚作为活性单元,Li+分配系数低,不利于锂同位素的多级分离和富集,这是限制冠醚用于锂同位素分离工业化的主要原因。
目前的研究多侧重于锂同位素分离效果的研究,对锂同位素分离的微观反应机制研究较少,尚未从电荷、锂同位素作用的差异、吸附材料孔结构、纳微环境、孔道限域效应等微观尺度揭示分离介质与同位素分离性能之间的构效关系,这在一定程度上也限制了高效分离体系的开发。另外,在分离过程中如何兼顾Li+分配和6Li/7Li分离也是锂同位素分离亟待解决的关键科学问题。因此,锂同位素分离工业化尚需解决从基础研究到产业化应用过程中的诸多关键科学和技术问题,需要进一步优化萃取剂的结构,研究Li+在分离过程中的动力学和热力学,开发高效的分离装置等。鉴于低温有利于Li+分配及6Li/7Li分离,因此开发低温的锂同位素分离技术是今后研究的一大方向。
随着化石能源的不断消耗,研发清洁能源已经成为全人类的共识。实现“可控核聚变”虽然困难重重,但从长远来看,核能必将是人类继煤、石油和天然气之后的主要能源,希望通过对锂同位素分离的基础理论和工程应用的不断攻关,推动核能的发展,实现可控核聚变造福人类。
