不同水质水体中溶藻微生物种群多样性研究
2021-06-30吴雅丽傅以钢
吴雅丽,傅以钢
(1.江苏省徐州环境监测中心,江苏 徐州 221000;2.同济大学环境科学与工程学院,上海 200092)
0 引言
作为水生生态系统的初级生产者,藻类可以通过光合作用为无脊椎动物、鱼类、鸟类和其他生物提供氧气和食物。藻种之间以及它的初级产物在结构上和水生生态系统的功能上有着直接的联系。目前,淡水富营养化、蓝藻出现和水华爆发吸引了全世界的极大关注,导致了广泛的社会、环境和经济问题,如水质恶化、受影响水体美学价值的下降和对水产养殖业的损害等[1-2]。有害的蓝藻细菌如Microcystis,Anabaena,Nostoc和Aphanizomenon能够产生毒素,而微囊藻毒素(microcystins:MCs)是目前检测出最为普遍存在的毒素[3]。当蓝藻爆发时,MCs 会伴随着大量蓝藻细胞出现,从健康和经济的视角来看,这对饮用水安全造成巨大的威胁[4]。更重要的是,由铜绿微囊藻产生的MCs 会对鱼类、鸟类、野生动物、家畜和人类造成严重不良影响,与过敏、刺激反应、肠胃炎、肝病和肿瘤发病有密切关系[5-6]。
藻毒素种类繁多,污染程度及范围也在不断扩大[7]。关于如何应对藻类的危害问题,各国的科研工作者采取了诸多不同的策略,取得了一定成就。目前,灭藻方法主要可以分为3 类,即物理方法、化学方法和生物方法。现在人们更多的把目光集中到生物方法上,如种植水生植物、投入原生动物和鱼类、投放溶藻微生物等[8-9]。而分子生物学方式由于简单、快速和经济等优点,逐渐成为各国学者普遍关注的热点[10]。本文采用分子生物学手段分析不同水质水体中的种群结构,研究确定溶藻微生物种群,以期为实际应用溶藻微生物防治藻类水华提供有效支撑。
1 材料和方法
1.1 材料
(1)样品与培养条件
样品:A 为太湖源头水样;B 为景观水样;C 为河道水样;D 为臭水沟水样。
培养条件:①富集水体微生物:在体积为100 mL LB 培养基中分别加入1 mL 水样,摇床设置37 ℃,100 r/min 平行培养1 d;②样品培养:分别添加0.01,0.02 mg/mL 铜绿微囊藻(藻干重),摇床设置37 ℃,100 r/min,与空白对照组一同培养2 d;③样品预处理:样品离心(6 000 r/min,6 min,4 ℃),去除上清液取沉淀,于4 ℃保存备用。
(2)培养基组分
①蓝藻培养基:NaNO3150 mg;K2HPO44 mg;MgSO4·7H2O 7.5 mg;CaCl2·2H2O 3.6 mg;Na2SiO3·9H2O 5.8 mg;柠檬酸0.6 mg;柠檬酸铁铵0.6 mg;EDTA 0.1 mg;Na2CO32 mg;A5 溶液0.1 mL;蒸馏水99.9 mL;②A5 溶液:H3BO3286 mg;MnCl2·4H2O 181 mg;ZnSO4·7H2O 22 mg;CuSO4·5H2O 7.9 mg;Na2MoO4·2H2O 3.9 mg;蒸馏水100 mL;③LB 培养基:蛋白胨10 g;酵母提取物5 g;NaCl 10 g;蒸馏水1 000 mL;pH 值为7.0~7.2。
1.2 16S 微生物种群分析
(1)DNA 提取
利用MP bio 土壤提取试剂盒(FastDNA Spin Kit for Soil),提取纯化样品DNA,提取得到的DNA 置于离心管中,于-20 ℃冷冻保存备用。
(2)PCR 扩增
①确定引物534r(V3):(5'-ATTACCGCGGCTGCTGG-3’);341f(V3):(5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3’)(下划线处为“GC”钳)。
②样品DNA 用16S rDNA 的V3 区引物进行扩增。PCR 体系:超纯水38.75 μL,dNTP(浓度为2.5 mmol/L)2μL,10×buffer5 μL,引物(浓度为10 μmol/L)为1 μL,DNA 模板2 μL,Taq 酶(大连宝生物工程有限公司)0.25 μL。
③PCR 扩增程序:温度94 ℃,保持3 min 预变性;温度94 ℃,保持20 s 变性;温度55 ℃,保持30 s退火;温度72℃,保持30s 延伸,30 个循环;温度72℃,保持7 min 延伸。
(3)DGGE 分析
PCR 扩增产物采用DGGE(变性梯度凝胶电泳)电泳分离,电泳缓冲液为1×TAE,凝胶变性梯度为35%~55%,电压200 V,温度60 ℃,电泳时间5 min;之后电压调为120 V,电泳时间6~7 h,电泳结束后加入30 μL SDNA-Nucleic acids stain dye(上海生工生物工程有限公司)在200 mL 1×TAE 缓冲液中染色,后在摇床上震荡30 min 取出,紫外灯下割取目的DNA 条带,置于微量离心管中,挤碎后加入20 μL 超纯水过夜,溶出DNA 待用。
(4)克隆
DGGE 条带再扩增引物为534r(V3)(5'-ATTACCGCGGCTGCTGG-3’)和341S(5'-CCTACGGGAGGCAGCAG-3’),PCR 体系与扩增程序见1.2。
采用1.0%琼脂糖凝胶对PCR 产物进行电泳检测,割胶后进行胶回收(BioMIGA Gel/PCR Extraction Kit),扩增片段纯化后与T-载体进行连接与转化,阳性克隆挑出后培养再扩增,取扩增产物委托华大基因公司进行测序。
1.3 蛋白分析
(1)蛋白质提取
吸取200 μL 水样于1.5 mL 离心管中,离心去除上清液,分别加入25 μL 蛋白Loading buffer 和100 μL 超纯水,置于沸水中蒸煮3~5 min 以提取蛋白,于4 ℃保存待用。
(2)SDS-PAGE 电泳
配制12%的分离胶及5%的浓缩胶,加入1× 电泳缓冲液进行电泳,分离胶电压为120 V,浓缩胶电压为80 V,电泳结束后用考马斯亮蓝染色30 min,过夜脱色,脱色完成后割取目的条带,委托中国科学院进行LC-MS 质谱测定。
(3)LC-MS 质谱测定
胶内酶解(Trypsin)20 h,并抽提酶解肽段,利用毛细管高效液相色谱方法分析,其中A 液为0.1%甲酸的水溶液,B 液为0.1%甲酸的乙腈水溶液(乙腈为84%);色谱柱以95%的A 液平衡后,样品由自动上样到Trap 柱。同时将样品经过ESI 质谱得到的多肽和多肽的碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集20 个碎片图谱(MS2 scan)。原始文件(raw file)用BIOWORKS 软件搜索相应的数据库,最后得到鉴定的蛋白质结果。搜索使用的数据库为Bacteria 蛋白质库,SEQUEST 结果过滤参数为:当Charge+1,Xcorr ≥1.9;当Charge+2,Xcorr≥2.2;当Charge +3,Xcorr≥3.75;其中DelCN≥0.1。
2 实验结果
2.1 不同水质采样点微生物多样性分析
作为研究对象的自然水体取自不同水质水体,A 为太湖源头水样,B 为景观水样,C 为河道水样,D为臭水沟水样。A1~D1 为样品中加入质量浓度为0.01 mg/mL(藻干重)铜绿微囊藻,A2~D2 为样品中加入质量浓度为0.02 mg/mL(藻干重)铜绿微囊藻。经过PCR-DGGE 技术分析,之后在紫外灯下拍照,得到DGGE 电泳图谱,结果见图1。
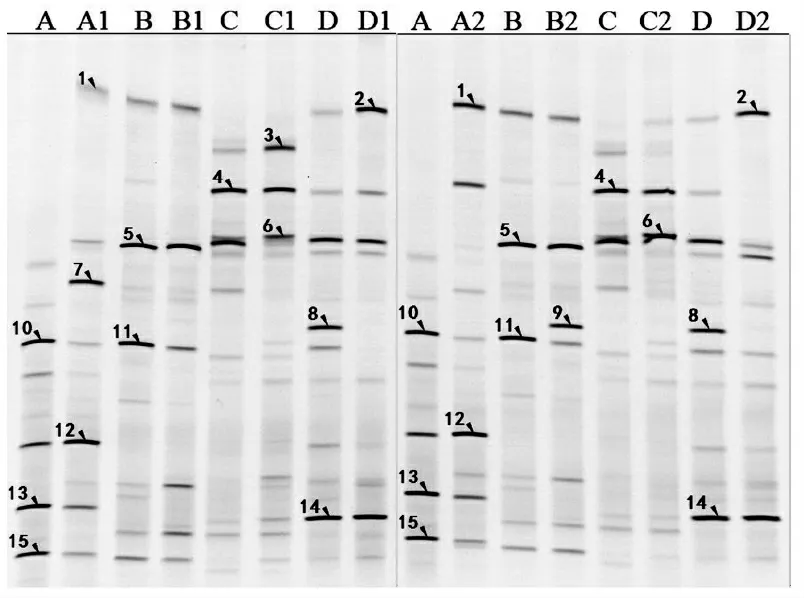
图1 不同水质自然水体微生物16S rDNA 电泳结果
由图1 可以看出,电泳图谱条带均匀、较密集,微生物种群结构丰富,加入不同浓度藻类冲击后大部分条带仍然与原水样条带保持一致,只是部分条带明暗程度有所改变。说明加藻冲击后对水样中微生物组成会有一定影响,但仍和水样原微生态基本保持一致,这是符合正常预期的。较亮的条带代表降解过程中可能起到主导作用的优势种群,而其他种群由于处在非主导地位,因而在数量上处于劣势。加藻后微生物优劣势种群部分发生了演替,如A 样品中的7 号条带在加质量浓度为0.01 mg/mL 藻后变为优势菌群,B 样品中的9 号条带在加质量浓度为0.02 mg/mL 藻后变为优势菌群,说明这2 种微生物可能对藻类有较强的适应力或具有一定的耐藻性。10 号条带则在加入不同浓度藻类后条带均变暗,成为劣势菌群,说明此类微生物对于藻类的冲击没办法适应,加藻后数量明显减少。B 样品和C 样品中的5 号条带和4 号条带则在加入不同浓度藻类后没有发生明显变化,说明这种微生物有可能具有一定的耐藻性。
从图1 样品中割取15 个目的条带,对这些条带进行纯化后克隆、测序,获得的基因序列与GenBank数据库进行比对,通过序列分析,发现2,12 条带同为Lysinibacillussp.MJJ-11 菌,各序列比对结果见表1。
由表1 可以看出,所选优势菌基本都能在Genbank 中找到同源性较好的细菌,除1 条带同源性为95%之外,其他条带均在99%以上,可以确定为同一个菌种或菌属。
用MEGA 软件分别对自然水体中原有细菌及受到藻类冲击后水样进行同源进化分析,结果见图2。
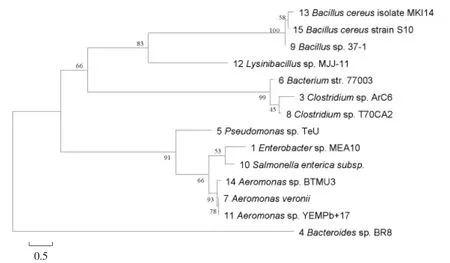
图2 不同水质细菌同源进化分析结果
由图2 可以看出,鉴定得到的细菌分为2 个家族,但家族中细菌数量相差较大,其中较大的一个家族又分为2 个细菌数量较一致的2 个分支,分别主要由Bacillus及Aeromonas所组成。结合DGGE 图谱,自然水体中原有优势菌群主要是Bacteroidessp.,Pseudomonassp.,Clostridiumsp.,Salmonella entericasubsp.,Aeromonassp.,Bacillus cereus。加入不同浓度藻类冲击后水样种群结构发生一些变化,优势菌群主要是Enterobactersp.,Clostridiumsp.,Bacteroidessp.,Pseudomonassp.,Bacteriumstr.,Aeromonas veronii,Bacillussp.,Lysinibacillussp.,Aeromonassp.。
测序结果显示,不同取样批次鉴定得到的微生物种类略有差别,但基本构成高度一致,鉴定得到的主要种属相似,2 批样品中主要存在的微生物群落均为Aeromonas,Enterobacter及Bacillus,说明同一水体不同批次的样品微生物菌落结构会有差异,原有微生物体系会因加藻冲击造成一定的影响,但最终会形成一个相对稳定的新的微生物体系。
2.2 不同水质样品蛋白差异性分析
利用提取得到的蛋白质样品进行蛋白单向电泳分析(SDS-PAGE),然后在白光下观察拍照,得到电泳图谱见图3。
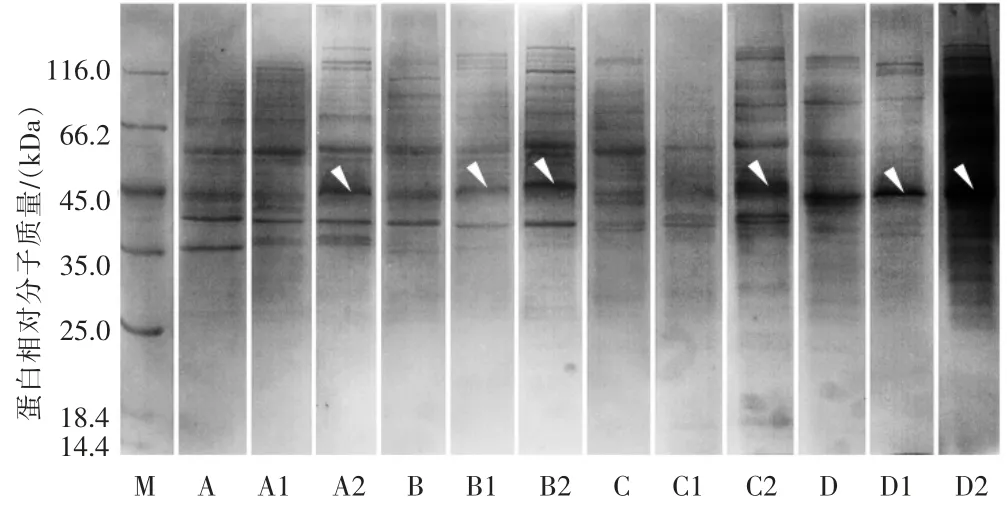
图3 不同水质采样点自然水体的蛋白电泳结果
由图3 可以看出,各泳道谱带背景均较清晰,蛋白条带分布较均匀,相对分子质量范围集中在35.0~116.0 kDa 之间,且不同水质在加入不同浓度的铜绿微囊藻后在蛋白条带浓度上均有一定程度的变化。电泳结果显示水质越差蛋白条带相应减少,4 种样品在位于45.0 kDa 左右的蛋白条带变化明显,加藻后蛋白条带浓度均有一定程度的增加,尤其D 样品变化最为明显。观察发现随着水质的变差蛋白浓度变化也相应变得明显,说明有可能随着水质的恶化,水体原有微生物抗藻类冲击的能力也随之增强。
2.3 目的蛋白条带质谱鉴定分析
割取的蛋白条带相对分子质量位于35.0~45.0 kDa 之间,且位于35.0~45.0 kDa 之间的蛋白条带与LEE S 等[11]从海水中分离得到的一株海洋细菌假交替单胞菌A28(Pseudoalteromonas sp.A28)中的高效溶藻酶特征比较相像,与本实验结果也较吻合,故本章仅对相对分子质量位于35.0~45.0 kDa 之间的蛋白条带结果进行进一步分析讨论。蛋白总质谱图谱结果见图4。
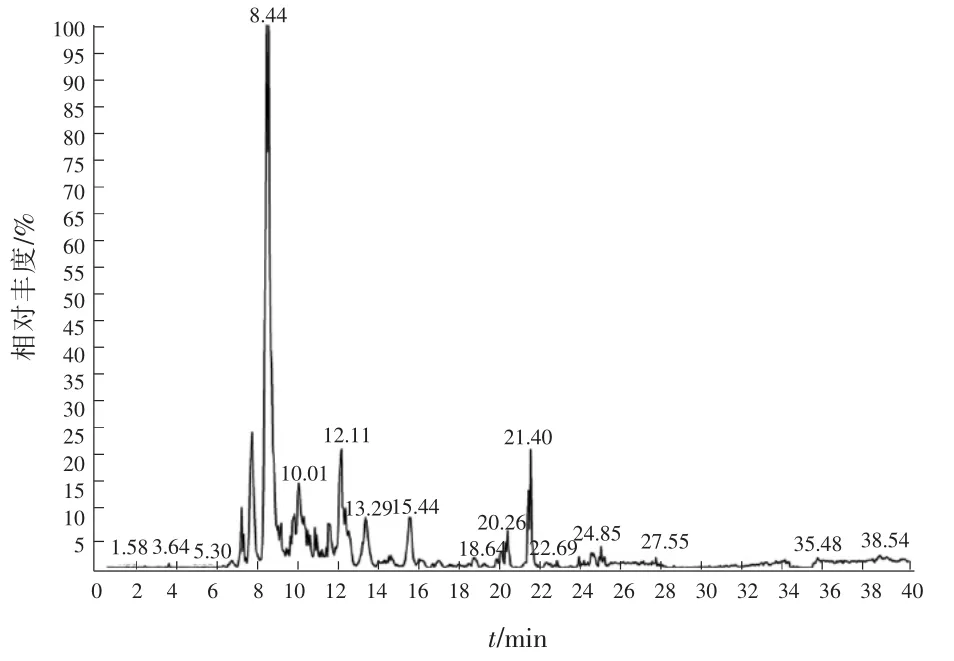
图4 质谱Base peak 图谱
由图4 可以看出,通过对相对分子质量为45.0 kDa 处目的蛋白的质谱鉴定结果分析,得到蛋白覆盖率达到10%~50%,其Delcn 相关因子及Xcorr 相关因子在鉴定的肽段中分别达到了0.1 及2 以上,说明质谱鉴定结果较可信。根据得到的多肽序列与数据库的匹配情况,共分析出637 个唯一肽段,鉴定得到132 种蛋白,其中已知蛋白119 种,未知蛋白13 种,已知蛋白条带鉴定结果见表2。

表2 已知蛋白的质谱鉴定结果
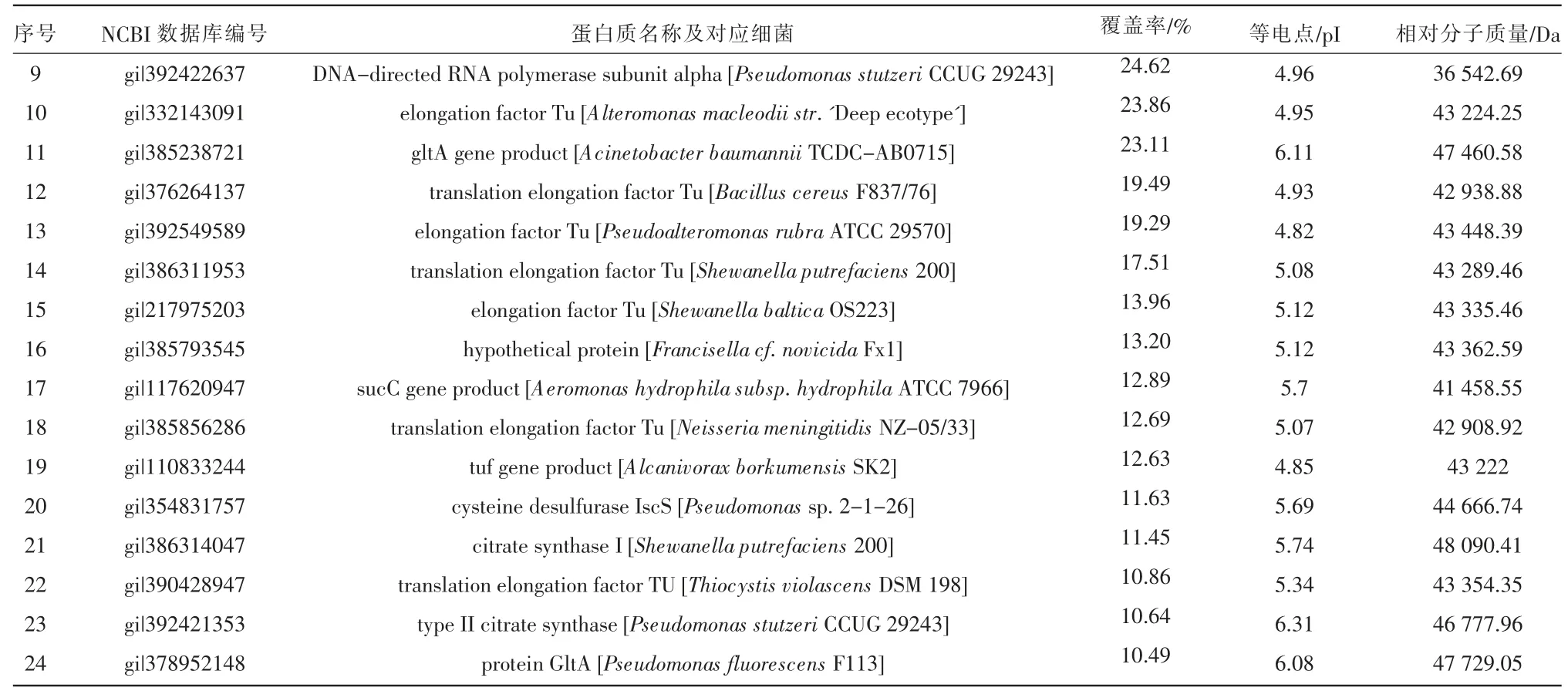
续表
由表2 可以看出,目的条带中主要存在的蛋白有A Chain A,Ef-Tu,tuf-2 gene product,elongation factor Tu,hypothetical protein,tufA gene product,DNAdirected RNA polymerase subunit alpha,gltA gene product,translation elongation factor Tu,hypothetical protein,ferredoxin,sucC gene product,gdhA gene product,cysteine desulfurase,citrate synthase IscS,protein GltA。与蛋白相对应的宿主细菌主要包括Escherichia Coli,Aeromonas hydrophila subsp.,Aeromonas salmonicida subsp.,Klebsiella pneumoniae,Enterobacter aerogenes,Bacillus pseudofirmus,Bacillus cereus,Pseudomonas sp.,Pseudomonas aeruginosa,Pseudomonas stutzeri,Pseudomonas fluorescens,Acinetobacter baumannii,Alteromonas macleodii str.,Pseudoalteromonas rubra,Shewanella putrefaciens,Shewa-nella baltica,Francisella cf.Novicida,Neisseria meningitidis,Alcanivorax borkumensis,Thiocystis violas-cens。其中已报道具有降藻作用的细菌为气单胞菌属(Aeromonas)、肠杆菌属(Enterobacter)、克雷伯氏杆菌属(Klebsiella)、不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)和假交替单胞菌属(Pseudoaltero-monas)。
3 结论
(1)自然水体中无论污染程度严重与否,都保有一个复杂而稳定的微生物生态链。这个生态链在受到藻类冲击时,其总体结构和蛋白表达组成基本能够保持不变。蛋白条带的浓度变化与藻类冲击的强度有直接联系。根据实验结果可大致判断能够耐受或者降解藻类的蛋白酶相对分子质量大小在35.0~45.0 kDa。
(2)结合目的蛋白条带质谱鉴定结果分析,鉴定得到的蛋白相应的细菌与DGGE 测序结果能够较好吻合,如Klebsiella,Acinetobacter,Enterobacter,Bacillus和Pseudomonas等菌在样品的蛋白鉴定结果及DGGE 条带测序结果中均有发现。说明得到表达的蛋白条带中所鉴定到的细菌能够很好的与水体中微生物相对应,且相对应的细菌多数被报道与溶藻相关,Kle bsiella,Acinetobacter,Enterobacter,Bacillus和Pseudomonas均在有关文献报道中被认为具有溶藻、降解有机物以及反硝化聚磷的作用,由此可以推测这5 种菌在水体溶藻方面发挥着重要的作用。
