干旱半干旱煤矿区联合接菌对土壤改良动态生态效应
2021-06-30毕银丽秦芳玲王茁优
毕银丽,江 彬,秦芳玲,王茁优
·农业水土工程·
干旱半干旱煤矿区联合接菌对土壤改良动态生态效应
毕银丽1,2,江 彬2,秦芳玲3,王茁优1
(1. 西安科技大学西部矿山生态环境修复研究院,西安 710054; 2. 中国矿业大学(北京)矿山生态修复研究院,北京 100083;3. 西安石油大学化学化工学院,陕西省油气田环境污染与储层保护重点实验室,西安 710065)
针对干旱半干旱地区煤炭开采造成的生态破坏问题,利用微生物-植物-土壤的综合作用效应,可加快矿区受损生态的修复进程。为评价不同接种微生物在矿区生态修复过程中的动态作用效果,以神东矿区大柳塔采煤塌陷区的紫穗槐(L.)为研究对象,通过原位监测,研究接种不同菌根真菌、解磷细菌或同时接种不同微生物处理对不同复垦年限下紫穗槐植株生长(株高和冠幅)、菌根效应(菌根侵染率和菌丝密度)、土壤养分及性质和复垦4 a不同生长季叶片养分和抗逆性的影响规律,以确定接种不同微生物菌剂对紫穗槐生长的影响和对土壤的改良效果。结果表明,与不接种相比,接种摩西管柄囊霉()、根内球囊霉()及解磷细菌()均能显著增加紫穗槐的株高和冠幅(<0.05),提高其生长旺盛期叶片的氮、磷和钾浓度,提高叶片氮钾的再吸收,降低叶片相对含水率,提高7-9月份叶片脯氨酸、可溶性糖的积累,显著降低土壤pH值(<0.05),提高土壤易提取球囊霉素、总提取球囊霉素、碱解氮、速效磷和速效钾等指标的含量。不同接种处理对紫穗槐生长、菌根侵染率、叶片抗逆性、土壤氮磷钾养分、易提取球囊霉素和总提取球囊霉素含量的影响随着复垦时间的延长具有显著的协同作用。摩西管柄囊霉与解磷细菌同时接种在复垦4 a后仍能促进紫穗槐菌根效应的发挥,促进植物生长,提高植物的养分和抗逆性,改良土壤,在干旱半干旱煤矿区生态修复进程中具有积极作用。
土壤;养分;采煤塌陷;接菌菌剂;紫穗槐;AMF
0 引 言
西部干旱半干旱矿区,生态环境脆弱,煤炭开采造成的地表沉陷,引发的生态问题和次生地质灾害问题(包括耕地破坏、水土流失、植被衰退、土地沙化贫瘠等)更为突出,因此西部矿区生态修复和重建尤为重要和迫切[1-2]。微生物技术在矿区生态修复中具有重要作用,通过给植物接种微生物(包括丛枝菌根真菌、解磷细菌、根瘤菌等),利用接种的优势微生物和植物间的相互关系,可改善植物营养,促进植物生长发育,并能重新建立和恢复土壤微生物体系,加速矿区基质向农业土壤的转化过程,使基质更趋于熟化,从而缩短复垦工程周期[3]。
菌根真菌广泛存在于自然界的土壤中,可与陆地生态系统70%以上的植物形成菌根共生体[4]。菌根共生体及根外菌丝可改善植物养分和水分状况,促进植物生长,提高植物对各种环境胁迫的耐受性[5]。同时菌根真菌分泌球囊霉素,能增加土壤微生物活性、促进土壤团聚体的形成和提高土壤养分,从而显著改善土壤质量[6]。研究表明,AMF(arbuscular mycorrhizal fungi)在煤矿恢复过程中可增加植被生长,并促进环境变化[5]。近年来以菌根真菌作为主要微生物菌剂在中国西部采煤沉陷区开展大规模人工造林重建工程,目前已取得了较好的生态效应[7-8]。王瑾等[9]在采煤沉陷区向紫穗槐接种AMF后,能显著增加其株高、冠幅;毕银丽等[2]研究发现接种菌根真菌在矿区人工干预植物群落演替中起着关键作用,且对维持植物群落结构和功能稳定性起着重要作用;张延旭等[10]发现接种菌根真菌可显著提高采煤塌陷区复垦苜蓿的生物量,有效改善根际土壤质量,表现出较好的生态效应。目前菌根微生物在矿区生态修复中的潜在作用已经被逐渐认识[11-12],研究的热点主要集中于菌根真菌在矿区生态重建中的作用效果,包括植物的生长效应、土壤的结构和肥力等[8-13],但对不同微生物,菌根菌、解磷细菌及其不同微生物同时接种在采矿沉陷区的生态修复作用鲜有报道,而对不同接菌处理在不同复垦年限条件下的原位生态修复动态监测和规律研究也少见报道。紫穗槐(L.)作为豆科紫穗槐属丛生灌木,根系发达,耐干旱、瘠薄,具有较强的保持水土、改良土壤作用,常作为西部采煤沉陷区复垦植物。本文以神东矿区复垦所用紫穗槐为研究对象,研究紫穗槐在干旱少雨、土壤结构不良、肥力低下、微生物稀少的神东矿区修复过程中,其植物生长、菌根生长、土壤养分和理化性质在接种不同微生物条件下随复垦时间的变化规律,同时研究接菌处理对复垦4 a后生长季叶片营养及抗逆性的影响,探究不同接菌组合式在采煤沉陷区生态复垦中的动态生态效应,为采煤沉陷区的植被恢复和土壤改良提供实验支持和理论依据。
1 材料与方法
1.1 研究区概况
试验区位于陕西省神木县神东大柳塔采煤塌陷区(109°13′~110°67′E,38°50′~39°47′N),属于典型的干旱半干旱高原大陆性气候。该地区主要的气候特征[4]为:全年光照充足,年均日照2875.9 h;干旱少雨,年平降水量441 mm(主要集中在7-9月);多风沙,年均大风日数14 d,年均蒸发量1 337 mm,年均气温8.9 ℃。研究区植被退化,种类单一,天然灌木植物是花棒(Mey),草本植被主要以一年生狗尾草()、紫花苜蓿()、赖草()、猪毛蒿()等为主。
该地区表层土壤基本理化性质:pH 值为8.35,有机碳7.36 g/kg,碱解氮32.1 mg/kg,全氮0.60 g/kg,速效磷8.16 mg/kg,速效钾66.2 mg/kg和电导率164S/cm,属于极贫瘠的沙土。
1.2 试验材料与设计
1.2.1 供试菌种
供试AMF菌种为由北京市农林科学研究院植物营养与资源研究所微生物室提供,后经中国矿业大学(北京)微生物复垦实验室通过玉米扩繁得到的根内球囊霉(,记为Ri)和摩西管柄囊霉(,记为Fm)。接种菌剂Ri和Fm为含有宿主植株侵染根段、孢子和菌丝的沙土混合物,其中孢子密度分别为158个/g和126个/g,侵染率分别为91%和90%。
供试解磷细菌()(CA)为本实验室从宁夏粉煤灰样品中自主分离并纯化培养的高效解磷细菌。采用细菌16 SrNDNA测序,通过与GenBank核酸数据库进行BLASTN比对,确定出该菌株为斯式泛菌()。CA菌株接种液为培养至对数生长期的菌液(30 ℃,120 r/min),其OD600为0.84。
1.2.2 供试植物
供试植物为紫穗槐(),为落叶丛生灌木,耐寒、耐干旱能力极强。
1.2.3 试验设计与管理
本试验设6个处理,即单接种Fm、单接种Ri、双接种Fm和Ri(Fm+Ri)、单接种CA、双接种Fm和CA(Fm+CA)、不接种(CK)。每个处理小区面积为480 m2,共5行,每行31株,苗木平均株高26.5 cm,冠幅20.4 cm,种植规格均为2 m×2 m。
2012年4月中旬进行紫穗槐栽植,浇水达土壤田间持水量,以后每周浇水1次,1个月后免浇水自然管理。2012年7月中旬对栽种紫穗槐进行菌剂接种,其中单接AMF处理每株植物穴施菌剂50 g;单接CA处理穴施10%CA接种液100 mL;双接AMF处理,每穴同时施加Fm和Ri菌剂各50 g;双接AMF与CA处理,每穴同时施入Fm菌剂50 g和10%CA接种液100 mL。每穴接种完成后覆土,浇水达土壤田间持水量。
1.3 样品采集与处理
1)根际土壤样品的采集
在各处理区随机选取植株大小较一致的紫穗槐作为定期采样点进行标记,分别于2012、2013年和2015年9月中旬采集新鲜的根际土壤(0~10 cm)样品并编号。采集的土样装入无菌自封袋带回实验室,根际土壤自然风干后,剔除杂物过1 mm筛备用。
2)植物叶片样品的采集
2015年6-9月每月分别采集各处理区标记采样点的紫穗槐叶片样品。采集的鲜叶用自封袋封存于4℃冰盒,并迅速在实验室于4 ℃冰箱中冷藏,用于分析植物叶片的养分浓度和抗逆性指标。
1.4 指标测定和方法
1.4.1 植株生长指标测定
1)紫穗槐株高和冠幅
用钢卷尺测量选定植株的株高和冠幅。
2)叶片养分指标
对2015年8月和9月采集的叶片样品进行养分浓度测定。叶片经硫酸-过氧化氢消煮获得消化样品,分别采用凯氏定氮法和钒钼黄比色法测定消化样品的全氮和全磷含量(以质量分数(%)表示)[14],采用ICP-AES法测定消化样品中的全钾含量[14]。
3)叶片抗逆性指标
对2015年6-9月采集的叶片样品进行叶片的抗逆性指标测定。参照高俊山等[15]方法采用干质量法测定叶片相对含水率、浸泡法测定叶片的相对电导率、酸性印三酮显色法测定叶片中脯氨酸的含量及蒽酮比色法测定叶片中可溶性糖的含量。
1.4.2 土壤基本理化指标
土壤基本理化指标参照鲍士旦[14]方法测定,其中土壤有机碳采用重铬酸钾氧化法测定;全氮采用凯氏定氮法测定;速效磷采用NaHCO3浸提-钼锑抗比色法测定;速效钾采用醋酸铵浸提和ICP-AES法测定;碱解氮采用碱解扩散法测定;采用电位法测定土壤pH值(水土比2.5∶1)和电导率(水土比5∶1)。
1.4.3 菌根相关指标
采用Phillips和Hayman法的KOH脱色-曲利苯蓝染色法测定菌根侵染率[16];菌丝密度测定采用真空泵微孔滤膜抽滤-网格交叉法测定[17]:易提取球囊霉素(easily extractable glomalin,记为EE-GRSP)和总球囊霉素(total glomalin,记为T-GRSP)采用Wright等[18]的改进方法进行提取和测定。
1.5 数据处理方法
所有试验数据采用Microsoft Excel 2010软件进行均值和标准差计算;采用统计分析软件SAS8.1(SAS INSTITUTE INC,2006)进行方差分析(LSD检验法,显著性差异水平设置为0.05。
2 结果与分析
2.1 不同接菌处理对紫穗槐生长的影响
表1为不同复垦时间紫穗槐在不同接菌处理条件下株高和冠幅的生长情况。由表1可见,不同复垦年限条件下,各处理紫穗槐的株高和冠幅均随着复垦时间的延长而增大,其中接种Fm、CA、Fm+Ri和Fm+CA处理紫穗槐的株高在不同复垦年间差异显著,而各处理紫穗槐的冠幅在不同复垦年间均差异显著(<0.05);在复垦第4a,接种CA和Fm+CA处理紫穗槐的株高和冠幅较其1a时均显著增大,对于株高分别增加191%和213%,而冠幅则分别增加562%和567%,表明随着复垦时间的延长,接种解磷细菌及Fm+CA对于紫穗槐冠幅生长较其株高更具有促进优势。
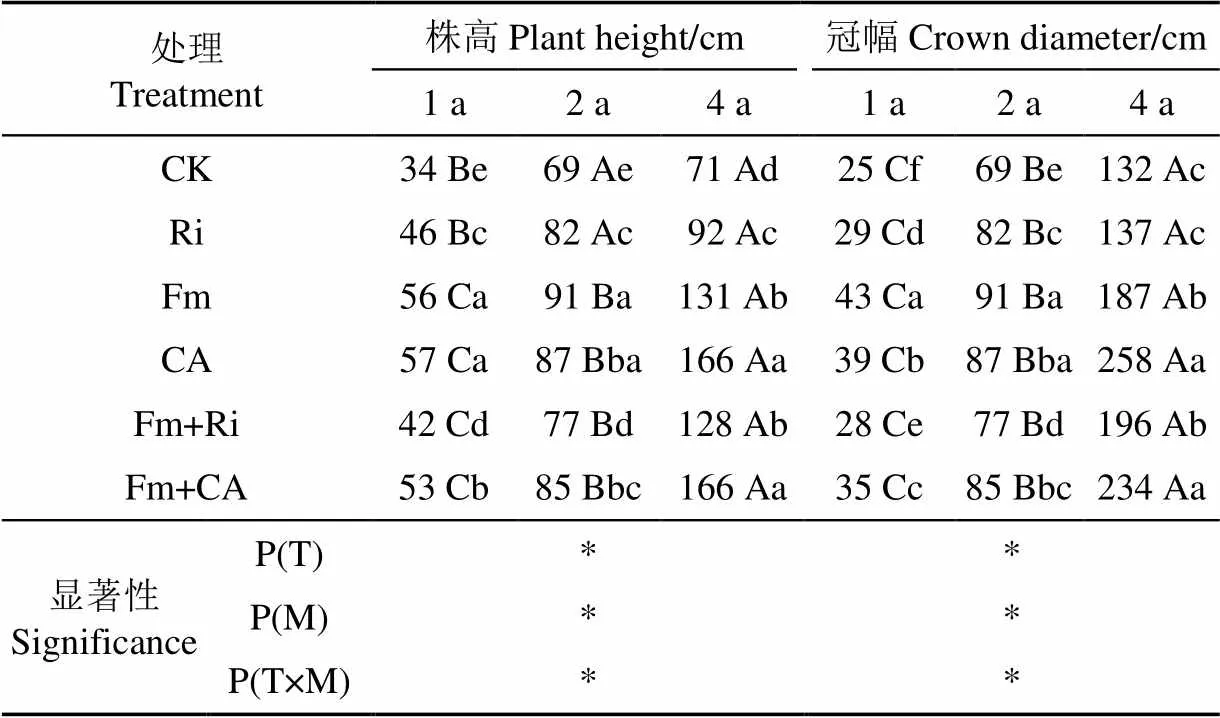
表1 不同接菌处理对紫穗槐生长的影响
注:表中数据为复垦1a、2a、4a连续监测所得,取5个重复均值,同列不同小写字母表示同一复垦年限各处理间具有显著差异(<0.05),同行大写字母表示同一处理在不同复垦年限下的差异显著(<0.05)。P(T)表示在时间尺度下各指标的差异显著性;P(M)为接菌条件下各指标的差异显著性;P(T×M)为时间尺度与接菌处理交互作用对各指标的差异显著性;*表示在0.05水平差异显著。下同。
Notes: Figures for continuous monitoring at 1a, 2a, 4a in the table are the mean values of five repeats. The different small letters within the same column mean the significant difference (<0.05) at the same reclamation of the inoculation. The different capital letters in the same row indicate the significant difference (<0.05) of the same processing under different reclamation years. P(T) indicates significant difference in time scale. P(M) indicates the significant difference in the inoculation conditions. P(T×M) means the interactions between inoculation and time scale. The signal “*”shows the significant difference at 0.05 level. Same as below.
同一复垦年限中,接菌处理紫穗槐的株高和冠幅(除复垦4a的Ri处理外)均显著高于其对照处理(<0.05),其中接种CA和Fm+CA处理紫穗槐的株高和冠幅均显著高于其他处理;随着复垦时间的延长,接种CA与Fm+CA对紫穗槐株高和冠幅的影响优势显著(<0.05),且处理间的差异显著性消失,表现为在复垦2a时两者较其CK处理可使紫穗槐的株高分别增高21%和23%,冠幅分别增加26%和23%,而在复垦4a时两处理较其相应的CK处理可使紫穗槐株高均增高达133.8%,冠幅分别增加95%和77%。由此可见,解磷细菌及其与菌根真菌Fm双接种可显著促进紫穗槐的生长,尤其是对紫穗槐植株冠幅生长的促进优势更为明显,且随着复垦时间的延长接种处理对紫穗槐生长的促进作用越显著,表现出强烈的时间效应。
2.2 不同接菌处理对菌根侵染率和菌丝密度的影响
由表2可见,不同接种处理和不同复垦时期紫穗槐的菌根侵染率和菌丝密度均达到差异显著性,同时它们间存在明显的交互作用,可对紫穗槐根系的菌根侵染率和菌丝密度产生显著影响。
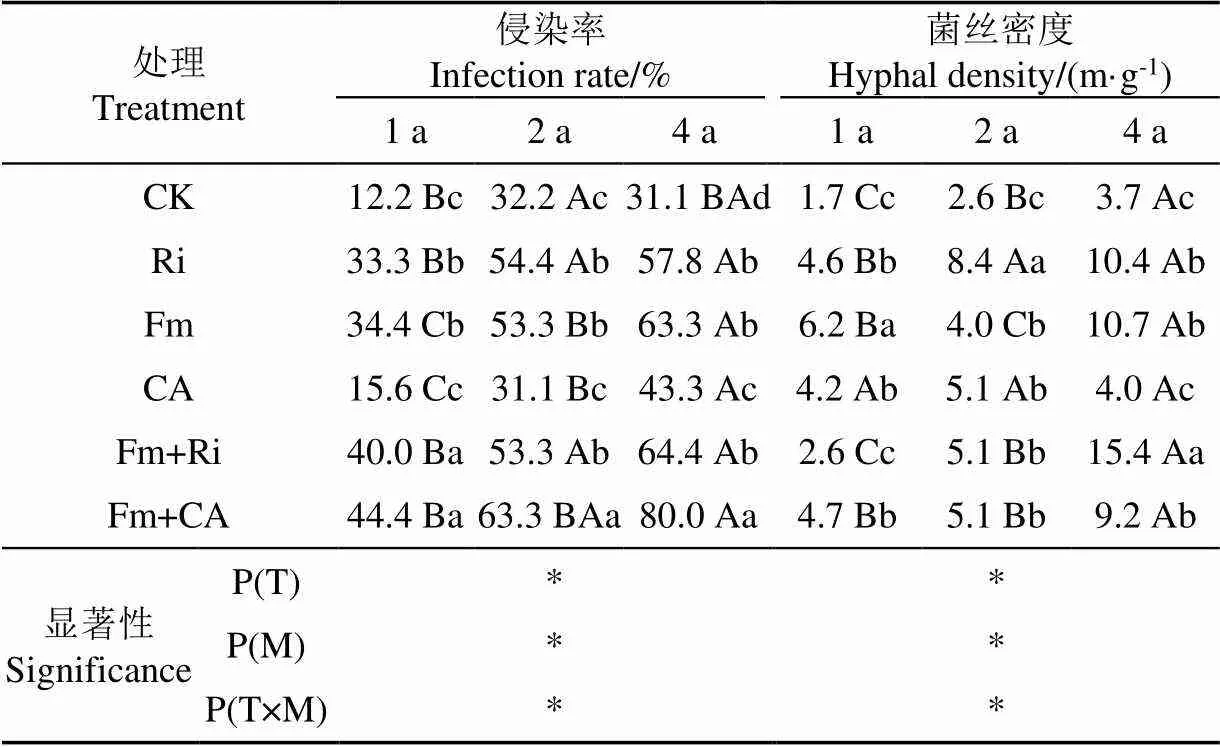
表2 不同接菌处理对紫穗槐菌根侵染率和菌丝密度的影响
在自然条件下(CK处理)或接种CA时,紫穗槐根系均有菌根侵染和一定的菌丝密度,表明菌根真菌是普遍存在于土壤的微生物种类;CK处理和接种CA处理紫穗槐根系的菌根侵染均随着复垦时间的延长而增大,在复垦4a时,后者与前者出现差异显著性(<0.05),表明解磷细菌对自然界菌根真菌对紫穗槐根系的侵染存在时间效应,但两者在菌丝密度间无显著差异。
由表2可见,各处理紫穗槐根系的菌根侵染率和菌丝密度(除Fm外)均随复垦年限延长而增加。复垦年限相同条件下,接菌处理紫穗槐的菌根侵染率均显著高于其对照处理(除CA处理复在复垦1 a和2 a外);双接种处理可使紫穗槐根系快速受到菌根侵染,表现为在复垦1a时其菌根侵染率均可达40%以上,且随复垦时间的延长其菌根浸染率不断增大,尤其是Fm+CA处理可使紫穗槐根系在复垦4a的菌根侵染率时达到80%,较其CK、CA和Fm处理分别增加156.6%、84.3%和26.4%,表明CA和Fm对提高紫穗槐菌根侵染率具有显著的正交互作用,可使紫穗槐根系的菌根侵染优势显著,进而有利于植物根系从土壤中获取营养物质,发挥共生体的优势,从而使该处理紫穗槐的株高和冠幅生长较其他处理更显著。复垦4a时,Fm+Ri处理的紫穗槐菌根侵染率显著低于Fm+CA处理,但其菌丝密度最高,达到15.4 m/g,显著高于Fm+CA处理。对照各植株生长情况(表1),结果表明菌根侵染率较菌丝密度对紫穗槐生长的影响更为显著。
2.3 不同接菌处理对紫穗槐生长季叶片养分含量的影响
为了解各接菌处理对紫穗槐叶片养分季节变化的影响,对复垦4 a时处于生长季(8-9月)紫穗槐叶片的氮磷钾含量分别进行监测分析,结果见表3。由表3可见,8月紫穗槐叶片的氮、磷和钾含量均高于其9月各指标的含量(<0.05)。这主要是由于8月紫穗槐处于生理活动旺盛期,需要更多的元素用于合成蛋白质和核酸等,以维持叶片光合作用和细胞分裂细胞等活动,而9月气温下降,紫穗槐叶片生理活动减弱,养分再吸收造成其含量下降,产生“稀释效应”[19]。
复垦4a后紫穗槐叶片的氮含量在不同接菌处理间表现不同(见表3)。除Fm处理外,其他接菌处理紫穗槐叶片的全氮含量在8月均显著高于CK处理(<0.05),表明这些各接菌处理均可显著促进紫穗槐植物根系对氮的吸收,但进入9月,除Ri处理外,其他接种处理反而使紫穗槐叶片的氮含量显著低于CK处理(<0.05),表明接种处理使紫穗槐在秋季养分再吸收率高,从而造成氮养分含量下降。

表3 不同接菌处理对紫穗槐叶片养分浓度的影响
注:表中数据为2015年(复垦4a)8、9月监测数据,取5个重复均值。同列不同小写字母表示各处理间具有显著差异(<0.05),同行大写字母表示同一处理在不同月份的差异显著(<0.05)。P(T)表示在不同月份下各指标的差异显著性;P(M)为接菌条件下各指标的差异显著性;P(T×M)为月份与接菌处理交互作用对各指标的差异显著性,NS表示差异不显著,下同。
Notes: The data are the mean values of five replicates, monitored at August, September in 2015. Figures in the table are the mean values of five repeats. The different small letters within the same column mean the significant difference (<0.05) at the same reclamation of the inoculation. The different capital letters in the same row indicate the significant difference (<0.05) of the same processing under different months. P(T) indicates significant difference in different months. P(M) indicates the significant difference in the inoculation conditions. P(T×M) means the interactions between different inoculation and months. NS indicates no significant difference. Same as below.
复垦4a后紫穗槐叶片的磷和钾含量在不同接菌处理间的变化规律较为相似。无论是在8月还是在9月,接种Fm+Ri处理紫穗槐叶片的磷和钾含量均显著低于其他处理,表明该双接种处理影响紫穗槐叶片中磷钾的吸收和积累。从磷含量来看,在8月接种Ri、CA、Fm和Fm+CA处理紫穗槐叶片的磷含量与CK间无显著差异(<0.05),但进入秋季9月,接种菌根真菌处理Ri或Fm使紫穗槐叶片的磷含量均显著高于对照及其他处理,且季节与接种处理对叶片磷含量的影响无交互作用(见表3),表明接种处理对紫穗槐磷养分再吸收的影响不显著,这与宁秋蕊等[20]的研究结果具有一致性,即认为叶片氮再吸收效率与年均气温、年均降雨量呈负相关关系,而磷再吸收与两者间的相关性不显著。
从叶片钾含量来看,8月接种Ri、Fm+CA和CA处理紫穗槐叶片的钾含量均显著高于其CK处理(<0.05),表明这些接菌处理可显著紫穗槐对土壤钾元素的促进吸收和利用,而进入9月,除CA处理外,其他接菌处理紫穗槐叶片的钾含量均显著低于对照处理(<0.05)。由表3可见,季节变化与接种处理使紫穗槐叶片全钾和全氮含量具有在显著的交互作用,接菌处理可显著促进紫穗槐叶片在秋季的养分再吸收,引起含量下降,而K在植物体内主要以离子态存在,流动性强,导致叶片脱落前其再吸收率高[21]。
2.4 不同接菌处理对紫穗槐生长季叶片抗逆性的影响
由于神东矿区属于典型半干旱、半沙漠温带大陆性气候,年降雨量少,植物在生长季受干旱胁迫,其抗逆性成为该矿区植物生存的关键因素之一。对复垦4a后紫穗槐叶片在生长季(6-9月)的抗旱性指标进行分析测定,以了解接种处理对复垦区植物的抗逆性的影响,结果见表4。
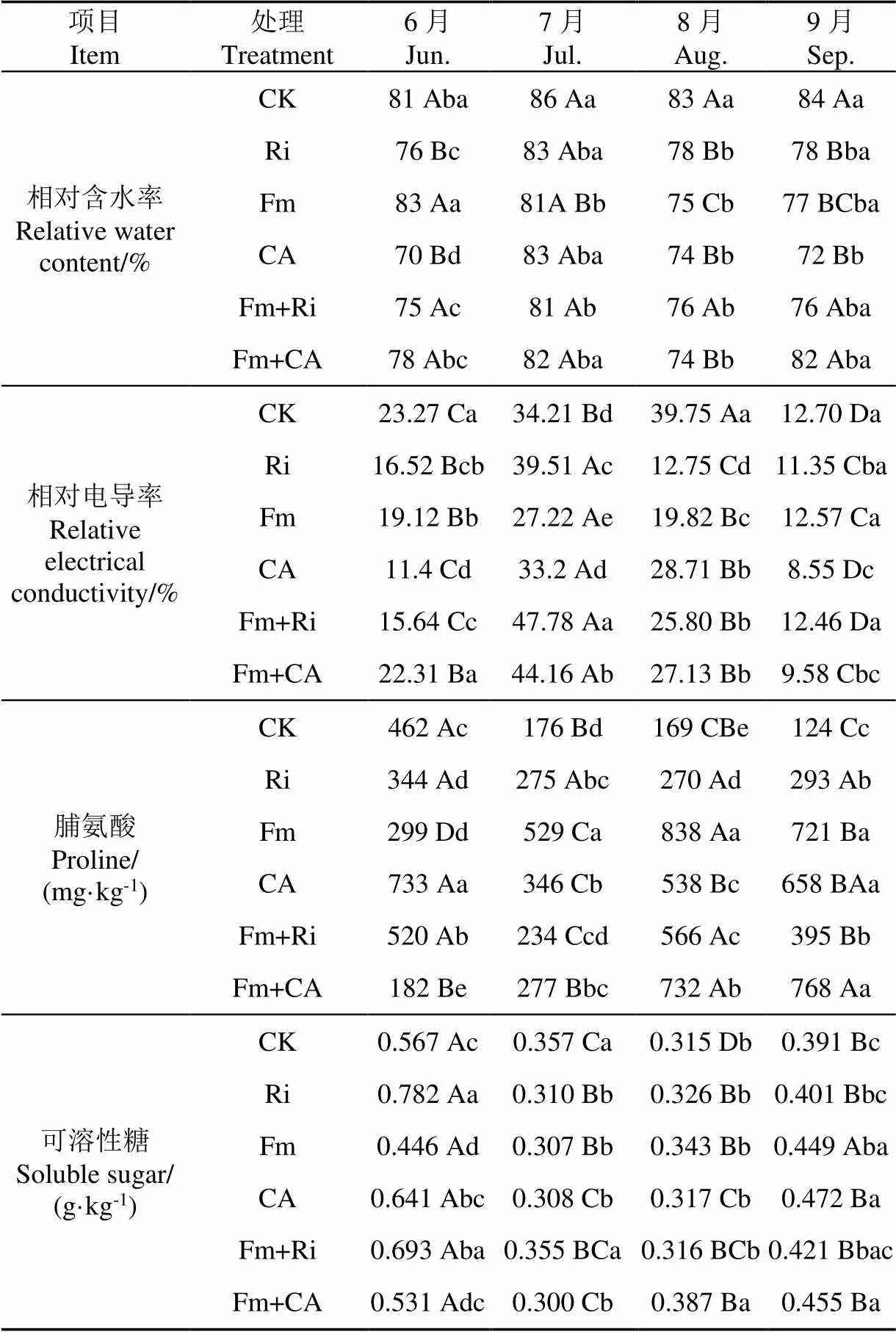
表4 不同接种处理对生长季紫穗槐叶片抗逆性的影响
注:表中数据为2015年6、7、8、9月监测数据,取5个重复均值。
Notes: The data are the mean values of five replicates, monitored at June, July, August, September in 2015.
由表4可知,在同一生长月份,与对照处理相比,接菌处理均可显著降低紫穗槐叶片的相对含水率(<0.05),而各接菌处理紫穗槐叶片的相对含水率间无明显变化规律。各处理紫穗槐叶片的相对含水率在生长季均差异不大,总体表现为随时间先增后降低的趋势,7月、8月和9月各接菌处理紫穗槐叶片的相对含水率分别为81%~83%、74%~78%和72%~82%,这可能是由于7、8月正是当地高温季节,干旱少雨,植物受干旱胁迫,需要提高其叶片的相对含水率以保证植物叶片正常的生理活动。接种处理与生长季节对紫穗槐叶片相对含水率的影响无交互作用(见表5)。
由表4可见,不同处理紫穗槐叶片相对电导率在生长季均呈现出随时间先增后减的规律,即在7月显著高于其他时期(<0.05),在9月最低,可见在7月高温干旱季节紫穗槐叶片受到的胁迫伤害最大。在同一生长月份,各处理紫穗槐叶片的相对电导率的变化规律不一致,6和8月各接菌处理紫穗槐叶片的相对电导率均显著降低其相应的CK处理,表明接菌处理均可降低紫穗槐叶片的膜损伤,使其抗逆性增强;在7月,单接菌Fm和CA处理紫穗槐叶片的相对电导率均低于CK,而Ri和双接种接菌处理紫穗槐叶片的相对电导率均显著高于对照处理(<0.05),表明不同接菌处理在高温干旱季节对紫穗槐叶片的抗逆性影响不同,解磷细菌和Fm双接种菌根侵染率虽然最高,土壤菌丝体有利于其根系吸收水分,但可能由于其植株高大对水分需求量大,蒸发量也相对较大,水分获取相对不足,引起胁迫伤害,叶片的相对电导率增大。
脯氨酸和可溶性糖作为渗透调节物质,在植物遭受非生物胁迫时,植物在体内积累脯氨酸和可溶性糖以提高其抗性[22]。由表4可见,在7-9月接菌处理紫穗槐叶片中脯氨酸含量均高于对照处理,表明接种微生物可提高该地区紫穗槐在夏季高温干旱季节的抗逆性,但各处理在不同月份的紫穗槐叶片脯氨酸含量无明显变化规律。在6月,CA处理紫穗槐叶片的脯氨酸含量显著高于其他处理,是其CK处理的158.7%,而Fm+CA处理最低,仅为CK处理的58.7%;Fm+CA处理紫穗槐叶片的脯氨酸含量随季节时间延长而不断显著增加;Fm处理紫穗槐叶片的脯氨酸含量随时间延长而先显著增加,随后又显著降低;Fm+Ri处理紫穗槐叶片的脯氨酸含量随时间呈先降低再增加又下降的规律。从脯氨酸含量来看,8和9月的Fm、CA及各双接种处理紫穗槐叶片的脯氨酸含均较高,表明对提高紫穗槐叶片的抗旱性具有一定作用。
不同处理紫穗槐叶片的可溶性糖含量在生长周期中随时间增加先减少后增大的趋势,其中在6月最高,7月最低。在同一生长月份各处理紫穗槐叶片的可溶性糖含量间也无明显变化规律,在6月各接菌处理除Fm处理外,紫穗槐叶片可溶性糖含量均显著高于其CK处理;在7月CK和Fm+Ri处理紫穗槐叶片的可溶性糖含量均显著高于其他处理,其他处理间的叶片可溶性糖浓度无显著差异;8、9月Fm+CA处理紫穗槐叶片的可溶性糖含量均显著高于其他处理。
由表5可见,不同接种处理间和不同生长时期紫穗槐叶片的相对含水率、相对电导率、脯氨酸含量和可溶性糖浓度达到差异显著性(<0.05),表明接种处理和生长时间对紫穗槐的抗逆性均具有显著影响。另外,不同接种处理和不同生长时期间存在交互作用,均可显著影响紫穗槐叶片的相对电导率、脯氨酸含量和可溶性糖浓度,对增强紫穗槐的抗旱和抗衰老性具有显著作用。

表5 不同接种处理对生长季紫穗槐叶片抗逆性影响的显著性分析
2.5 不同接菌处理对土壤基本理化性质的影响
表6为不同接菌处理在不同复垦年份中对土壤各基本理化指标的影响。对于土壤pH值,随着复垦时间的延长,不同处理土壤pH值的变化规律基本为:2a<4a<1a,且均表现为由碱性(8.1~8.3)逐渐呈中性(6.73~7.75)。复垦4a后,各接菌处理土壤pH均显著低于对照处理土壤的pH,且均呈中性,表明接菌处理可使碱性土壤的得以改良为适宜植物生长的中性土壤。
由表6可见,各处理土壤电导率在不同复垦年间均存在差异显著性(<0.05),且均表现为先降后升,在复垦1a时各处理土壤的电导率在130~160S/cm,在复垦2a是为26~45S/cm,在复垦4a后又升至59~96S/cm,表明紫穗槐复垦使该矿区土壤的含盐量显著降低,降低土壤的盐碱化。不同接菌处理对土壤电导率的影响不显著。无明显的变化规律(见表7)。在复垦4a后,Fm、Fm+CA和Fm+Ri处理较CK处理可使土壤的电导率分别显著降低9.9%、25%和35%,Fm和 CA或Ri间及其与复垦时间间存在的显著交互作用(见表7),能使土壤的电导率显著降低,表明复垦时间越久,紫穗槐双接种处理对土壤盐碱化的改良作用逐渐突显。
由表6可见,各处理土壤有机碳含量、碱解氮含量和速效磷含量随复垦时间延长整体呈不断递减的变化规律,而土壤速效钾含量则呈先降低后升高。与CK处理相比较,在复垦2a和4a时接种Ri、Fm、Fm+CA和Fm+Ri均可显著提高处理土壤有机碳含量(<0.05),说明丛枝菌根侵染紫穗槐根系促进了根际土壤有机碳的累积。在同一复垦年份中,接菌处理土壤的碱解氮、速效磷和速效钾含量均显著高于其相应的对照处理,表明接种菌根真菌、解磷细菌或其双接种有利于土壤氮磷钾养分的积累。由表7可见,时间尺度、接种处理及它们交互作用对土壤氮、磷和钾含量的影响存在差异显著性(<0.05),表明接菌处理和复垦时间对土壤养分具有显著影响。

表6 不同接菌处理对土壤理化性质的影响

表7 不同接种处理对土壤理化性质影响的显著性分析
有研究表明丛枝菌根真菌可分泌球囊霉素的相关蛋白,并认为土壤中球囊霉素含量与有机碳呈正相关关系[23]。由表6可知,各处理土壤的EE-GRSP和T-GRSP含量总体表现为在复垦1a均显著高于其他复垦年;除Ri和Fm+CA处理外,其他处理土壤的EE-GRSP含量在2a和4a年间无显著差异;Fm、CA和Fm+CA处理土壤的T-GRSP含量在复垦4a时显著高于其2a,但Fm+Ri处理土壤的TG含量则在复垦4a时显著低于其2a的含量。同一复垦时间条件下,接菌处理的EE-GRSP和T-GRSP含量均显著高于其CK处理,表明接种丛枝菌根真菌和解磷细菌均具有提高土壤中球囊霉素的作用,但其球囊霉素含量与土壤有机碳含量间未必正相关。
由表7可见,接菌处理、复垦年限及其它们间的交互作用对土壤中EE-GRSP和T-GRSP含量具有显著影响,(<0.05)。对比复垦4a时接种Ri、Fm和Fm+Ri处理土壤的EE-GRSP含量,可以看出它们间随着复垦时间的延长具有协同作用,接种CA和Fm对处理土壤的TG含量也表现出同样的时间效应。
3 讨 论
神东矿区地处干旱半干旱地区,水分和养分不足常导致植物成活率低和长势差,采煤沉陷加剧水土流失,使植物生长更加困难。大量研究表明,菌根真菌能通过改善宿主植物营养状况、生理代谢及对恶劣环境(干旱、盐碱、低温、重金属等)的适应能力促进煤矿复垦区植物的生长[9-11],同时对煤矿复垦区退化的土壤具有改良作用[7-10]。解磷细菌通常通过合成和分泌磷酸酶和一些有机酸类,促进土壤中难溶性的磷酸转化为可溶性磷[24],有利于植物对磷的吸收利用,而解磷细菌与菌根真菌同时接种对植物生长具有积极的促进作用[25]。本研究表明接种根内球囊霉(Ri)、摩西管柄囊霉(Fm)、解磷细菌及它们的不同双接菌处理均可促进紫穗槐的株高和冠幅的显著增加,有力促进了紫穗槐的生长,且随着复垦时间延长,各接种微生物处理对紫穗槐生长的促进作用越显著,表明菌根真菌、解磷细菌或它们之间的相互作用对神东矿区采煤沉陷区的紫穗槐复垦过程中具有显著的生物效应。
叶片养分含量与植物的生长发育状况密切相关,不同生长季叶片的营养状况不同[20]。叶片在衰老过程中通过养分再吸收,可提高植物的养分利用效率,也可降低植物对土壤环境的依赖性,对生长在贫瘠土壤的植物具有十分重要的意义[19]。本研究发现在生长旺盛期,接菌处理可显著提高紫穗槐叶片的氮、磷、钾含量,这与其它研究结果所报道的菌根真菌[10-11]、解磷细菌[26]、菌根真菌间及其与解磷细菌的相互作用[25]对矿区修复植物营养吸收的促进作用具有一致性。当紫穗槐进入生长秋季,气温下降,不同接菌处理紫穗槐叶片氮、磷和钾含量均能表现出显著的再吸收现象(即与其相应8月分含量相比显著下降),表明接种微生物可显著提高紫穗槐的养分保存能力和对养分的利用效率,有利于紫穗槐能更好地适应干旱贫瘠的矿区生境。另外,宁秋蕊等[20]认为叶片氮和钾再吸收效率与物候变化呈负相关关系,这与本研究结果具有一致性,尤其是对紫穗槐叶片的氮含量,不管接菌与否,进入9月其叶片含氮量均出现显著回流,表现出对季节变化的强烈相应,且接种微生物处理更有利于叶片氮的再吸收,接菌处理和季节变化(可能主要与年均气温)间植物叶片N再吸收具有显著的交互作用,可见在矿区复垦接种微生物对植物氮养分的再吸收及高效利用具有重要意义。本研究发现,不同接种处理对紫穗槐叶片磷的再吸收影响不一,其中菌根真菌Fm、Ri和Fm+CA)的磷再吸收显著低于不接种处理,可能与菌根真菌菌丝体更有利于紫穗槐根系吸收土壤中磷有关[4],但接种微生物种类和季节变化对紫穗槐P再吸收无交互影响作用。
神东矿区地处西北干旱半干旱区,水热条件不均,环境胁迫严重,植物为了抵御干旱胁迫,通过调节体内的相对含水率、电解质及渗透调节物质适应环境以保证自身生长。本研究发现,接菌处理可降低紫穗槐叶片的相对含水率和电导率,提高紫穗槐叶片中脯氨酸和可溶性糖的积累,有利于植物在干旱环境下能正常生长。这与郭辉娟等[27]、贺学礼等[28]研究结果具有一致性。同时,解磷细菌与AM真菌协同对促进紫穗槐生长、菌根侵染和抗逆性效果明显,这与其他研究两者双接种对植物生长影响的结果[25]具有一致性,因此可通过菌根真菌和解磷细菌同时接种来提高矿区因气候恶劣造成的植物成活低,发育慢等问题[1],对增强矿区修复植物抗逆性、加快矿区修复进程具有重要意义。
在矿区复垦过程中,大量研究发现菌根真菌产生的球囊霉素是植物根际土壤碳、氮的重要来源,对土壤理化性质和结构的改良具有积极作用[29]。本研究发现,接菌处理可提高根际土壤有机碳的积累,显著提高T-GRSP、EE-GRSP含量,与王瑾等[9]研究结果一致。同一复垦年限,接菌处理可显著增加土壤氮、磷、钾养分,降低土壤pH值和电导率,与王瑾等[9]、张延旭等[10]、杜慧平等[30]研究一致,这可能是菌根菌丝具有酸化菌丝际土壤的能力,从而降低土壤pH值和电导率,使盐碱土壤的pH更适于植物和土壤微生物的生长。同时菌丝能伸展到根系养分吸收范围以外,有效地吸收根系不能吸收的矿质元素,增加根际土壤养分累积[1,3,10],为恢复矿区土壤肥力提供技术支持。
随着复垦年限的增加,各处理土壤pH、电导率、碱解氮和速效钾均呈现出先减后增的规律,可能因为紫穗槐生长初期,由于苗株生长发育较快,所需养分高,接种的微生物也需吸收养分保证自身繁殖,导致复垦两年后,土壤根际养分急剧降低,而在复垦4a后,紫穗槐生长速度放缓,微生物在土壤中形成稳定的群落,侵染率提高,菌丝密度增大,非根际土壤矿物养分吸收聚集,提高了根际养分浓度。复垦时间和接种菌根真菌或(和)解磷细菌菌对矿区修复植物生长、菌根侵染、植物养分吸收、抗逆性和土壤改良具有积极的作用,并随着复垦时间的延长表现出显著和积极的生态效应。
4 结 论
对采煤塌陷区采用接种不同菌根真菌或(和)解磷细菌进行生态修复,经原位监测不同复垦年份紫穗槐的生长、抗逆性及矿区土壤的理化性质,揭示复垦矿区植物接种微生物对植物生长和抗逆性及土壤养分和性质的动态变化规律,为塌陷矿区生态的可持续治理提供理论和技术支持。
1)接种菌根真菌和(或)解磷细菌可显著促进紫穗槐的生长,改善植株氮磷钾营养状况,提高叶片脯氨酸与可溶性糖含量,降低叶片的相对电导率和相对含水率,提高紫穗槐的抗逆性和对矿区环境的适应能力,有利于矿区复垦植被的生长发育和修复。
2)接种菌根真菌和(或)解磷细菌可显著提高紫穗槐的菌根侵染率及菌丝密度,增加土壤球囊霉素和有机碳含量,使矿区碱性土壤趋于中性,降低土壤的含盐量盐碱化,有利于土壤氮磷钾养分的积累,对于复垦矿区退化土壤质量的提升效果明显。
3)接菌处理对矿区修复植物生长、菌根侵染、植物养分吸收和再吸收、抗逆性和土壤改良具有积极的作用,并表现出显著的时间效应。
[1] Xiao W, Hu Z Q, Fu Y H. Zoning of land reclamation in coal mining area and new progresses for the past 10 years[J]. International Journal of Coal Science & Technology, 2014, 1(2): 177-183.
[2] 毕银丽,申慧慧. 西部采煤沉陷地微生物复垦植被种群自我演变规律[J]. 煤炭学报,2019,44(1):307-315.
Bi Yinli, Shen Huihui. Effect of micro-reclamation on different planted forest on the vegetation self-succession in the western mining subsidence area[J]. Journal of China Coal Society, 2019, 44(1): 307-315. (in Chinese with English abstract)
[3] 马彦卿. 微生物技术在矿区生态重建中的作用[J]. 采矿技术,2001,1(2):66-68.
[4] Brundrett M C, Tedersoo L. Evolutionary history of mycorrhizal symbioses and global host plant diversity[J]. New Phytologist, 2018, 220: 1108-1115.
[5] Barea J, Palenzuela J, Cornejo P, et al. Ecological and functional roles of mycorrhizas in semiarid ecosystems of Southeast Spain[J]. Journal of Arid Environments, 2011, 75(12): 1292-1301.
[6] Vasconcellos R L, Bonfim J A, Baretta D, et al. Arbuscular mycorrhizal fungi and glomalin-related soil protein as potential indicators of soil quality in a recuperation gradient of the atlantic forest in Brazil[J]. Land Degradation & Development, 2016, 27(2): 325-334.
[7] Bi Y L, Wang K, Wang J. Effect of different inoculation treatments on AM fungal communities and the sustainability of soil remediation in Daliuta coal mining subsidence area in northwest China[J]. Applied Soil Ecology, 2018, 132: 107-113.
[8] Bi Y L, Zhang J, Song Z H, et al. Arbuscular mycorrhizal fungi alleviate root damage stress induced by simulated coal mining subsidence ground fifissures[J]. Sci Total Environ, 2019, 652: 398-405.
[9] 王瑾,毕银丽,邓穆彪,等. 丛枝菌根对采煤沉陷区紫穗槐生长及土壤改良的影响[J]. 科技导报,2014,32(11):26-32.
Wang Jin, Bi Yinli, Deng Mubiao, et al. Effects of arbuscular mycorrhiza on growth ofL. and soil improvement in coal mining subsidence area[J]. Science & Technology Review, 2014, 32(11): 26-32. (in Chinese with English abstract)
[10] 张延旭,毕银丽,王瑾. 接种菌根对采煤沉陷区苜蓿生长及土壤改良影响研究[J]. 煤炭科学技术,2020,48(4):142-147.
Zhang Yanxu, Bi Yinli, Wang Jin. Research on effect of arbuscular mycorrhizal fungi on alfalfa growth and soil improvement in mining subsidence area[J]. Coal Science and Technology, 2020, 48(4): 142-147. (in Chinese with English abstract)
[11] 王志刚,毕银丽,李强,等. 接种AM真菌对采煤沉陷地复垦植物光合作用和抗逆性的影响[J]. 南方农业学报,2017,48(5):800-805.
Wang Zhigang, Bi Yinli, Li Qiang, et al. Effects of Arbuscular mycorrhizal fungus on photosynthesis and stress resistance of reclamation plants in coal mining subsidence areas[J]. Journal of Southern Agriculture, 2017, 48(5): 800-805. (in Chinese with English abstract)
[12] Bi Y L, Xiao L, Guo C, et al. Revegetation type drives rhizosphere arbuscular mycorrhizal fungi and soil organic carbon fractions in the mining subsidence area of northwest China[J]. Catena, 2020, 195: 104791
[13] Xiao L, Bi Y L, Du S Z. Response of ecological stoichiometry and stoichiometric homeostasis in the plant-litter-soil system to re-vegetation type in arid mining subsidence areas[J]. Journal of Arid Environments, 2021, 184: 104298.
[14] 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2005.
[15] 高俊山,蔡永萍. 植物生理学实验指导[M]. 北京:中国农业大学出版社,2010.
[16] Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55(1): 158-160.
[17] Abbott L K, Robson A D, De Boer G. The effect of phosphorus on the formation of hyphae in soil by the vesicular-arbuscular mycorrhizal fungus,[J]. New Phytol, 1984, 97(3): 437-446.
[18] Wright S F, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi[J]. Plant and Soil, 1998, 198(1): 97-107.
[19] 刘波,王力华,阴黎明,等. 两种树龄文冠果叶N、P、K的季节变化及再吸收特征[J]. 生态学杂志,2010,29(7):1270-1276.
Liu Bo, Wang Lihua,Yin Liming, et al. Seasonal variation and resorption characteristics of leaf N, P, and K in two aged Xantho-ceras sorbifolia plantations[J]. Chinese Journal of Ecology, 2010, 29(7): 1270-1276. (in Chinese with English abstract)
[20] 宁秋蕊,李守中,姜良超,等. 植物叶片养分再吸收特征及其影响因子[J]. 应用与环境生物学报,2017,23(5):811-817.
Ning Quirui, Li Shouzhong, Jiang Liangchao, et al. Characteristics and factors influencing foliar nutrient resorption in plants[J]. Chin J Appl Environ Biol, 2017, 23(5): 811-817. (in Chinese with English abstract)
[21] 刘洋,曾全超,安韶山,等. 黄土丘陵区草本植物叶片与枯落物生态化学计量学特征[J]. 应用生态学报,2017,28(6):1793-1800.
Liu Yang, Zeng Quanchao, An Shaoshan, et al. Ecological stoichiometry of leaf and litter of herbaceous plants in loess hilly and gully regions, China[J]. Chinese Journal of Applied Ecology, 2017, 28(6): 1793-1800.(in Chinese with English abstract)
[22] 李亚,魏怀东,陈芳,等. 甘肃河西地区典型沙生植物叶绿素和脯氨酸累积研究[J]. 西北林学院学报,2018,33(3):27-32.
Li Ya, Wei Huaidong, Chen Fang, et al. Proline and chlorophyll content in leaves of typical sand plants in the Hexi region of Gansu Province[J]. Journal of Northwest Forestry University, 2018, 33(3): 27-32. (in Chinese with English abstract)
[23] 黄艺,王东伟,蔡佳亮,等. 球囊霉素相关土壤蛋白根际环境功能研究进展[J]. 植物生态学报,2011,35(2):232-236.
Huang Yi, Wang Dongwei, Cai Jialiang, et al. Review of glomalin-related soil protein and its environmental function in the rhizosphere[J]. Chinese Journal of Plant Ecology, 2011, 35(2): 232-236. (in Chinese with English abstract)
[24] Son H J, Park G T, Cha M S, et al. Solubilization of insoluble inorganic phosphates by a novel salt- and pH- tolerant Pantoea agglomerans R-42 isolated from soybean rhizosphere[J]. Bioresource Technology, 2006, 97(2): 204-210.
[25] 孙艳梅,张前兵,苗晓茸,等. 解磷细菌和丛枝菌根真菌对紫花苜蓿生产性能及地下生物量的影响[J]. 中国农业科学,2019,52(13):2230-2242.
Sun Yanmei, Zhang Qianbing, Miao Xiaorong, et al. Effects of phosphorus-solubilizing bacteria and arbuscular mycorrhizal fungi on production performance and root biomass of Alfalfa[J]. Scientia Agricultura Sinica, 2019, 52(13): 2230-2242. (in Chinese with English abstract)
[26] 毕银丽,郭婧婷,刘榕榕. 解磷微生物对煤系废弃物粉煤灰的改良效应[J]. 环境工程学报,2008,2(9):1235-1238.
Bi Yinli, Guo Jingting, Liu Rongrong. Effects of phosphate-solubilizing bacteria on amendment of coal fly ash[J]. Chinese Journal of Environmental Engineering, 2008, 2(9): 1235-1238. (in Chinese with English abstract)
[27] 郭辉娟,贺学礼. 水分胁迫下AM真菌对沙打旺生长和抗旱性的影响[J]. 生态学报,2010,30(21):5933-5940.
Guo Huijuan, He Xueli. Effects of AM fungi on the growth and drought resistance of astragalus adsurgens Pall under water stress[J]. Acta Ecologica Sinica, 2010, 30(21): 5933-5940. (in Chinese with English abstract)
[28] 贺学礼,高露,赵丽莉. 水分胁迫下丛枝菌根AM真菌对民勤绢蒿生长与抗旱性的影响[J]. 生态学报,2011,31(4):1029-1037.
He Xueli, Gao Lu, Zhao Lili. Effects of AM fungi on the growth and drought resistance of Seriphidium minchiinense under water stress[J]. Acta Ecologica Sinica, 2011, 31(4): 1029-1037. (in Chinese with English abstract)
[29] Jǐrí Holátko, Martin Brtnický, Jǐrí Kǔcerík, et al. Glomalin- Truths, myths, and the future of this elusive soil glycoprotein[J]. Soil Biology and Biochemistry, 2021, 153: 108116.
[30] 杜慧平,刘利军,闫双堆. 微生物对矿山复垦地土壤基质的改良作用[J]. 山西农业科学,2011,39(1):43-46.
Du Huiping, Liu Lijun, Yan Shuangdui. Improvement action of microorganism on the reclamation soil in mining area[J]. Journal of Shanxi Agricultural Science, 2011, 39(1): 43-46. (in Chinese with English abstract)
Effects of combined inoculation microbes on soil dynamic improvement in coal mining subsidence areas
Bi Yinli1,2, Jiang Bin2, Qin Fangling3, Wang Zhuoyou1
(1. Institute of Mine Ecological Environment Restoration of West China, Xi’an University of Science and Technology, Xi’an 710054, China; 2. Institute of Mine Ecological Environment Restoration, China University of Mining and Technology (Beijing), Beijing 100083, China; 3. College of Chemistry and Chemical Engineering, Xi’an Shiyou University, Key Laboratory of Shaanxi Province for Environmental Pollution Control and Reservoir Protection Technologies in Oil and Gas Field, Xi’an 710065, China)
Deterioration of soil structure has posed a great threat to the farmland and vegetation in ecological and environmental development in large subsided lands, due mainly to excessive coal mining for rapid economic growth in China in recent years. This study aims to accurately and comprehensively evaluate the effects of microorganisms-plants-soil interactions on the soil restoration of damaged ecology caused by coal mining in arid and semi-arid areas. In-situ monitoring was performed on anL. inoculated by different microorganisms in the coal-mining subsidence area of Daliuta in Shandong Province of eastern China. A systematic evaluation was made on the dynamic ecological effects of inoculated microorganisms (such as mycorrhizal fungi, phosphate solubilizing bacteria or simultaneous inoculation of microorganisms) treatments on the plant growth (plant height and crown width), mycorrhizal effect (mycorrhizal infection rate and hypha density), soil nutrients and properties, the leaf nutrients, and plant resistance under different growth seasons after four years of reclamation in the mining area. A dynamic ecological mechanism of microorganisms was also elucidated in the process of vegetation reclamation in arid and semi-arid coal mine areas. Compared with no inoculation, the inoculation of,andsignificantly increased the plant height and crown width of, as well as the concentration of nitrogen, phosphorus and potassium ofleaves. The reabsorption of leaves and stress resistance ofwere also improved remarkably, due possibly to the reduction of relative electrical conductivity and the increase in the accumulation of proline and soluble sugar in the leaves. The soil pH and electrical conductivity were significantly reduced, with an obvious increase in the content of easy-to-extract Glomus (EE-GRSP), total-extract Glomus (T-GRSP), organic carbon, alkali hydrolyzable nitrogen, available phosphorus and available potassium of the rhizosphere soil. There was a significant synergistic effect of inoculation treatments on the growth of, mycorrhizal infection rate, soil nitrogen, phosphorus and potassium nutrients, EEG and TG content, with the extension of reclamation time. Furthermore, simultaneous inoculation ofand phosphate-dissolving bacteria played a positive role in the plant growth and mycorrhizal effect of, plant nutrients, and soil stress resistance in arid and semi-arid coal mining areas after 4 years of ecological reclamation. Mycorrhizal fungi were inoculated in the subsided land to maintain sustainable ecological effects. Nevertheless, there was a significant increase in the plant survival/growth rate with a sharp decrease in the nutrient of plant rhizosphere after reclamation about two years. Until four years reclamation, the mycorrhizal fungi with informed hyphal nets contributed to increasing population diversity and absorbing more nutrition from far away space. In natural or managed soil ecosystems, the shifts in the diversity and community structure of arbuscular mycorrhizal fungal (AMF) assemblages over space and time were associated with the plant community succession, anthropogenic activities, and changes in environmental conditions. Such interactions included the mutualistic associations between most vascular plants and their below-ground mycorrhizal symbionts. In any way, the interaction between plant, soil, and mycorrhizal fungi can provide a potential theoretical and practical reference to the restoration of ecological functions and processes in disturbed soil ecosystems, such as post-mining subsided areas.
soils; nutrients; mining subsidence; inoculants;L.; arbuscular mycorrhizal fungi
2020-11-26
2021-03-19
国家自然基金科学项目(51974326)
毕银丽,博士,教授,长江学者。研究方向为矿区生态修复。Email:ylbi88@126.com
10.11975/j.issn.1002-6819.2021.07.011
X171.4; S154.4
A
1002-6819(2021)-07-0085-09
毕银丽,江彬,秦芳玲,等. 干旱半干旱煤矿区联合接菌对土壤改良动态生态效应[J]. 农业工程学报,2021,37(7):85-93. doi:10.11975/j.issn.1002-6819.2021.07.011 http://www.tcsae.org
Bi Yinli, Jiang Bin, Qin Fangling, et al. Effects of combined inoculation microbes on soil dynamic improvement in coal mining subsidence areas[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(7): 85-93. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.07.011 http://www.tcsae.org
