虾肝肠胞虫(Enterocytozoon hepatopenaei)SWP2基因的克隆、表达及其在虾类病害检测中的应用
2021-06-30沈卫锋牛宝龙翁宏飚
沈卫锋,郭 琦,刘 莉,牛宝龙,翁宏飚,楼 宝
(浙江省农业科学院 水生生物研究所,浙江 杭州 310021)
微孢子虫(microsporidia)是一种单细胞的真核内寄生虫,广泛寄生于虾、甲壳类等动物。虾肝肠胞虫(Enterocytozoonhepatopenaei,EHP)是微孢子虫的一种,属于肠胞虫科、肠胞虫属,最早于2009年在泰国养殖的斑节对虾(Penaeusmonodon)中发现,随后在亚洲各国的凡纳滨对虾、脊尾白虾和中国对虾养殖区陆续有EHP检出[1]。研究表明,EHP的感染途径较广,可通过污染的养殖水体和病虾进行水平传播,也可以通过受精卵和虾苗进行垂直传播[2]。EHP感染的对虾初期没有明显症状,但随着病程的发展体色、胃、肠均表现出明显异常,体色发白、肠道吸收功能下降,严重的出现肝胰腺萎缩,个别虾体还会出现白便症状。由于该病在早期难以发现,往往要养殖30~45 d以上才会表现出生长缓慢,不长个的现象,因此,极易造成饲料空耗,给养殖户带来巨大的经济损失[3-4]。近几年,EHP在全世界范围内传播,中国、马来西亚、越南、印度尼西亚、泰国已经成为了重灾区,印度和墨西哥也有发现,极大地打击了虾农的养殖积极性。
常用的EHP检测方法包括:组织病理学观察、电子显微镜观察、PCR、原位杂交等[5-10],其中PCR方法因其高特异性、高灵敏度的优势而被广泛使用。目前,EHP的PCR检测方法已有一定数量报道,且主要集中在以一个核糖体小亚基作为PCR的目的基因[7,10]。经NCBI检索,我们发现该扩增的目标区域与其他微孢子虫的核糖体序列具有较高同源性,因此,用这些方法进行EHP检测容易造成非特异性扩增,从而增加假阳性率。
本研究通过电子克隆方法扩增到了EHP的一种孢壁蛋白基因(SWP2),该基因目前在NCBI数据库中还未登录,同时也检索不到与之匹配的其他物种核酸序列。因此,以该基因为扩增靶标所设计引物的特异性强,与病原EHP之间存在明确的对应关系,适合用来开展虾类EHP感染的定性检测。
1 材料与方法
1.1 供试虾
罗氏沼虾(Macrobrachiumrosenbergii)检测样本由浙江海盐红宝石水产有限公司提供。
1.2 试剂和仪器
基因组提取试剂盒TIANamp Genomic DNA Kit购于北京TIANGEN公司;PfuDNA聚合酶购于北京全式金生物技术有限公司;PCR反应试剂购于上海翊圣生物科技有限公司;DNA胶回收试剂盒、质粒提取试剂盒购于生工生物工程(上海)股份有限公司;NdeⅠ和XhoⅠ限制性内切酶、pET15b载体、T4 DNA连接酶、Top10和BL21(DE3)感受态细胞由生工生物工程(上海)股份有限公司提供。引物由生工生物工程(上海)股份有限公司合成。
超声波细胞破碎仪,天津津立仪器设备科技发展有限公司;全温度振荡培养箱,常州锐品精密仪器有限公司;高速冷冻离心机,湖南湘仪离心机仪器有限公司;PCR仪,北京东胜创新生物科技有限公司。
1.3 试验样品的收集与DNA提取
取20只活虾,解剖获得每只虾的肝胰腺,保存于-70 ℃。取其中一小块肝胰腺组织均匀涂抹于洁净的载玻片上,用苏木精-伊红染色,在光学显微镜下观察每个样品中EHP的存在。通过显微镜观察确定感染EHP的样品,并取这些样品剩余的肝胰腺组织,每个样品10 mg,利用基因组DNA提取试剂盒提取DNA,提取方法参照试剂盒操作手册。
1.4 基因的克隆与测序
以蝗虫SWP2基因的蛋白序列(API85832.1)为模板,检索NCBI的蛋白数据库,检索到了一条来源于EHP且有228个氨基酸的同源蛋白(OQS53873.1),并根据该序列找到了EHP的全基因组数据;定位SWP2蛋白在EHP全基因组序列上的相应位置,整理获得SWP2基因cDNA序列,命名为EHP-SWP2。以EHP-SWP2为靶基因设计PCR引物SWP2-F与SWP2-R,以EHP阳性DNA为模板,进行PCR反应及产物克隆测序,验证通过电子克隆方法获得的SWP2基因cDNA序列的正确性。
1.5 序列与系统进化分析
利用BLAST在线工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列相似性分析;利用DNAMAN 6.0软件进行核苷酸和推定的氨基酸序列分析;利用ProtParam(http://www.pasy.org/tools/protparam.html)预测蛋白的相对分子质量及等电点;利用CLUSTAL Omega(http://www.ebi.ac.uk/Tools/msa/clustal)进行氨基酸的多序列比对; 利用 MEGA 7.0软件中的邻接法(neighbor-joining method)(bootstrap值为1 000次)构建系统进化树。
1.6 EHPSWP2蛋白的表达与纯化
1.6.1 重组质粒构建
构建 pET15b-EHPSWP2载体步骤如下:(1)将PCR产物和pET-15b载体进行双酶切。双酶切体系:NdeⅠ(10 U·μL-1)与XhoⅠ(10 U·μL-1)各1 mL,10×FD Buffer 5 μL,目的片段20 mL,ddH2O补足50 μL。(2)连接酶切产物: PCR双酶切产物与pET15b载体双酶切产物比例为 7∶1,T4 DNA连接酶(5 U·μL-1)1 μL,10×T4 DNA连接酶Buffer 2 μL,ddH2O补足20 μL。(3)检测阳性克隆:挑取克隆,经PCR与双酶切验证正确的质粒送至生工生物工程(上海)股份有限公司测序验证。
1.6.2 蛋白表达与纯化
将测序正确的 pET15b(+)-SWP2重组质粒转化感受态细胞,热激后涂布抗生素平板过夜;挑取单克隆到含有抗生素的液体培养基培养过夜,按1∶100的比例将菌液加至新的含有氨苄的LB液体培养基中,培养至D值0.6时,添加0.5 mmol·L-1IPTG,20 ℃条件下过夜培养进行大量表达。离心收集细胞菌体并破碎细胞,分别对上清和沉淀进行SDS-PAGE检测。取上清粗蛋白与平衡后的柱填料孵育1 h,上柱收集流出,用Binding buffer清洗平衡柱子;用Washing buffer清洗柱子,并收集流出,然后用Elution buffer洗脱,收集流出。对粗蛋白、洗杂流出、洗脱流出分别进行SDS-PAGE检测和Western blot验证。将纯度较好的3组分透析到缓冲液中,PEG20000浓缩,0.22 μm滤膜过滤后分装,-80 ℃保存。
1.7 单克隆抗体的筛选与制备
1.7.1 动物免疫与小鼠效价测定
表达纯化获得的SWP2蛋白采用常规免疫方法对BALB/c小鼠进行免疫。初免后每隔3周免疫一次,细胞融合前3 d将小鼠再冲击免疫一次。使用间接ELISA方法检测免疫小鼠血清的抗体效价,选取免疫效价检测值最高的小鼠追加免疫一次。
1.7.2 细胞融合与杂交瘤细胞株的筛选
取效价最高且加强免疫的小鼠脾细胞,与提前复苏备用的骨髓瘤细胞进行融合,加入用HAT的细胞培养液吹打成单细胞悬液,铺入96孔细胞培养板。细胞融合后第7天,通过ELISA间接法对所有细胞孔进行初次筛选,对初筛呈阳性的各细胞孔进行扩大培养和克隆化。经数次克隆化直至所有细胞孔检测阳性率为100%时,即可确定已获得分泌单克隆抗体的杂交瘤细胞株,将阳性杂交瘤细胞扩大培养并冻存。
1.7.3 单克隆抗体的制备与纯化
取6周龄健康雌性小鼠,腹腔注射(1~2)×106个阳性杂交瘤细胞,7~10 d后待小鼠腹腔明显膨大后收集腹水,离心取上清液,并倒入纯化柱。静置,待beads全部沉淀后收集腹水流穿。重复上述操作,10倍柱体积的1×PBS冲洗纯化柱,将洗脱液加入纯化柱并封闭下端,待beads全部沉淀后流出液体,用1.5 mL离心管收集洗脱液,分光光度计测定浓度并检测抗体效价。
1.8 SWP2基因在虾病检测中的应用
1.8.1 PCR方法
将EHP-SWP2作为靶基因设计PCR引物SWP2-F/R,扩增目标片段长度为568 bp,同时以EHP-18S作为靶基因设计引物18S-F/R,扩增目标片段长度为801 bp(表1)。以确定携带EHP罗氏沼虾DNA为模板,分别以SWP2-F/R和18S-F/R为引物对进行PCR扩增,反应体系:2×PCR Master Mix 10.0 μL,10 mmol·L-1引物各0.5 μL,模板DNA 2.0 μL,ddH2O 7.0 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,共40个循环;最后72 ℃延伸5 min,反应完毕后进行琼脂糖电泳分析。
1.8.2 Western blot方法
取约30 mg虾的肝胰腺组织,于冰上边加液氮边将组织研磨成粉末状,加蛋白裂解液RIPA、蛋白酶抑制剂和磷酸酶抑制剂,静置于冰上30 min充分裂解,离心取上清液,BCA 法检测蛋白质浓度。取30 μg蛋白上清液,以10%聚丙烯酰胺凝胶进行电泳分离和湿法转膜,再以5%脱脂牛奶室温封闭60 min,加入单抗(1∶5 000稀释)于4 ℃孵育过夜。用TBST洗膜,加入羊抗鼠二抗(1∶10 000稀释)室温孵育40 min,再用TBST洗膜。用ECL化学发光液显影和定影,检测SWP2蛋白的存在。其中0号为EHP阴性的罗氏沼虾样品,1~5号为EHP阳性的罗氏沼虾样品。
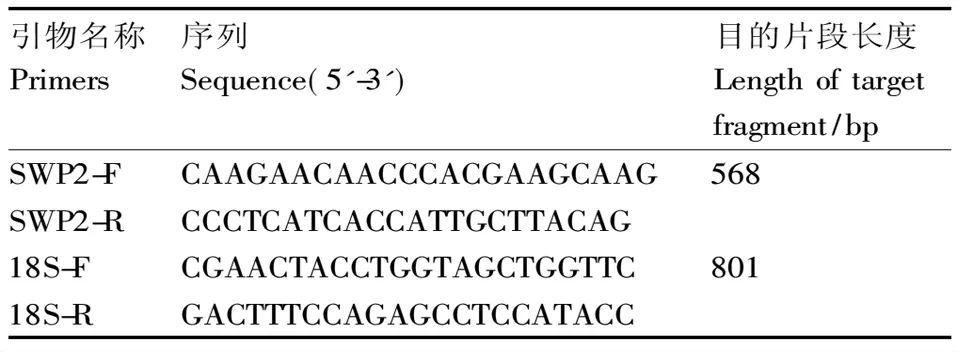
表1 引物序列
2 结果与分析
2.1 SWP2基因cDNA序列分析
SWP2基因的cDNA全长1 019 bp,包含一个名为MICSWaP的微孢子虫专属的保守结构域。开放阅读框(ORF)为687 bp,编码一个含有229个氨基酸残基的蛋白,5′非编码区(UTR)为120 bp,3′非编码区(UTR)为179 bp。Protparam在线软件预测ORF编码蛋白的相对分子质量为26.32 ku,等电点为5.21,是亲水酸性蛋白,无跨膜结构(图1)。以EHP阳性的罗氏沼虾DNA为模板,SWP2-F/R为引物,PCR扩增获得了长度为568 bp的片段,测序结果显示PCR产物序列与电子克隆获得的EHP-SWP2 cDNA序列完全一致。

图1 EHP-SWP2基因cDNA全长序列及其编码蛋白氨基酸序列Fig.1 Complete nucleotide sequences and deduced amino acid sequences of the EHP-SWP2 gene
将EHPSWP2蛋白与同源性较高的其他微孢子虫孢壁蛋白进行比较,并构建了系统进化树(图2)。其中,Enterocytozoonbieneusi是一种能引起人类腹泻的微孢子虫,Hepatosporaeriocheir是一种寄生于绒螯蟹的肝肠微孢子虫,Vittaformacorneae是一种能引起人类眼睛疾病的微孢子虫,Tubulinosemaratisbonensis是一种寄生于黑腹果蝇的微孢子虫。系统进化树显示Enterocytozoonbieneusi与Hepatosporaeriocheir处于同一分支,它们与EHP具有较近的亲缘关系,Tubulinosemaratisbonensis与EHP遗传距离最远,表明亲缘关系较远。
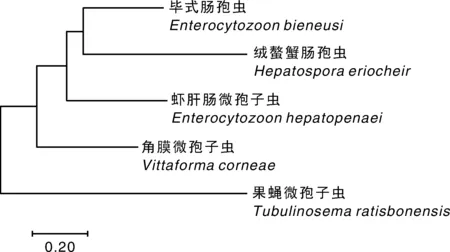
图2 邻接法构建的基于虾肝肠微孢子虫EHP-SWP2蛋白与其他微孢子虫孢壁蛋白氨基酸序列的系统进化树Fig.2 Phylogenetic tree of EHP-SWP2 protein and SWP protein from other microsporidia based on amino acid sequences with neighbor-joining method
2.2 SWP2蛋白的原核表达
表达载体构建过程中酶切电泳见图3-A、B,其中图3-A表示SWP2基因片段的PCR产物,图3-B表示重组载体的单酶切产物,两个片段大小与理论片段大小相一致,说明表达载体构建成功。利用镍琼脂糖亲和层析方法对SWP2蛋白进行分离纯化,并用SDS-PAGE 蛋白电泳验证蛋白相对分子质量大小(图3-D)。通过His-tag 标签抗体检测表达的重组蛋白,结果显示,重组His-SWP2 蛋白在28 ku处有一条明显条带,大小和重组蛋白预测一致(图3-C)。
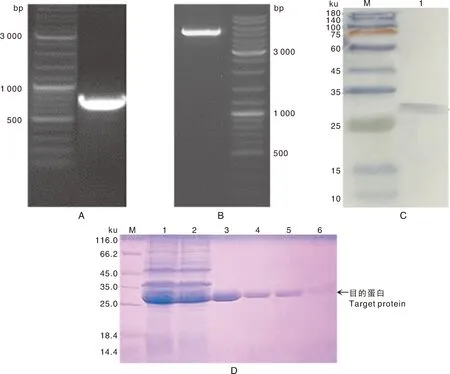
A,SWP2基因片段PCR产物;B,重组质粒酶切;C,重组蛋白的Western验证;D,SDS-PAGE 鉴定纯化的His-SWP2重组蛋白。A,PCR fragment of SWP2 gens; B,Recombinant plasmid digestion; C,Western verification of recombinant protein; D,Verification of His-SWP2 protein with SDS-PAGE.图3 EHP-SWP2基因克隆与重组表达Fig.3 Cloning and expression of EHP-SWP2 gene
2.3 单克隆抗体的获得
共获得3株能稳定分泌单克隆抗体的单克隆细胞株,分别命名为2D11H7、3G3D4、3H3C8,经纯化后的抗体的效价和浓度检测结果如表2,其中3H3C8菌株的效价最高,以此菌株制备高效的单克隆抗体为后续Western blot实验使用。

表2 不同细胞株分泌的单克隆抗体的效价和浓度检测结果
2.4 SWP2基因在罗氏沼虾EHP感染检测中的应用
从海盐红宝石水产有限公司提供的罗氏沼虾送检样品中随机抽取20个,解剖获得肝胰腺组织,用苏木精-伊红染色后在光学显微镜下观察,发现其中的5个样品有EHP感染。用这5个样品剩余的肝胰腺组织提取DNA,分别用SWP2-F/R和18S-F/R引物对进行PCR扩增,电泳结果显示:用SWP2-F/R引物对扩增后的1~5号样品均在550 bp左右位置出现明显条带,而用18S-F/R引物对扩增后仅1号和4号样品在800 bp左右位置出现明显条带(图4)。
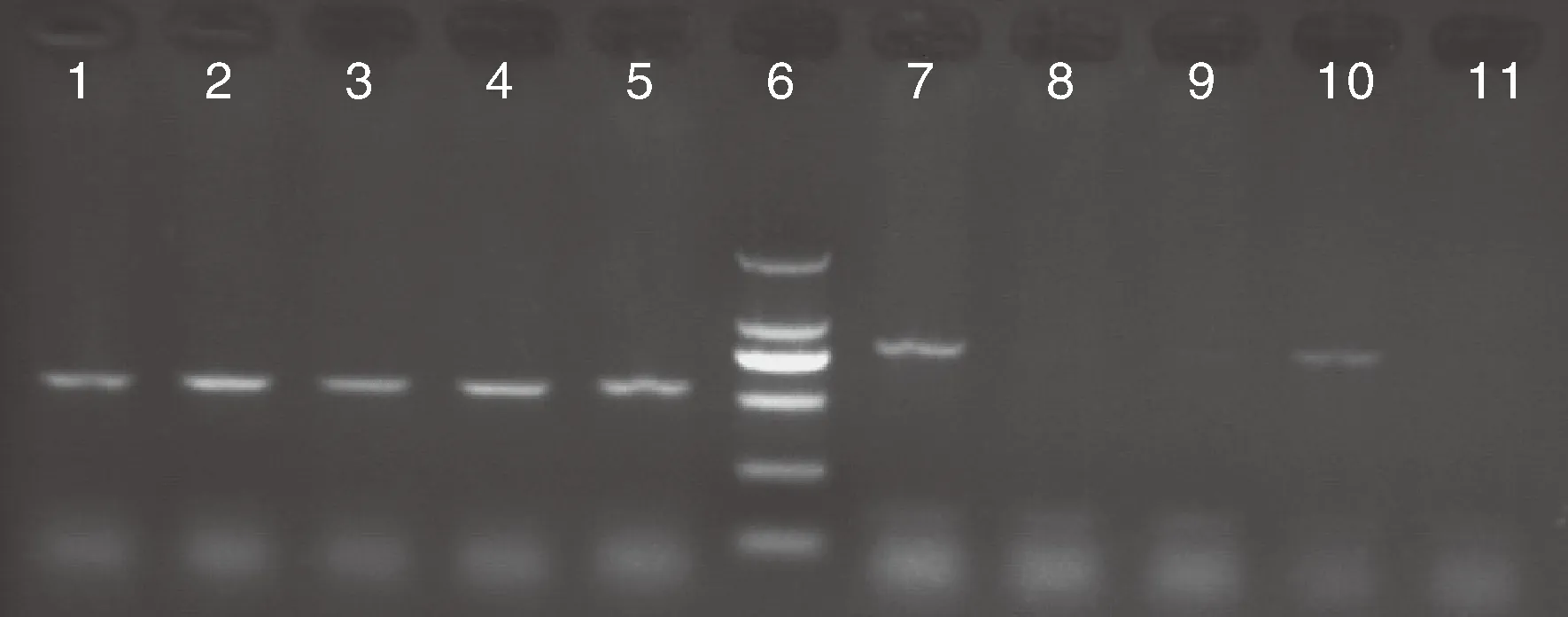
1~5号泳道,1-5号EHP阳性样品用SWP2-F/R引物的扩增结果;7~11号泳道,1-5号EHP阳性样品用18S-F/R引物的扩增结果;6号泳道为DL2000分子质量标记。Lane 1-5,PCR results to No. 1-5 positive samples with SWP2-F/R primer; Lane 7-11,PCR results to No. 1-5 positive samples with 18S-F/R primer; Lane 6,DNA marker (DL2000).图4 两种引物PCR检测效果比较Fig.4 Comparison of PCR detection with two kinds of primers
对上述5个虾的肝胰腺样品提取蛋白进行Western blot方法验证,蛋白杂交结果显示:1~5号样品均出现特异性条带(阴性对照样品无条带),说明1~5号样品均感染了EHP(图5)。
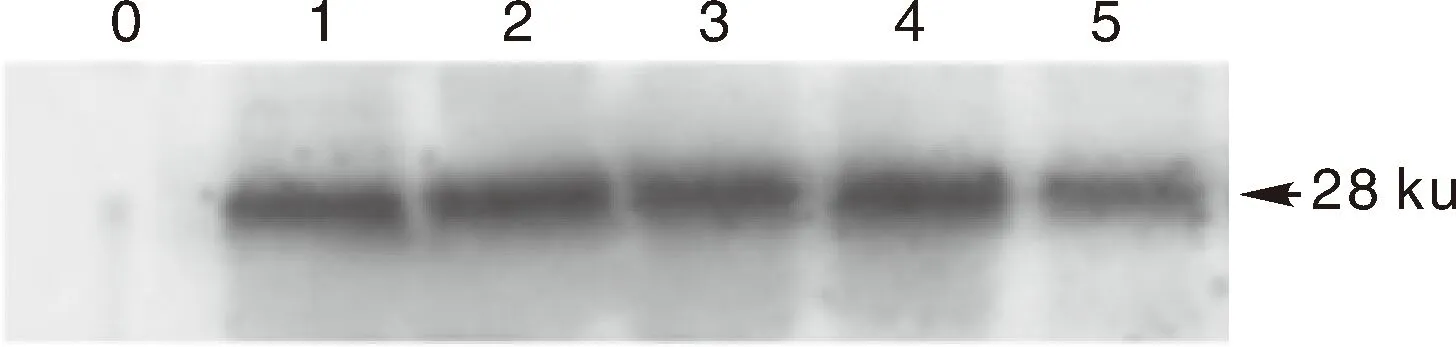
0号泳道,EHP阴性样品的杂交结果;1~5号泳道,1~5号EHP阳性样品的杂交结果。Lane 0,Negative sample with Western blot; Lane 1-5,Results to No. 1-5 positive samples with Western blot.图5 Western blot检测结果Fig.5 Results of Western blot analysis
3 讨论
孢壁蛋白是微孢子虫的一种结构蛋白,它在不同真核生物中的同源性很低,目前仅有少数孢壁蛋白被鉴定出来,如:来源于Encephalitozoonintestinalis的SWP1、SWP2、EnP1[11-12],来源于E.cuniculi的EcSWP1、SWP3、EcCDA、EnP1、EnP2[13-16],来源于家蚕微孢子虫(Nosemabombycis)的SWP7、SWP9、SWP26、SWP30、SWP32等[17-19],来源于蝗虫微孢子虫的AlocSWP1、AlocSWP2等[20-21]。研究表明,微孢子虫的孢壁蛋白在孢子形成、寄主细胞识别与侵染等过程中发挥重要作用。本研究通过生物信息学方法从公布的EHP全基因组序列中克隆到了一个孢壁蛋白SWP2,该蛋白编码229个氨基酸,预测分子量为26.32 ku,大肠埃希菌原核表达结果显示SWP2实际大小与预测一致。
除了肝胰腺组织外,肠道是EHP感染虾体的另一个重要组织,在养殖过程中,感染了EHP的虾往往会出现“光吃饲料不长个”的病症,这就是营养消化吸收障碍的典型症状。我们用EHP-SWP2蛋白序列在NCBI数据库中进行同源比对,发现SWP2蛋白与引起人类肠道顽固性腹泻的毕氏肠孢虫(E.bieneusi)的一个蛋白同源性高达52%,这或许从另一个侧面说明了EHP感染与虾类肠道疾病发生的相关性。
关于EHP的PCR检测方法已有不少报道,但主要是以核糖体18S为靶基因。有研究人员设计了V1F/964R、510F/510R等不同引物对来检测EHP的存在[6,22],但用这些引物扩增得到的片段序列经NCBI检索,发现与其他微孢子虫核糖体18S序列具有较高同源性,因此,这些片段很有可能来源于其他种属的微孢子虫,而并非是引起虾肝肠微孢子虫病的EHP。本研究以EHP-SWP2基因为靶标,设计了特异性引物SWP2-F/R,并应用在罗氏沼虾EHP感染的检测中,同时以18S-F/R引物作为对照。PCR结果显示:5个确定的阳性样品用SWP2-F/R引物均能得到正确条带,而用18S-F/R引物只有2个样品出现条带,说明SWP2-F/R引物的检测成功率明显优于18S-F/R引物。我们推测,由于核糖体18S基因在不同种属微孢子虫中具有较高保守性,一旦检测样品中除了EHP外存在其他种类微孢子虫,就容易造成引物在退火配对过程中与其他微孢子虫的18S基因形成非特异性结合,从而影响其与EHP-18S基因片段的结合能力。而SWP2-F/R引物针对SWP2基因,孢壁蛋白基因为了适应不同寄主的生理特点进化出了更高的特异性,因此,比核糖体18S基因更适合于微孢子虫种属的鉴定。本研究还通过蛋白原核表达、单克隆抗体制备、Western blot杂交等一系列实验,证明了SWP2蛋白与序列分析的预测结果一致,同时利用单克隆抗体进行蛋白杂交也可以作为虾类EHP病害的一种检测方法。
目前EHP的SWP1、SWP2基因已克隆,但是否还有其他孢壁蛋白基因的存在还需要挖掘。孢壁蛋白在寄主识别与侵染过程中起着关键作用,因此进一步研究该类蛋白的功能及与寄主的互作方式对于虾肝肠微孢子虫病的发生与防治具有重要指导意义。
参考文献(References):
[1] TOURTIP S,WONGTRIPOP S,STENTIFORD G D,et al.Enterocytozoonhepatopenaei sp. nov. (Microsporida: Enterocytozoonidae),a parasite of the black tiger shrimpPenaeusmonodon(Decapoda: Penaeidae): fine structure and phylogenetic relationships[J].JournalofInvertebratePathology,2009,102(1): 21-29.
[2] SALACHAN P V,JAROENLAK P,THITAMADEE S,et al. Laboratory cohabitation challenge model for shrimp hepatopancreatic microsporidiosis (HPM) caused byEnterocytozoonhepatopenaei(EHP)[J].BMCVeterinaryResearch,2017,13(1): 1-7.
[3] 杨明,丁福江. 罗氏沼虾产业健康发展措施初探[J]. 上海农业科技,2014(3): 62.
YANG M,DING F J. Study on the healthy development ofMacrobrachiumrosenbergiiindustry[J].ShanghaiAgriculturalScienceandTechnology,2014(3): 62. (in Chinese)
[4] 许杰,邓威,李军,等. 虾肝肠胞虫(EHP)流行病学与检测技术研究进展[J]. 中国动物检疫,2018,35(2): 64-68.
XU J,DENG W,LI J,et al. Research progress on epidemiology and detection technology ofEnterocytozoonhepatopenaei(EHP)[J].ChinaAnimalHealthInspection,2018,35(2): 64-68.(in Chinese with English abstract)
[5] WIREDU BOAKYE D,JAROENLAK P,PRACHUMWAT A,et al. Decay of the glycolytic pathway and adaptation to intranuclear parasitism within Enterocytozoonidae microsporidia[J].EnvironmentalMicrobiology,2017,19(5): 2077-2089.
[6] TANG K F J,PANTOJA C R,REDMAN R M,et al. Development ofinsituhybridization and PCR assays for the detection ofEnterocytozoonhepatopenaei(EHP),a microsporidian parasite infecting penaeid shrimp[J].JournalofInvertebratePathology,2015,130: 37-41.
[7] JAROENLAK P,SANGUANRUT P,WILLIAMS B A P,et al. A nested PCR assay to avoid false positive detection of the microsporidianEnterocytozoonhepatopenaei(EHP) in environmental samples in shrimp farms[J].PLoSOne,2016,11(11): e0166320.
[8] SANTHOSHKUMAR S,SIVAKUMAR S,VIMAL S,et al. Biochemical changes and tissue distribution ofEnterocytozoonhepatopenaei(EHP) in naturally and experimentally EHP-infected whiteleg shrimp,Litopenaeusvannamei(Boone,1931),in India[J].JournalofFishDiseases,2017,40(4): 529-539.
[9] 刘珍,张庆利,万晓媛,等. 虾肝肠胞虫(Enterocytozoonhepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测[J]. 渔业科学进展,2016,37(2): 119-126.
LIU Z,ZHANG Q L,WAN X Y,et al. Development of real-time PCR assay for detecting microsporidianEnterocytozoonhepatopenaeiand the application in shrimp samples with different growth rates[J].ProgressinFisherySciences,2016,37(2): 119-126.(in Chinese with English abstract)
[10] HAN J E,TANG K,PANTOJA C R,et al. Detection of a newMicrosporidiumPereziasp. in shrimpsPenaeusmonodonandP.indicusby histopathology,insituhybridization and PCR[J].DiseasesofAquaticOrganisms,2016,120(2): 165-171.
[11] HAYMAN J R,HAYES S F,AMON J,et al. Developmental expression of two spore wall proteins during maturation of the microsporidianEncephalitozoonintestinalis[J].InfectionandImmunity,2001,69(11): 7057-7066.
[12] SOUTHERN T R,JOLLY C E,LESTER M E,et al. EnP1,a microsporidian spore wall protein that enables spores to adhere to and infect host cellsinvitro[J].EukaryoticCell,2007,6(8): 1354-1362.
[13] BROSSON D,KUHN L,PRENSIER G,et al. The putative chitin deacetylase ofEncephalitozooncuniculi: a surface protein implicated in microsporidian spore-wall formation[J].FEMSMicrobiologyLetters,2005,247(1): 81-90.
[14] PEUVEL-FANGET I,POLONAIS V,BROSSON D,et al. EnP1 and EnP2,two proteins associated with theEncephalitozooncuniculiendospore,the chitin-rich inner layer of the microsporidian spore wall[J].InternationalJournalforParasitology,2006,36(3): 309-318.
[15] TAUPIN V,MÉTÉNIER G,DELBAC F,et al. Expression of two cell wall proteins during the intracellular development ofEncephalitozooncuniculi: an immunocytochemical andinsituhybridization study with ultrathin frozen sections[J].Parasitology,2006,132(Pt 6): 815-825.
[16] XU Y J,TAKVORIAN P,CALI A,et al. Identification of a new spore wall protein fromEncephalitozooncuniculi[J].InfectionandImmunity,2006,74(1): 239-247.
[17] YANG D L,PAN G Q,DANG X Q,et al. Interaction and assembly of two novel proteins in the spore wall of the microsporidian speciesNosemabombycisand their roles in adherence to and infection of host cells[J].InfectionandImmunity,2015,83(4): 1715-1731.
[18] LI Y H,WU Z L,PAN G Q,et al. Identification of a novel spore wall protein (SWP26) from microsporidiaNosemabombycis[J].InternationalJournalforParasitology,2009,39(4): 391-398.
[19] WU Z L,LI Y H,PAN G Q,et al. Proteomic analysis of spore wall proteins and identification of two spore wall proteins fromNosemabombycis(Microsporidia)[J].Proteomics,2008,8(12): 2447-2461.
[20] 冷赫. 蝗虫微孢子虫孢壁蛋白的鉴定及功能分析[D]. 哈尔滨:黑龙江大学,2012.
LENG H. Identification and functional analysis of spore wall protein fromAntonosporalocustaemicrospore [D]. Harbin: Heilongjiang University,2012.(in Chinese with English abstract)
[21] 陈中华. 蝗虫微孢子虫ALSWP2基因功能初探[D]. 哈尔滨:黑龙江大学,2014.
CHEN Z H. Functional analysis of ALSWP2 gene fromAntonosporalocustaemicrospore[D]. Harbin: Heilongjiang University,2014.(in Chinese with English abstract)
[22] DING Z F,SUN M L,LIU H Y,et al. A new microsporidium,PotasporaMacrobrachiumn.sp. infecting the musculature of pond-reared oriental river prawnMacrobrachiumnipponense(Decapoda: Palaemonidae)[J].JournalofInvertebratePathology,2016,136: 57-64.
