外源性硫化氢对蛛网膜下腔出血大鼠早期脑损伤的改善作用及相关机制
2021-06-30曾进田密成建蒙迪聂伟
曾进 田密 成建 蒙迪 聂伟
(湖南中医药高等专科学校附属第一医院神经内科,湖南 株洲 412000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是中风的一种亚型,具有极高的致死率和致残率[1]。早期脑损伤(Early brain injury,EBI)被证明是SAH患者高致死率的主要原因[2]。SAH后脑组织产生的氧化应激、脑水肿、血脑屏障通透性改变以及神经元的凋亡发生等均为EBI的重要成因[3]。硫化氢(H2S)作为继NO和CO之后公认的第三种气体信号分子,其具有广泛的生物学效应[4-6]。最近研究显示,外源性硫化氢能显著降低实验性SAH大鼠的脑损伤,且对癫痫大鼠的神经元具有一定程度的保护作用,但对其作用机制的研究尚不完备[7-8]。硫氧还蛋白系统包括硫氧还蛋白(thioredoxin,TRX)、硫氧还蛋白还原酶及NADPH等,是一个有效的蛋白还原系统,在机体氧化还原调节、抗氧化防御以及细胞增殖和生存过程中均发挥重要的作用[9-10]。虽然已有研究显示H2S能够通过激活TRX系统发挥对损伤机体的保护作用,但在SAH诱导的EBI研究中尚未见报道[11]。基于此,我们推测H2S可能通过激活TRX系统改善SAH诱导的EBI。故本研究构建大鼠SAH模型并采用外源性H2S进行干预,探讨H2S对EBI的改善作用及机制,加深对SAH诱导的EBI致病机理的认识,为临床治疗SAH提供参考。
1 材料与方法
1.1 材料 36只6-7周龄无特定病原体(SPF)级健康雄性SD大鼠,体重(260±20)g,购自南华大学实验动物学部,动物许可证编号:SCXK(湘)2015-0002。H2S供体NaHS购自Sigma公司;SOD及MDA测定试剂盒、全蛋白提取试剂盒、BCA法蛋白定量测定试剂盒、DAB显色试剂盒、原位末端转移酶标记技术(TUNEL)试剂盒均购自南京建成生物工程研究所;超敏ECL化学发光试剂盒购自上海碧云天生物技术研究所;兔抗人TRX1多克隆抗体、兔抗人TXNIP单克隆抗体、兔抗人Bcl-2多克隆抗体以及兔抗人cleaved-caspase3多克隆抗体均购自英国Abcam公司;兔抗人GAPDH单克隆抗体,购自美国CST公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自武汉博士德生物工程有限公司。光学显微镜购自日本Olympus公司;Tanon-4100全自动数码凝胶成像仪购自上海天能科技有限公司。
1.2 方法
1.2.1 动物分组及SAH模型制备 实验开始前,实验动物先在动物室适应性喂养1周,自由进食,环境湿度45%~60%,温度(23±2)℃。1周后,将36只大鼠随机分成3组,假手术组、模型组和H2S供体-NaHS治疗组,每组12只,且经统计学分析,组间大鼠体重比较无显著差异(P>0.05)。模型组及治疗组大鼠采用改良血管内穿刺法制作SAH模型[12]:腹腔注射2%的戊巴比妥钠(3 mL/kg)麻醉大鼠,后仰卧位将大鼠固定于手术台上,颈部皮肤剪毛暴皮,常规消毒处理;采用手术刀于颈正中切开皮肤,依次分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),并结扎ECA和ICA之间的吻合支。将ECA结扎并剪断,拉直,使其与ICA成一条直线,后将直径为0.126 mm头部锐化后的单股尼龙线由ECA置入ICA直至颅内,遇阻时再往前3 mm刺破血管,造成SAH;约15 s后拔出尼龙线,结扎ECA残端,恢复血流后缝合伤口。假手术组除不刺破血管外,其余步骤一致。造模2 h后治疗组大鼠按100 μmol/kg剂量腹腔内注射2 mL NaHS溶液,而模型组和假手术组大鼠均腹腔内注射等量生理盐水。
1.2.2 大鼠神经行为学评估及脑含水量检测 每组随机挑选6只大鼠,参照Garcia等[13]的神经行为学评估标准进行神经功能评估。总分18分,共包括6项:①触须反应。②肢体的本体感觉。③攀爬运动能力。④前爪的伸展性。⑤四肢运动的对称性。⑥自主运动能力。每项0-3分,得分越低说明神经功能损伤越严重。随后将神经功能评估后的各组大鼠断颈处死,取脑组织记录湿重A,后在100℃烤箱中烘烤24 h后取出记录干重B,脑含水量=(脑湿重A-脑干重B)/脑湿重A×100%。
1.2.3 HE染色观察脑组织海马区病理变化 造模24 h后,断头处死各组剩余大鼠并取脑组织,剥离海马区,并分成两等份。一部分保存于4%多聚甲醛固定48 h,另一部分-80℃冻存备用。取固定了48 h的海马组织标本,梯度乙醇脱水,二甲苯透明,石蜡包埋制作病理切片(厚度3~5 μm)。将石蜡切片依次再经脱蜡、苏木精染色、分化以及蓝化后伊红染色、洗涤脱水以及透明后封片。光镜下观察染色并采集图片。
1.2.4 海马组织内源性H2S及氧化应激指标SOD、MDA水平检测 取各组大鼠冻存的海马组织,用磷酸盐缓冲液(pH6.8)制备组织匀浆,采用BCA蛋白定量试剂盒进行蛋白定量,后根据各指标试剂盒说明依次进行操作,分光光度计下记录各组各指标的读数,最后根据各指标标准曲线分别计算出每组样本的各指标的实际浓度。其中内源性H2S含量以nmol·g-1(protein)表示,SOD含量以U·mg-1(protein)表示,MDA含量以mmol·g-1(protein)表示。
1.2.5 TUNEL染色检测海马区细胞凋亡 将各组海马组织石蜡切片依次进行TUNEL染色处理:烤片和脱蜡;水化;蛋白酶K工作液常温孵育15~30 min;滴加50 μL TUNEL反应混合液于样品上,在湿盒、暗室中37℃避光孵育60 min;用PBS冲洗3次;加入50 μL转化剂-POD于样品上,在湿盒中37℃避光孵育30 min;用PBS冲洗3次;加入100 μL DAB底物,于15~25℃孵育10 min;用PBS冲洗3次;苏木素复染、脱水、透明、封片,光镜下随机选择3个视野,观察凋亡细胞并计算凋亡率,其中阳性染色的细胞核呈棕褐色。
1.2.6 Western blot检测蛋白表达 取-80℃冻存的海马组织,分别进行蛋白提取,后进行浓度检测;取20 μg蛋白和4 μL 2×SDS上样缓冲液混合均匀,100℃变性10 min;上样,10% SDS-PAGE凝胶电泳分离后转至PVDF膜上;用5%脱脂牛奶封闭1 h;PBS洗膜;PBS洗膜后分别加入兔抗人一抗(TRX1,1∶1000;TXNIP,1∶1000;Bcl-2,1∶1000;cleaved-caspase3,1∶1000;GAPDH,1∶1500)在4℃下孵育过夜;PBS洗膜;加入HRP标记的羊抗兔二抗IgG(1∶5000)室温孵育0.5 h;PBS洗膜;用ECL化学发光进行显色。以GAPDH为内参蛋白,后采用Quantity One图像处理软件对各指标灰度值进行半定量分析。
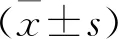
2 结果
2.1 外源性H2S治疗改善SAH大鼠神经功能及脑含水量 造模24 h后评估结果显示,假手术组、模型组和NaHS治疗组大鼠神经功能评分分别为(16.5±0.89)分、(7.83±1.24)分、(12.83±1.64)分,与假手术组比较,SAH模型组大鼠评分显著降低(P<0.05),而与SAH模型组比较,NaHS治疗组大鼠评分显著升高(P<0.05),见图1A。造模24 h后检测结果显示,假手术组、模型组和NaHS治疗组大鼠脑含水量分别为(55.36±4.58)%、(82.38±3.97)%、(65.47±3.34)%,与假手术组比较,SAH模型组大鼠脑含水量显著升高(P<0.05),而与SAH模型组比较,NaHS治疗组大鼠鼠脑含水量显著降低(P<0.05),见图1B。

图1 各组大鼠神经功能评分及脑含水量检测Figure 1 Neurological function score and brain water content of rats in each group 注:A.神经功能评分;B.脑含水量检测。1.假手术组;2.SAH模型组;3.NaHS治疗组。与假手术组比较,①P<0.05;与SAH模型组比较,②P<0.05
2.2 外源性H2S治疗改善SAH大鼠早期脑损伤 造模24 h后海马组织HE染色显示,假手术组大鼠脑海马组织锥体细胞形态结构完整,轮廓清晰可见,排列整齐,细胞数目多,核仁明显,胞质丰富;模型组大鼠脑海马组织锥体细胞排列杂乱,基质疏松,细胞脱失明显,部分细胞出现核固缩、溶解等现象;而NaHS治疗组大鼠海马组织病变得到缓解,仅少量锥体细胞变性、脱失或核固缩,锥体细胞排列较整齐,核仁较清晰,见图2。
图2 各组大鼠海马组织HE染色(400×)Figure 2 HE staining of hippocampal tissue of rats in each group 注:A.假手术组;B.SAH模型组;C.NaHS治疗组
2.3 外源性H2S治疗增加SAH大鼠海马组织内源性H2S水平、抑制氧化应激反应 分光光度计法测定结果显示,与假手术组比较,SAH模型组大鼠海马组织内源性H2S、SOD水平显著降低,而MDA水平显著升高(均P<0.05);而与SAH模型组比较,NaHS治疗组大鼠海马组织内源性H2S、SOD水平显著升高,而MDA水平显著降低(均P<0.05),见表1。

表1 各组大鼠海马组织内源性H2S,氧化应激指标SOD、MDA水平检测Table 1 The levels of endogenous H2S,SOD and MDA in hippocampus
2.4 外源性H2S治疗抑制SAH大鼠海马组织神经元凋亡 为进一步探究外源性H2S治疗对SAH早期脑损伤大鼠的修复作用,我们采用TUNEL染色鉴定和比较各组凋亡神经元。TUNEL染色结果显示,假手术组、模型组和NaHS治疗组大鼠海马组织神经元凋亡率分别为(11.35±1.26)%、(37.56±3.24)%、(22.91±2.64)%,与假手术组比较,SAH模型组大鼠海马组织神经元凋亡率显著升高(P<0.05);而与SAH模型组比较,NaHS治疗组大鼠海马组织神经元凋亡率显著降低(P<0.05),见图3。
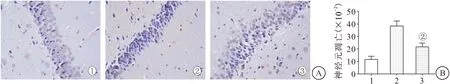
图3 TUNEL染色检测各组大鼠海马组织神经元凋亡Figure 3 The apoptosis of hippocampal neurons in each group of rats A.海马组织TUNEL染色(400×);B.海马组织神经元凋亡率比较。1.假手术组;2.SAH模型组;3.NaHS治疗组。与假手术组比较,①P<0.05;②与SAH模型组比较,P<0.05
2.5 硫氧还蛋白系统参与外源性H2S对SAH大鼠早期脑损伤的修复 Western blot检测结果显示,与假手术组比较,SAH模型组大鼠海马组织TRX1及Bcl-2蛋白表达水平显著降低(均P<0.05),TXNIP和cleaved-caspase3蛋白表达水平显著升高(均P<0.05);而与SAH模型组比较,NaHS治疗组大鼠海马组织TRX1及Bcl-2蛋白表达水平显著升高(均P<0.05),TXNIP和cleaved-caspase3蛋白表达水平显著降低(均P<0.05)见图4。

图4 Western blot检测各组大鼠海马组织TRX1、TXNIP、Bcl-2及cleaved-caspase3蛋白水平Figure 4 Trx1,TXNIP,BCL 2 and cleared caspase 3 protein levels in hippocampus of rats in each group注:A.Western blot检测各指标蛋白水平表达;B.各指标蛋白水平半定量分析。1.假手术组;2.SAH模型组;3.NaHS治疗组。与假手术组比较,①P<0.05;与SAH模型组比较,②P<0.05
3 讨论
早期脑损伤(EBI)指的是蛛网膜下腔出血(SAH)后72 h内所发生的整个脑组织的直接性损伤,涉及急性脑血管痉挛、神经血管炎症、脑血管功能障碍、血脑屏障损坏、脑积水及神经元凋亡等[14]。近些年,研究者对EBI的关注程度逐渐上升,其病理生理过程日益清晰,多种药物也被运用于临床治疗,但EBI患者的治疗效果仍不容乐观[15],这提示EBI的治疗还面临着巨大挑战。
硫化氢(H2S)作为一种新型的信号分子,在血管性、神经性、缺血再灌注等多种疾病中均发挥了重要的生理和病理作用[16]。本研究发现外源性H2S补给治疗能显著改善SAH大鼠EBI,主要体现在神经功能评分的提升、脑积水含量的降低、海马组织病理学损伤的修复、氧化应激反应的削弱及神经元凋亡率的降低这外源性H2S补给疗法在SAH治疗上是可行的。Cui等[7]在实验研究中发现,SAH发生能显著抑制脑组织及血浆H2S的产生,而补给外源性H2S进行治疗后,大鼠EBI症状(包括脑水肿、血脑屏障破坏、脑细胞凋亡、炎症反应以及脑血管痉挛)得到显著改善;且外源性H2S。氧化应激是一种病理状态,导致过度积累的氧自由基及相关代谢产物对细胞本身所产生的多种毒性作用[17]。外源性H2S对于氧化应激性疾病的治疗研究也十分广泛,如Pan等[18]发现外源性H2S对于高盐诱导的大鼠心肌氧化应激反应及心肌肥大均具有较好的抑制作用。Gao等[19]发现外源性H2S在叠氮化钠诱导的PC12细胞氧化应激中扮演着极好的神经性保护作用。而本研究同样发现外源性H2S同样能降低SAH大鼠海马组织的氧化应激进而发挥对EBI的保护作用。
硫氧还蛋白(TRX)系统对于维持细胞的还原性微环境意义重大。哺乳动物体内含有两套TRX系统细胞质TRX1系统及线粒体TRX2系统,硫氧还蛋白互作蛋白(TXNIP)则是细胞TRX的内源性抑制剂[20]。细胞质TRX1对机体内氧化性蛋白具有还原性,但当其与TXNIP结合时抗氧化能力便会大大降低造成细胞因累积氧化应激反应而更易发生凋亡现象。Li等[21]研究发现,通过siRNA靶向抑制TRX1的表达能进一步促进大鼠脑缺血再灌注后的氧化应激损伤,提示TRX1可能受核转录因子Nrf2调控,进而影响硫氧还蛋白过氧化物酶的还原活性。而Liang等[22]的研究发现,与假手术组比较,TXNIP在SAH大鼠损伤脑组织中的表达异常偏高;而通过白藜芦醇(TXNIP抑制剂)进行处理后显著降低了TXNIP及线粒体相关促凋亡因子的水平,并降低了SAH的预后指标,如脑积水、血脑屏障通透性及神经功能缺陷,这提示TXNIP可作为SAH的治疗靶点。而本研究结果显示外源性H2S能显著促进SAH大鼠海马组织TRX1,抑制TXNIP的表达,提示外源性H2S对SAH后EBI的保护作用与TRX系统密切相关。
线粒体依赖性凋亡途径在正常细胞遭受非生理性改变时会被激活细胞凋亡刺激促使凋亡蛋白Bax和抗凋亡蛋白Bcl-2发生平衡失调,同时破坏线粒体膜致使细胞色素C(Cyt C)从线粒体内释放到细胞质中,最终诱导下游的caspase3被激活[23]。本研究结果显示,与假手术组比较,SAH大鼠海马组织神经元凋亡率显著提升,Bcl-2表达下降而cleaved-caspase3表达上升;而外源性H2S补给治疗显著降低了神经元凋亡率,且上调了Bcl-2和下调了cleaved-caspase3的表达在脊髓缺血再灌注损伤的研究中,Xie等[24]发现氧化应激是自噬神经元细胞凋亡的主要诱因,且通过外源性H2S治疗能降低自噬神经元细胞的死亡,恢复损伤大鼠的神经和运动功能;这一效应被证明与AKT-mTOR通路的调控密切相关。在慢性肾病的相关研究中,Askari等[25]发现长期进行外源性H2S补给治疗能通过改善肾脏中氧化剂/抗氧化剂的平衡,减少炎症和细胞凋亡来预防慢性肾病。由此可见,在多种疾病损伤中,外源性H2S可通过调控凋亡信号通路发挥损伤作用。
4 结论与启示
外源性硫化氢可改善SAH大鼠早期脑损伤,这可能与激活硫氧还蛋白系统,进而降低氧化应激反应、抑制海马神经元凋亡有关。这一结果将为SAH的临床治疗提供新思路。
