生鲜面优势腐败菌的分离鉴定及致腐能力分析
2021-06-30温青玉张康逸王燕芳李耀强
温青玉,张康逸,*,王燕芳,李耀强,李 芳
(1.河南省农业科学院农副产品加工研究中心,河南 郑州 450002;2.河南省全谷物小麦制品加工国际联合实验室,河南 郑州 450002;3.河南省全谷物鲜食加工工程技术研究中心,河南 郑州 450002;4.河南省安康食品科技研究院,河南 郑州 450006;5.新乡市星河生物科技有限公司,河南 新乡 453600;6.白象食品股份有限公司,河南 郑州 451162)
面条作为我国人们的传统主食之一,有着悠久的历史,且制作便捷,含有丰富的维生素、碳水化合物、蛋白质和微量元素[1-2]。面条主要分为生鲜面、挂面和方便面等,其中生鲜面由于即做即食,口感筋道爽滑,颇受人们的喜爱,在我国占据很大的消费市场。随着我国食品工业的发展以及人们对食物越来越高的要求,对生鲜面的保水性、保存性和不宜腐败性等提出了更高的要求。但由于生鲜面本身含水量高,容易因微生物的滋生而腐败变质,从而造成原料的大量浪费[3-5]。因此,如何防止微生物对生鲜面品质的损坏是提高生鲜面品质和降低储藏成本的重要研究方向之一。
目前,国内外对生鲜面中的腐败菌有一定的研究报道。许玉慧等[6]在对即食湿面条腐败微生物的分离中得出,导致湿面条腐败变质的微生物为细菌,其主要为枯草芽孢杆菌、巨大芽孢杆菌和地衣芽孢杆菌。周其中[7]在生鲜湿面储藏技术的研究中发现,导致腐败的主要微生物为细菌和霉菌,另外也鉴定出了7个霉菌属。黄斌等[8]对生鲜面进行了危害分析和关键环节控制点的研究。刘增贵等[9]的研究表明,生鲜面条在30℃储藏条件下,微生物迅速增殖,面条颜色逐渐变黄,得出微生物是造成面条劣变的重要因素。但目前对即食湿面条中腐败微生物的相关研究报道相对较少,李昌文等[10]对即食湿面条的保鲜进行了研究,但未对腐败微生物进行分离鉴定,而李运通等[11]指出细菌是导致高水分面制品腐败的主要微生物,会产生复杂的生化反应,从而导致面条品质变质。
本研究通过形态学观察筛选生鲜面中的优势腐败菌,再利用生理生化手段和16SrDNA序列分析法对生鲜面中的优势腐败菌进行鉴定。同时,以感官评分、酸度、pH值和菌落总数为评价指标,综合评价优势腐败菌对不同储藏时间生鲜面的致腐能力,为生鲜面的工业化生产和商品流通等提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
小麦粉,金龙鱼高筋麦芯小麦粉;食用盐,河南省卫群多品种盐有限公司产品。
三氯甲烷、氯化钠、革兰氏染剂、氢氧化钠、丙酮、30%过氧化氢溶液、V-P试剂盒、硝酸盐、吲哚、营养琼脂培养基、平板计数琼脂培养基、孟加拉红培养基,均为北京奥博星生物技术有限公司产品;DNA提取试剂盒,西安擎科创新生物科技有限公司。
1.1.2 仪器与设备
YP-N型电子分析天平,上海精密仪器仪表有限公司;ST16R冷冻离心机,郑州金友宁仪器有限公司;YXQ-LS-75SII立式压力蒸汽灭菌器,上海博讯医疗生物仪器股份有限公司;SPX-250B-Z型生化培养箱、SW-CJ-1BU超净工作台,上海博讯医疗生物仪器股份有限公司;PHS-25型pH计,上海雷磁仪器厂;WD-9413B型凝胶成像分析系统,北京六一生物科技有限公司。
1.2 方法
1.2.1 生鲜面制作工艺
面粉、食盐、水(质量比100∶1∶39)→和面(慢速档搅拌5 min,中速档搅拌2 min)→熟化(室温静置15 min)→压延(在压辊间距为2、1.8、1.6和1.4 mm处各对折压片5次,形成厚度为1.4 mm的面片)→切条→脱水(120℃烘干1 min)→装袋
1.2.2 生鲜面的腐败处理
将无菌生鲜面在25℃条件下进行储藏,直至腐败变质。
1.2.3 微生物计数
菌落总数测定:参照GB 4789.2—2016《食品安全国家标准 食品微生物检验 菌落总数测定》[12]规定的方法检测;霉菌及酵母菌测定:参照GB4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》[13]规定的方法检测。
1.2.4 生鲜面腐败菌的分离纯化
在无菌操作环境下,称取已腐败生鲜面样品1 g,放入已灭过菌的研钵中,把生鲜面研碎,加入9 mL无菌水后再次进行充分研磨,随后取1 mL生鲜面的悬浊液进行10倍系列梯度稀释,选择4个合适的稀释度各吸取1 mL涂营养琼脂培养基平板,每个浓度下进行3次平行试验,同时做好空白对照。涂布完成后将平板放入37℃的生化培养箱中培养48 h±2 h。待培养基上的细菌长出,观察培养基表面的菌落生长状况,确定优势腐败菌,做好标记。将标记的菌落采用平板划线法进行分离纯化,纯化后的菌种低温保藏待用。
1.2.5 优势腐败菌的鉴定
1.2.5.1 生理生化鉴定
参考《常见细菌系统鉴定手册》[14]运用菌落观察等方法对试验中分离得到的菌株进行初步鉴定;通过硝酸盐还原、接触酶、氧化酶、葡萄糖、甘露醇、木糖发酵实验、V-P实验、明胶水解、淀粉水解、柠檬酸盐利用、丙酸盐利用、吲哚实验、耐盐性实验和耐热性等鉴定试验对分离的菌株进行生理生化鉴定。
1.2.5.2 分子生物学鉴定
选取在适宜条件下培养了24 h左右的腐败菌制成菌悬液,10 000 r/min离心10 min后弃去上清液,然后加入100μLddH2O制得模板DNA,进行PCR扩增反应,PCR扩增反应体系包括:模板DNA 2μL,引物27F 1μL,引物1541R 1μL,TaqPCR Master Mix(2×)25μL,ddH2O补至50μL。PCR反应条件:95℃预变性5 min,95℃变性60 s,58℃复性60 s,72℃延伸90 s,共30个循环;72℃延伸5 min;4℃保存。取5μL PCR扩增产物进行琼脂糖凝胶电泳,随后将扩增产物送至西安擎科生物技术有限公司进行测序鉴定,并登录NCBI网站,与数据库已知序列进行比对,获得相似性较高的菌株序列,使用MEGA5.0软件构建系统发育树。
1.2.6 生鲜面腐败菌的致腐能力测定
1.2.6.1 处理方法
生鲜面经包装密封后紫外杀菌,得到无菌生鲜面。首先,将分离出的几种供试优势菌分别接种于营养琼脂培养基中,然后放入生化培养箱中于37℃下培养48 h,在无菌操作下用接种环分别挑取一定量培养好的菌株加入225 mL的无菌水中,充分混均,得到供试菌株菌悬液。然后将无菌生鲜面置于供试菌株菌悬液中浸泡30 s后拿出,用无菌包装密封袋包装后即为接种处理过的生鲜面,同时以无菌水代替供试菌株菌悬液按上述方式处理生鲜面作为空白对照(CK)。最后,将所有处理过的生鲜面样品放入恒温箱中25℃密封保存。每隔6 h定时取样,对采集的样品进行感官评价,测定酸度、pH值和菌落总数,以评价几种不同的菌株对生鲜面的致腐能力。
1.2.6.2 生鲜面的感官评价
根据任顺成等[15]和张婉[16]的面条感官评分标准,由感官评价小组(5位经过专业培训的人员组成)对生鲜面的色泽、质地、气味、是否酸败等指标进行评价。感官评价采用10分制,当评分低于5分(包括5分)时,生鲜面若出现酸味或霉变,即不能食用。评价标准详见表1。

表1 生鲜面感官评价标准Table 1 Sensory evaluation standardsof fresh noodles
1.2.6.3 生鲜面酸度的测定
参照GB 5009.239—2016《食品安全国家标准食品酸度的测定》[17]规定的方法进行测定。
1.2.6.4 生鲜面pH值的测定
参照GB5009.237—2016《食品安全国家标准 食品pH值的测定》[18]规定的方法进行测定。
1.2.6.5 生鲜面菌落总数测定
参照“1.2.3微生物计数法”进行测定。
1.2.8 数据处理
数据采用3次平行试验的平均值±标准偏差表示。采用Origin 8.0软件绘制数据图。使用MEGA 5.0软件构建系统发育树。
2 结果与分析
2.1 生鲜面微生物计数
将腐败的面条分别接种在营养琼脂培养基和孟加拉红培养基上,经培养后,各培养基的生长情况如表2所示。

表2 培养基中微生物的生长情况Table 2 Growth states of microorganisms in media
由表2可知,在营养琼脂培养基上生长出较多的微生物,大大超过了NY/T 1512—2007《绿色食品 生面食、米粉制品》[19]中生面食菌落总数≤3×105CFU/g的要求。在主要用于培养霉菌和酵母菌的孟加拉红培养基上几乎没有微生物。由此可知,导致生鲜面腐败的优势腐败微生物主要是细菌。
2.2 生鲜面优势腐败菌的分离和筛选
2.2.1 腐败菌菌落特征及比例
图1为1、2和3号菌的菌落特征图,表3为各种腐败菌菌落的特征及比例。由表3可知,1号菌在培养基中的比例为39.25%,2号菌为30.45%,3号菌为21.34%,3株菌占所有腐败菌的91.04%,表明这3株菌为生鲜面中主要的优势腐败菌。

表3 各种腐败菌菌落特征及比例Table 3 Characteristics and proportionsof variousspoilage bacteria colonies

图1 3种腐败菌菌落特征图Fig.1 The colony characteristics of three dominant spoilagebacteria
标记1号菌为DX,2号菌为DY,3号菌为DZ,3株优势腐败菌的生理生化特征如表4所示,由表4结果与《常见细菌系统鉴定手册》[14]初步对比可知,DX为枯草芽孢杆菌,DY为地衣芽孢杆菌,DZ为蜡状芽孢杆菌。
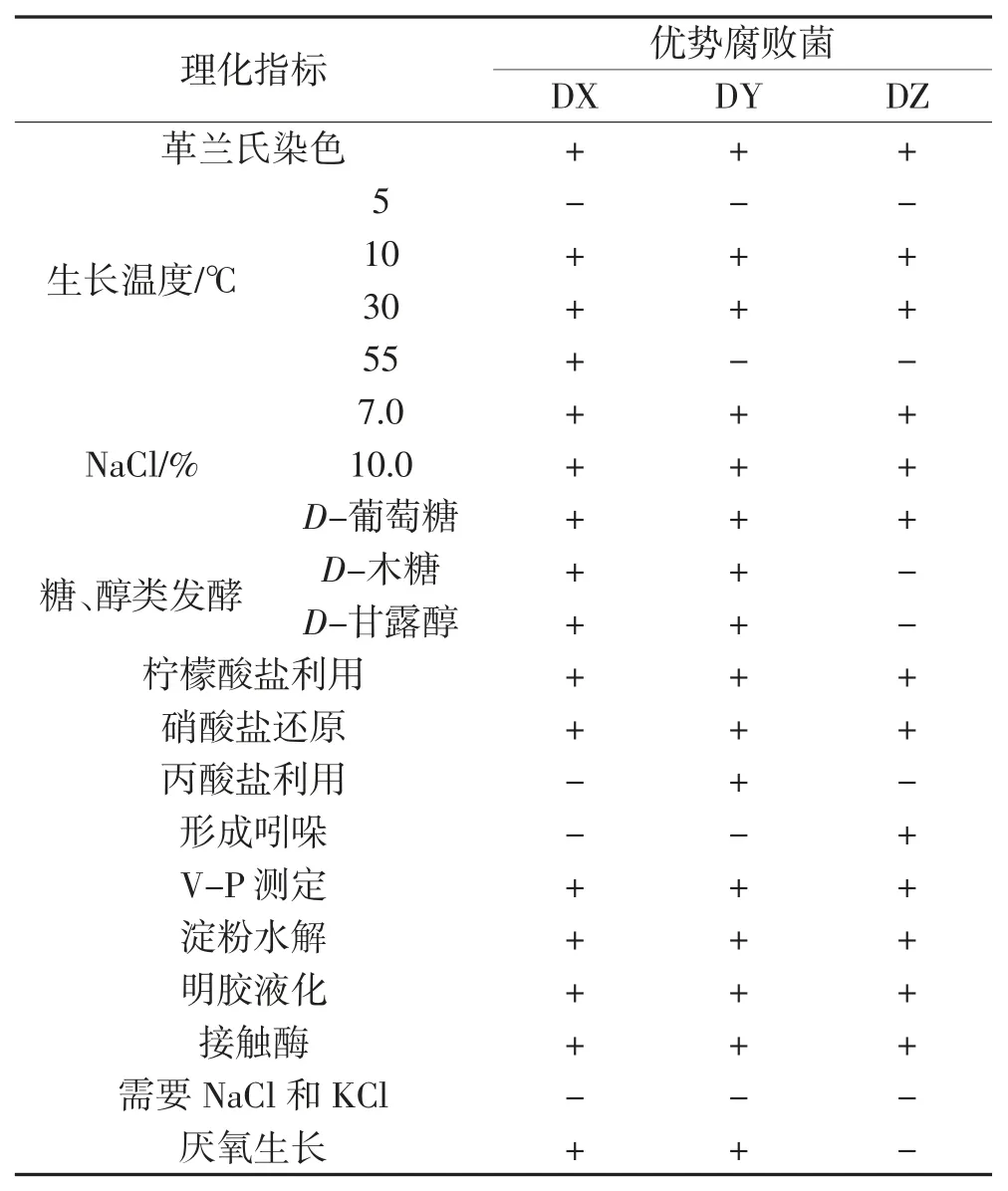
表4 3株优势腐败菌的生理生化特征Table 4 Physiological and biochemical characteristics of three dominant spoilage bacteria
2.2.2 16 SrDNA序列测定
将分离得到的3株优势菌DX、DY和DZ进行16SrDNA测序鉴定。以3株优势腐败菌株的DNA为模板,进行PCR扩增,并做凝胶电泳检测。
3株优势菌株16SrDNA的PCR扩增电泳图谱如图2所示。由图2可见,扩增产物在1 500 bp附近可见清晰明亮条带。
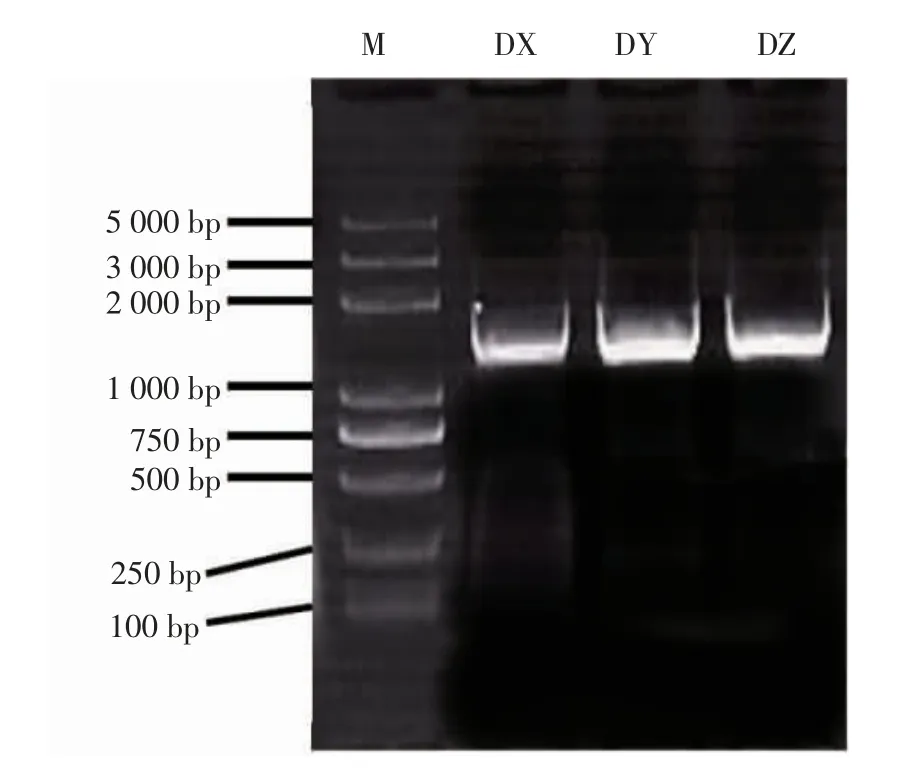
图2 3株优势菌株16SrDNA的PCR扩增电泳图谱Fig.2 16SrDNA PCRamplification electrophoresis pattern of three dominant strains
3株优势菌株的16SrDNA序列同源性系统发育树如图3所示。由图3可知,所有序列与已知序列的同源性均在97%以上,说明鉴定结果可靠。经分子鉴定后,3株菌株分别为:DX为枯草芽孢杆菌,DY为地衣芽孢杆菌,DZ为蜡状芽孢杆菌。
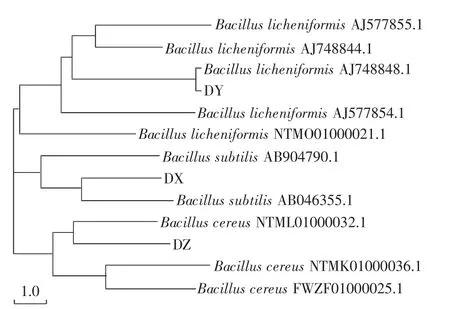
图3 3株优势菌株16SrDNA序列同源性系统发育树Fig.3 The phylogenetic tree of three dominant strainsbased on 16SrDNA sequence homology
2.3 优势致腐菌对生鲜面品质的影响
2.3.1 感官评分
感官评价法目前是食品品质评价的主要方法[20-21]。在25℃储藏条件下接种腐败菌的生鲜面感官评分的变化趋势如图4所示。由图4可知,在储藏期间,感官评分起始为9.10分,随着储藏时间的延长,评分总体都呈下降趋势,在储藏12 h后生鲜面外观明显变暗,质地发黏,伴随有腐烂变质的气味,在储藏30 h时感官评分达到最低,且不同微生物对生鲜面感官评价的影响程度不同。同时,随着储藏时间的延长,感官评价下降的程度越来越明显,其中接种DX的生鲜面的变质程度最大,在储藏30 h时感官评分达到最小值,即4.20分,其次是DZ和DY,其最小值分别为4.50分和5.10分,这与赵宏强等[22]研究的冷藏鲈鱼片中优势腐败菌的感官评分变化趋势基本一致。这主要是由于不同微生物的生长速度和致腐能力不同,进而造成生鲜面的腐败程度也不同。

图4 在25℃储藏条件下接种腐败菌的生鲜面感官评分的变化Fig.4 Thesensory scores changes of fresh noodles after inoculated with spoilage bacteria and stored at 25℃
2.3.2 酸度
酸度的变化是判断生鲜面腐败变质的重要因素。在25℃储藏条件下接种优势腐败菌的生鲜面酸度的变化趋势如图5所示。由图5可知,生鲜面酸度起始为0.80 mL/10 g,随着储藏时间的增加,所有处理生鲜面的酸度总体都逐渐上升,在储藏18 h后,酸度上升略微平缓,在储藏30 h时达到最大值。接种不同微生物的生鲜面的酸度之间差异较大。其中,接种DX的生鲜面在储藏30 h时酸度达到最大值,为4.46 mL/10 g,其次是接种DZ和DY的生鲜面,酸度分别达3.90 mL/10 g和3.70 mL/10 g。对照组的酸度整体低于接种优势菌株的样品组的酸度。Li等[23]研究表明,酸度与微生物的增长有显著的正相关关系,主要是由于在储藏过程中,微生物的生长代谢产物会造成生鲜面酸败。
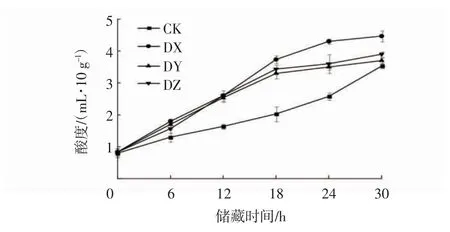
图5 在25℃储藏条件下接种腐败菌的生鲜面酸度的变化Fig.5 The acidity changes of fresh noodlesafter inoculated with spoilage bacteria and stored at 25℃
2.3.3 pH值
pH值的变化是判断生鲜面腐败变质的关键因素。25℃储藏条件下接种腐败菌的生鲜面pH值的变化趋势如图6所示。由图6可知,生鲜面pH值起始为6.72,随着储藏时间的增加,接种优势腐败菌DX、DY和DZ的生鲜面的pH值都逐渐降低,在储藏18 h后,pH值下降略微平缓,在储藏30 h时pH值达到最小值。刚制备出的生鲜面的pH值在6.50左右,此条件下非常适合微生物的生长[24]。随着储藏时间的延长,接种DX菌的生鲜面的pH值下降速率最快,在储藏30 h时达到最小值,即pH值为5.07。其次是接种DZ的生鲜面,最后是接种DY的生鲜面,30 h时其pH值分别为5.24和5.58。此外,未接种腐败菌的对照组的pH值都略高于其他3种,3株优势腐败菌之间对生鲜面pH值的影响呈显著性差异(P<0.05)。引起生鲜面pH值下降的主要原因是在储藏期间由于微生物的大量繁殖,使得生鲜面中的淀粉等碳水化合物被充分利用,产生了大量的有机酸等酸性产物,使得生鲜面的pH值不断下降[25]。
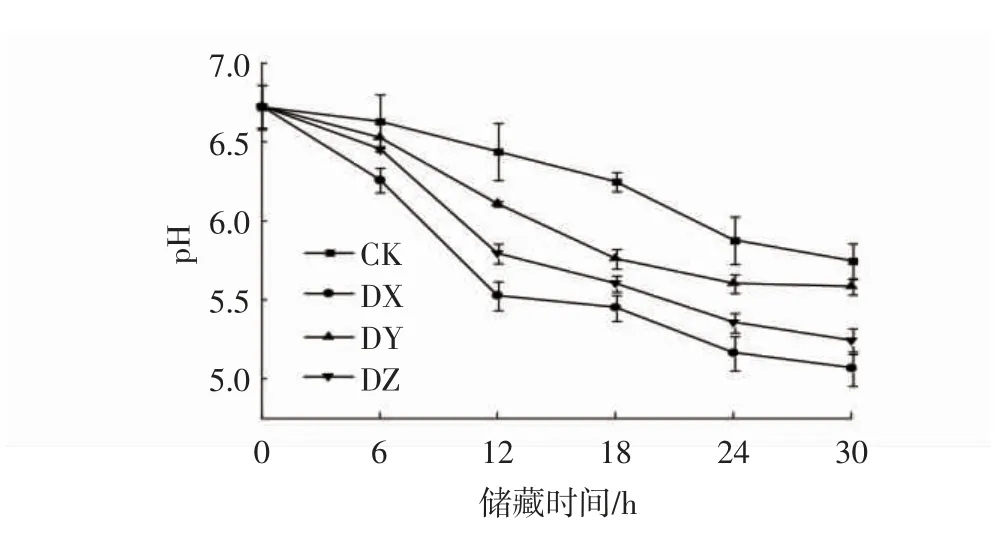
图6 在25℃储藏条件下接种腐败菌的生鲜面pH值的变化Fig.6 The pH values changes of fresh noodles after inoculated with spoilage bacteria and stored at 25℃
2.3.4 菌落总数
微生物的生长繁殖所产生的代谢产物是引起生鲜面腐败变质的主要原因之一。其最明显的特征就是生鲜面中菌落总数的变化,这是品质变化的指标之一[26-27]。在25℃储藏条件下接种腐败菌的生鲜面菌落总数的变化趋势如图7所示。由图7可知,生鲜面菌落总数起始为2.86 lg(CFU·g-1),随着储藏时间的增加,菌落总数总体均呈现上升的趋势,其中接种DX菌的菌落总数变化最大,在储藏30 h时达到最大值,即7.77 lg(CFU·g-1),高于其他3组,其次是DZ组,最后是DY组,菌落总数最大值分别为6.78lg(CFU·g-1)和6.62 lg(CFU·g-1),这与高磊等[28]研究的冷鲜鸡腿肉中优势腐败菌的菌落总数变化趋势基本一致。产生这种现象的主要原因可能是由于每种微生物的生长代谢速度和致腐机制不同,从而造成菌落总数不同,其结果与3种优势腐败菌在感官评分、酸度以及pH值方面对生鲜面品质影响的结果大致相同。不同菌株的生长情况会随着储藏时间的不同呈现差异,但储藏后期因为酸类、胺类等代谢产物的逐渐增多,又会反过来抑制微生物的生长[29]。
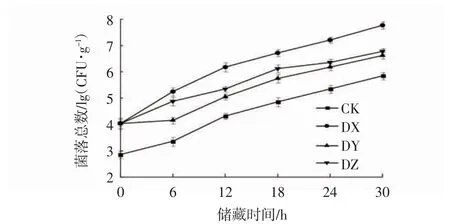
图7 在25℃储藏条件下接种腐败菌的生鲜面菌落总数的变化Fig.7 Thetotal coloniesnumberschanges of fresh noodlesafter inoculated with spoilage bacteria and stored at 25℃
3 结论
本试验通过形态学鉴定筛选出3株生鲜面中的优势腐败菌,再借助生理生化手段和16SrDNA序列分析法对3株优势腐败菌进行鉴定,鉴定结果表明3株优势腐败菌分别为枯草芽孢杆菌、地衣芽孢杆菌和蜡状芽孢杆菌。将鉴定出的3株优势腐败菌回接到生鲜面中,以不同储藏时间生鲜面的感官评分、酸度、pH值和菌落总数为指标,综合评价优势腐败菌对生鲜面致腐能力的大小。结果表明3株优势腐败菌的致腐能力为:枯草芽孢杆菌>蜡状芽孢杆菌>地衣芽孢杆菌。这为生鲜面的保鲜提供了依据。
