高效液相色谱法测定羧甲基壳聚糖/水杨酸处理的葡萄柚果实中水杨酸含量
2021-06-30李文清孔珊珊马电通朱绍志李贤忠
李文清,孔珊珊,马电通,朱绍志,李贤忠,邓 佳,2,*
(1.西南林业大学林学院,云南 昆明 650224;2.西南山地森林资源保育利用省部共建教育部重点实验室,云南 昆明 650224)
葡萄柚营养价值高,味酸甜略带苦味,主要用以鲜食、榨汁等,深受消费者喜爱,但葡萄柚鲜果采后易受青、绿霉病菌侵染而严重腐烂[1]。羧甲基壳聚糖(Carboxymethyl Chitosan,CMC)是壳聚糖(Chitosan,CTS)的一种衍生物,相比壳聚糖,羧甲基壳聚糖具有较好的水溶性、成膜性、吸湿保湿性等优良特性[2]。邓雨艳等[3]研究表明,壳聚糖可以诱导脐橙果实水杨酸的升高。水杨酸(Salicylic Acid,SA)是一种简单酚类化合物,是近年来研究较热的新型植物激素。大量研究表明,水杨酸作为一种内源信号分子参与植物体抗性反应,其含量水平与植物抗病性表现出一定的相关性,可以促使植物产生系统获得抗性[4]。张玉[5]研究发现,乙酰水杨酸(ASA)处理可以显著提高猕猴桃果实组织中水杨酸水平,并通过水杨酸的生理效应延缓果实的成熟衰老。也有研究表明,1.5%壳聚糖+1.5 mmol/L水杨酸处理在延缓黑莓果实衰老和保持果实品质方面非常有效[6]。高效液相色谱法(High Performance Liquid Chromatography,HPLC) 因具有重现性好、分辨率和灵敏度高、分析速度快等特点,目前被广泛用于食品[7]、药品[8-10]和植物组织[11-14]中水杨酸的检测。水杨酸属于酚酸类,且植物组织内源水杨酸水平很低,检测难度较大,因此,许多研究者探究了水杨酸在果实内的高效液相色谱检测方法,并对果实内源水杨酸提取方法和检测条件进行了改进和优化调整,简化了提取步骤,提高了方法回收率。
目前,有关柑橘类果实水杨酸的提取测定已有一些报道[15-16],但原有提取方法对葡萄柚果实水杨酸的分离及测定效果并不理想,故本文以葡萄柚果实为研究对象,对其果皮水杨酸提取的不同方法、检测条件进行比较、优化,以期获得较佳的葡萄柚果皮水杨酸的提取及高效液相色谱测定的方法,并测定分析羧甲基壳聚糖、水杨酸单独/复合处理葡萄柚果皮中游离态水杨酸和结合态水杨酸含量变化情况,以期为合理、安全地利用外源羧甲基壳聚糖、水杨酸诱导提高果实抗病性及安全生产提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
“里约红”葡萄柚,于2018年9月采自昆明商业化种植园,选取成熟度一致,无虫害、无机械损伤的果实,包装于纸箱,24 h之内运回西南林业大学教育部重点实验室。
水杨酸(标准品)、乙腈(色谱级)、甲醇(色谱级),均为美国Sigma公司产品;冰乙酸(0.1 mol/L,pH 5.5)、三氯乙酸、乙酸钠(0.2 mol/L,pH 5.5)、乙酸乙酯、环己烷等试剂均为分析纯。
1.1.2 仪器与设备
Aligent 1260色谱仪,Eclipse XDB-C18反相色谱柱(250 mm×4.6 mm,5μm),Agilent G1316A紫外检测器,均为安捷伦科技有限公司产品;AR224CN电子天平,奥豪斯仪器(上海)有限公司;SK5200HP型台式超声波清洗器,上海科导超声仪器有限公司;MIKRO 220R型台式高速冷冻离心机,广州市华粤行仪器有限公司;0.22μm微孔滤膜针式过滤器,江苏绿盟科学仪器有限公司。
1.2 方法
1.2.1 水杨酸色谱条件的筛选
1.2.1.1 流动相的筛选
根据前人摸索的HPLC条件[11,17-19],流动相为色谱级乙腈和乙酸25∶75(V/V),色谱级甲醇和乙酸50∶50、60∶40(V/V),色谱级甲醇和乙酸钠混合液,其比例分别为50∶50、60∶40、70∶30(V/V),控制流速为1 mL/min,进样量为10μL,分别用不同比例的流动相定容水杨酸标准品和提取物进行HPLC检测。
1.2.1.2 流速和进样量的筛选
将标准溶液稀释至适宜浓度样品,分别在流速为0.5、0.8、1.0 mL/min条件下观察色谱峰的分离度,从而确定测定水杨酸的适宜流速;进样量分别为5、10、20μL,确定测定水杨酸的适宜进样量。
1.2.1.3 精密度及线性关系试验
用天平精密称取50.00 mg水杨酸标准品,置于50mL量瓶中,用60%甲醇+40%乙酸钠溶液(0.2mol/L,pH 5.5)的混合液配制浓度为1.0 mg/mL水杨酸标准溶液,取标准溶液在最佳色谱条件下进行测定,连续重复进样6次,对照水杨酸的峰面积,记录其峰面积的数值,计算相对标准偏差。再将标准液稀释成0、3.91、7.81、15.63、31.25、125、500μg/mL的标准溶液,将不同浓度的标准溶液用HPLC测定,以水杨酸标准溶液的质量浓度为横坐标,峰面积为纵坐标,制作标准曲线。
1.2.2 提取方法的确定
试验比较了3种水杨酸提取方法。方法1:参考张玉等[20]的方法,进行三氯乙酸/乙醚萃取;方法2:参考邓文红等[11]、王倩倩[18]的提取方法,进行三氯乙酸/三氯甲烷萃取;方法3:参考鲍峰伟等[12]的提取方法,进行乙酸乙酯/环己烷萃取。3种方法提取的葡萄柚果皮游离态水杨酸和结合态水杨酸,采用相同色谱条件测定,并对其谱图进行对比分析。
1.2.3 材料处理
选择大小均一、成熟度一致、无机械损害的葡萄柚果实,随机分为4组,将其浸入2%(V/V)次氯酸钠中1 min进行表面消毒,之后用自来水冲洗,在室温下风干。羧甲基壳聚糖和水杨酸的浓度选取根据前人研究[21]及课题组前期的试验效果确定。
试验设置3个处理,CMC处理:1.5 g/L羧甲基壳聚糖溶液中浸泡3 min;SA处理:0.2 g/L水杨酸溶液中浸泡3 min;CMC+SA处理:先于0.2 g/L水杨酸溶液中浸泡3 min,再于1.5 g/L羧甲基壳聚糖溶液中浸泡3 min;以蒸馏水浸泡处理3 min的果实作为对照(CK)。浸泡结束后将样品于通风室温晾干,置于室温(20±2)℃、相对湿度85%~90%的环境下贮藏。每个处理20个果实,于处理后7、14、21、28 d取样进行水杨酸提取测定。
1.2.4 内源水杨酸提取及测定
样品前处理参照张玉等[20]的方法并改进。经外源水杨酸处理后的葡萄柚果实,测定内源SA时,先用75%乙醇擦拭果实表面,再用蒸馏水冲洗果实表面,晾干,确保果实表面干净无残留。取10.0 g果皮充分研磨后,转入50 mL离心管中,加4.0 mL 5%的三氯乙酸,加超纯水至20.0 mL后再加入30.0 mL乙醚,充分摇匀,浸提12 h,于10 000 r/min下离心5.0 min,取出上部乙醚相,水相再经乙醚重复提取2次,合并乙醚相,真空旋转蒸干后,加入1.0 mL流动相溶液将其溶解,置于Eppendorf管中保存,即为游离态水杨酸样品。已提取游离态水杨酸样品的剩余水相加等体积2 mmol/L的HCl,于80℃水浴中加热1.0 h,冷却后用乙醚提取3次,合并乙醚相,蒸干后加入1.0 mL流动相液溶解,置于Eppendorf管中保存,即为结合态水杨酸样品。样品经0.22μm微孔过滤器过滤后,采用试验筛选出的最佳HPLC条件进行检测。采用比较保留时间定性,外标工作曲线法定量。
1.2.5 数据处理
试验数据整理及制图均采用Excel 2019软件;数据的方差分析(ANOVA)采用SPSS 23.0软件,利用Duncan’s多重比较对数据的显著性差异进行分析,P<0.05表示差异显著。
2 结果与分析
2.1 最佳色谱条件的确定
对采用不同有机溶剂作为流动相的有机相下水杨酸标准品的色谱峰图比较分析可知,甲醇和乙酸钠作为有机相下水杨酸峰形没有太大的差异,乙腈和乙酸、甲醇和乙酸用作有机相时出现杂质峰,不宜用作定量分析,相比之下,甲醇和乙酸钠作为流动相所测定的水杨酸标准品的色谱峰图更加理想,所以选择甲醇和乙酸钠作为流动相。如图1所示,用甲醇和乙酸钠作为流动相,对比分析可知,甲醇与乙酸钠体积比60∶40时的保留时间更短,在1.588 min时出完整峰形,也无其他杂峰影响,确定甲醇和乙酸钠体积比60∶40流动相下水杨酸的保留时间最短,分离效果达到最佳。
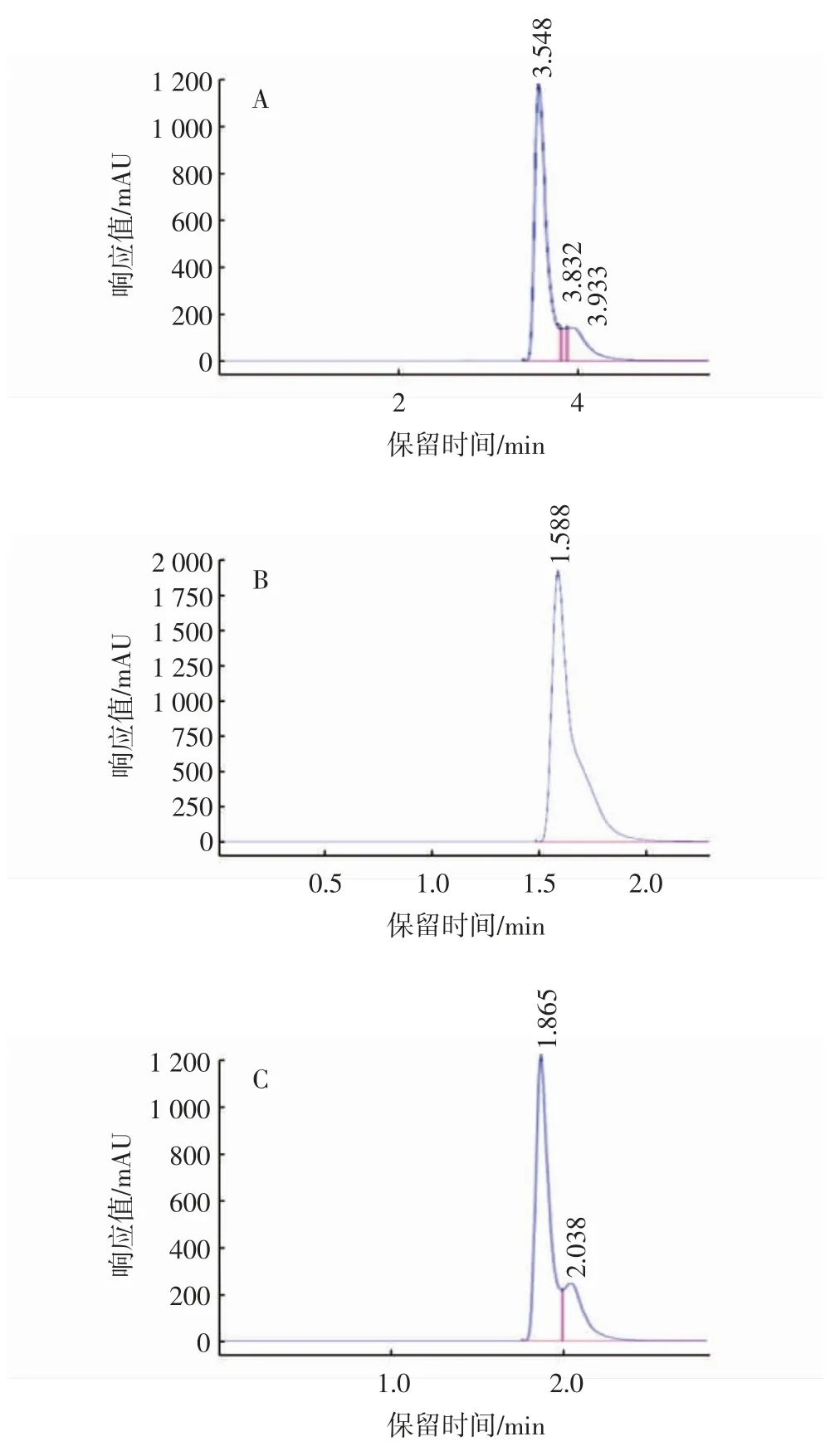
图1 不同流动相的标准水杨酸样品峰图Fig.1 The peak maps of standard SAusing different mobile phases
如表1所示,通过对比出峰时间、峰形的分离度可知,在0.5、0.8、1.0 mL/min的流速下,标准水杨酸样品都会出现杂峰。0.8和1.0 mL/min流速下,不同进样量下标准水杨酸峰型变化相似,进样量为20μL时,标准水杨酸出现杂峰。通过比较,流速为0.8 mL/min、进样量为5μL时,标准水杨酸和样品水杨酸的出峰时间一致,且此时峰的保留时间较其他条件更短,综合分析得出最佳色谱条件为:以甲醇∶乙酸钠(60∶40(V/V))为流动相,波长296nm,流速0.8mL/min,进样量5μL。
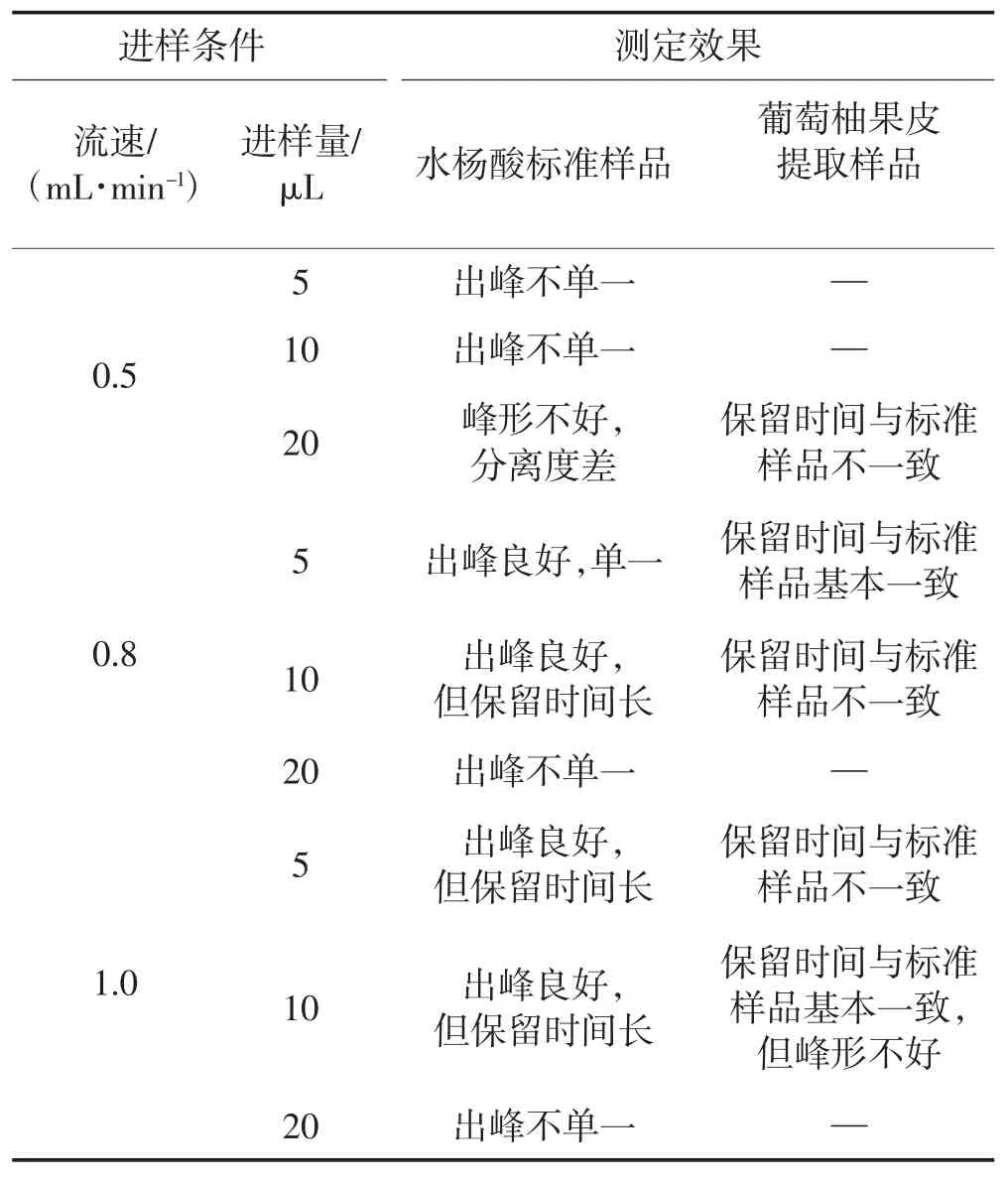
表1 不同进样量和流速下的水杨酸色谱效果Table 1 Determination effectsof SAunder different flowratesand injection volumes
2.2 精密度的确定及标准曲线的建立
通过计算得出同一水杨酸标准品的峰面积,结果见表2,得到水杨酸的相对标准偏差(RSD)为0.86%,表明仪器精密度良好,重现性好。按照选用方法在最佳测定条件下,测得水杨酸标准品的浓度x在3.91~500μg/mL范围之内与峰面积呈良好的线性关系(图2),回归方程为y=10.454x-19.166,R2=0.999 8。

表2 水杨酸标准品的峰面积Table 2 The peak areasof salicylic acid standard sample
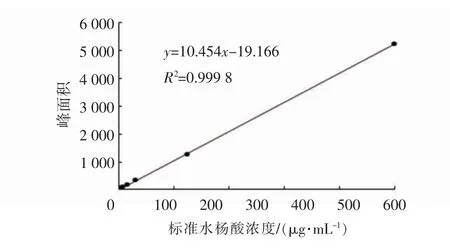
图2 水杨酸标准曲线Fig.2 The standard curve of SA standard sample
2.3 样品的分离及提取
应用HPLC检测水杨酸时,因为并存的各类物质相互干扰,分离效果差,提取方法便成为了关键。分别采用3种方法进行水杨酸提取,并对样品进行测定,样品图谱如图3所示。采用方法1取(三氯乙酸/乙醚)进行果皮水杨酸提,样品中水杨酸保留时间与标准品保留时间均为1.6 min,杂质少,目标峰分离良好(图3A);采用方法2(三氯乙酸/三氯甲烷)进行水杨酸提取,样品的杂质峰干扰较明显,目标峰与杂质峰未完全分离(图3B);采用方法3(乙酸乙酯/环己烷)进行水杨酸提取,在样品内测不到相应保留时间内的目标峰,杂质峰对目标峰影响较大(图3C)。对比分析3种提取方法下的水杨酸峰图,发现方法1提取效果较其他两种方法好,表明采用三氯乙酸/乙醚提取葡萄柚果皮水杨酸,并在最佳HPLC检测条件下葡萄柚水杨酸出峰效果较好。

图3 不同提取溶剂下葡萄柚果皮中的水杨酸峰图(三氯乙酸/乙醚(A)、三氯乙酸/三氯甲烷(B)、乙酸乙酯/环己烷(C))Fig.3 The peak mapsof SA in grapefruit peels under different extraction solventsincluding trichloroacetic acid/diethyl ether(A),trichloroacetic acid/trichloromethane(B)and ethyl acetate/cyclohexane(C)
2.4 羧甲基壳聚糖/水杨酸单独及复合处理下葡萄柚果皮中的水杨酸含量
如图4A所示,随贮藏时间的延长,对照组葡萄柚果皮内总水杨酸含量逐渐减少,羧甲基壳聚糖和水杨酸处理诱导果皮水杨酸含量增加,除贮藏7 d时SA处理与对照差异不显著外,其他处理总水杨酸含量均显著高于对照组(P<0.05)。贮藏期间,除第28天外,羧甲基壳聚糖+水杨酸复合处理效果优于羧甲基壳聚糖单独处理组。
由图4B可见,经不同处理后的葡萄柚果皮游离态水杨酸含量总体呈“下降—上升—下降”的变化趋势。贮藏过程中,羧甲基壳聚糖和水杨酸单独、复合处理组游离态水杨酸含量显著高于对照组(P<0.05)。贮藏第21天,羧甲基壳聚糖、水杨酸单独和复合处理的游离态水杨酸含量分别到达峰值45.55、44.1、47.6μg/g,分别高出对照组99.34%、93.00%和108.32%。贮藏后期(21~28 d),不同处理组间的游离态水杨酸含量差异不显著。
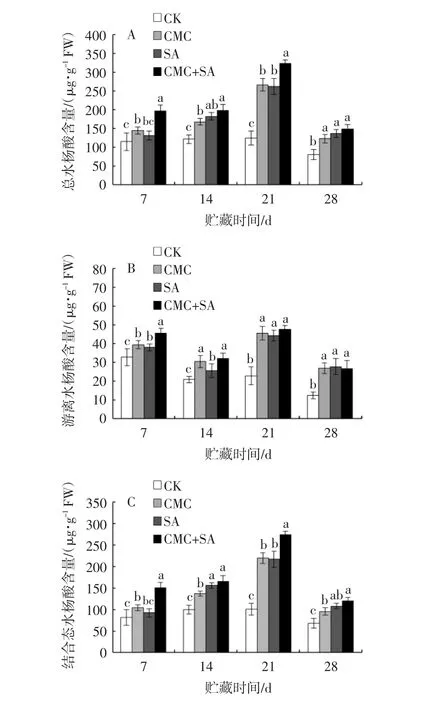
图4 羧甲基壳聚糖、水杨酸单独及复合处理下葡萄柚果皮总水杨酸(A)、游离态水杨酸(B)、结合态水杨酸(C)含量Fig.4 Thecontentsof total salicylic acid(A),freesalicylic acid(B)and conjugation salicylic acid(C)fromgrapefruit peelswith CMC/SA singleor combined treatments
如图4C所示,整个贮藏过程中,葡萄柚果皮结合态水杨酸含量呈先升高后降低的趋势,除贮藏7 d时SA处理与对照差异不显著外,羧甲基壳聚糖、水杨酸单独和复合处理组结合态水杨酸含量显著高于对照组(P<0.05)。
3 讨论
水杨酸作为近年来研究较热的一种新型植物激素,对植物生长发育起到重要的调节作用,内源水杨酸含量与介导的调控机制直接相关。由于水杨酸在植物体内的特殊作用,所以研究水杨酸的提取测定具有很重要的理论价值。但水杨酸在植物组织内含量甚微,检测难度大,检测方法直接决定其分离效果。常用的测定方法中,高效液相色谱法是一种比较简单、成本较低的方法,利用该法检测水杨酸是一个研究热点。
测定植物激素通常选择甲醇、乙腈等作为有机相,但乙腈成本明显高于甲醇,所以依据成本及分离效果标准,以甲醇为首选利于普及应用。本试验结果表明,用甲醇作为有机相进行分析效果较好。选择不同的流动相来进行分析,使用等度洗脱的方法进行色谱条件的摸索。乙酸属于弱酸,利于改善拖尾现象,本试验发现采用0.1 mol/L乙酸作为流动相时,杂质峰与目标峰未能很好分离,张玉琼等[13]探究了不同pH条件下的乙酸对样品分离度的影响,显示当pH<3.6时,易与样品中杂质峰重叠,这与本研究的结果相似。本试验还采用0.2 mol/L的乙酸钠溶液,分别设定甲醇添加量为50%、60%和70%,结果表明V甲醇∶V乙酸钠=60∶40时,水杨酸的分离效果最好,在1~2 min即可洗脱出来,在样品中未与杂质峰重叠,而且拖尾不严重。在此基础上,分别考察了流速为0.5、0.8、1.0 mL/min时的分离效果,并设置5、10、20μL的进样量,结果表明流速为0.8 mL/min时比0.5 mL/min和1.0 mL/min检测时间短,且目标峰形完整无其他杂峰影响,分离效果好。进样量为5μL较进样量为10μL和20μL的检测时间缩短,拖尾不严重。利用上述筛选的最佳检测条件对同一水杨酸标准溶液进行重复检测,结果表明此方法有较高的可重复性。对水杨酸标准溶液进行逐级稀释,得到水杨酸的回归方程、相关系数和线性范围,结果表明标准品浓度在3.91~500μg/mL范围与峰面积的相关性良好。
本试验参考了水杨酸提取的3种方法,对其提取条件进行对比,分别取三氯乙酸/乙醚、三氯乙酸/三氯甲烷、乙酸乙酯/环己烷作为萃取剂对葡萄柚果皮中的水杨酸进行提取,发现经三氯乙酸/乙醚提取的水杨酸分离度较高,且水杨酸的目标峰峰形良好,其他两种方法水杨酸杂质峰未能与目标峰很好分离。在已筛选的色谱条件下,对葡萄柚果皮进行检测,样品中的水杨酸几乎没有杂质峰,目标峰对称性良好,分析时间也较短。
水杨酸在植物体内通常以游离态和结合态两种形式存在,当游离态水杨酸含量达到阈值时,则会转换为结合态水杨酸[16]。王引[22]在对纽荷尔脐橙抵御溃疡病的研究中发现,结合态水杨酸是防御反应的主要形式,这期间可能存在某种转化机制促使新合成的水杨酸向结合态转变。不同植物组织中水杨酸含量不同,刘玉良等[23]测定了不同品种苜宿叶片总水杨酸最高含量为0.539 mg/g,邓文红等[11]测定了五角叶片中总水杨酸的含量为483.2μg/g,鲍峰伟等[12]测定了不同地区烟草中游离态的水杨酸最高含量为6.22μg/g,刘洪蛟等[17]测定了不同地区链荚豆中游离态水杨酸最高含量为57μg/g。王倩倩[18]测定了不同月份、不同树莓品种以及树莓植株不同发育部位的水杨酸含量,发现成熟期的果实中水杨酸含量较高,达1.39 mg/g。本试验对羧甲基壳聚糖、水杨酸单独及复合处理葡萄柚果皮的水杨酸进行提取,利用最佳色谱条件测定水杨酸含量,结果表明,葡萄柚果皮的游离态水杨酸含量范围是18~47.6μg/g,结合态水杨酸含量范围是68.05~273.85μg/g。与对照相比,羧甲基壳聚糖、水杨酸单独及复合处理的果皮中游离态水杨酸和结合态水杨酸均呈上升的趋势,羧甲基壳聚糖单独和羧甲基壳聚糖与水杨酸复合处理诱导提高游离态水杨酸含量的效果比水杨酸独处理更为明显。羧甲基壳聚糖能够在果实表面吸附形成一层薄膜,抑制果实水分散失,减少微生物的侵染[24]。研究表明SA可诱导植物产生系统获得性抗性,提高相关病程蛋白的表达,从而增强植物的广谱抗性[25]。羧甲基壳聚糖与水杨酸复合处理在果实表面形成完整而均匀的涂膜,可有效减少水分的挥发,有利于减缓葡萄柚果实的质量损失、抑制果实呼吸和减少微生物侵染,达到防腐的作用。综合来看,二者复合处理对葡萄柚果皮内源水杨酸的诱导效果优于二者单独处理。Shi等[26]采用10 g/L壳聚糖和2 nmol/L水杨酸处理葡萄柚果实后接种指状青霉(Penicillium digitatum)病原菌,测定果皮内源水杨酸含量,结果表明,壳聚糖/水杨酸复合处理显著诱导葡萄柚果皮内源水杨酸含量的升高,激活葡萄柚对绿霉病的抗性其效果优于单独处理。本试验与上述研究结果相似,表明本试验选择的处理原料羧甲基壳聚糖与壳聚糖都具有诱导果实水杨酸含量提高的作用,且羧甲基壳聚糖水溶性更好,便于生产操作,对羧甲基壳聚糖今后在采后果实保鲜应用具有指导意义。
4 结论
本试验结果表明,葡萄柚果皮水杨酸最适提取溶剂为:三氯乙酸/乙醚,该条件下水杨酸分离度较高;HPLC测定最佳色谱条件为:流动相为甲醇和乙酸钠(0.2 mol/L pH 5.5)(60∶40(V/V)),波长为296 nm,流速为0.8 mL/min,进样量为5μL。该测定条件下,检测精密度高,具有可重复性,RSD为0.86%,在3.91~500μg/mL范围内有良好的线性关系,R2=0.999 8。利用最佳色谱条件测定对照组葡萄柚果皮水杨酸含量,发现随贮藏时间的增长,其含量下降。经羧甲基壳聚糖与水杨酸单独、复合处理的葡萄柚果皮水杨酸含量均显著高于对照组含量,羧甲基壳聚糖与水杨酸复合处理能维持果皮水杨酸含量,其效果显著优于二者单独处理。
