尿激酶纤溶酶原激活物、可溶性程序性死亡配体1对肝癌切除术后患者临床预后的评估*
2021-06-30郭力硕秦曾增
郭力硕 秦曾增
中国人民武装警察部队重庆市总队医院消化外科 (重庆,400000)
肝癌是消化道最常见的恶性肿瘤之一,是恶性肿瘤的第二大死亡原因[1]。肝癌恶性程度较高,且病情进展快,患者早期症状不明显,出现临床症状时患者多处于晚期,如不及时诊断治疗,患者的平均生存时间约3个月[2,3]。近几年,随着医疗技术的发展,肝癌的诊断和治疗得到有效提高,但患者的预后仍不太乐观。尿激酶纤溶酶原激活物(uPA)是由癌细胞分泌的一种丝氨酸蛋白酶,具有水解蛋白和信号传导等功能,可促进肿瘤细胞发生、增殖等活动[4]。Iwata等[5]研究表明,uPA的高表达与膀胱癌的预后不良有关。程序性死亡配体1(sPD-L1)属于B7-CD28超家族,在肿瘤细胞上表达可使T细胞衰竭、活性抑制、凋亡和细胞因子生成受损,从而促进肿瘤的生长。sPD-L1可能是由基质金属蛋白酶裂解细胞膜表面PD-L1而成[6]。sPD-L1在肿瘤免疫、炎性介导等方面发挥着重要作用。刘灿等[7]认为,食管癌患者血清sPD-L1水平升高,sPD-L1升高与患者的死亡风险增加有关。本研究检测肝癌患者的血清uPA、sPD-L1水平,分析血清uPA、sPD-L1水平与肝癌患者临床预后的关系。
1 资料与方法
1.1 一般资料 选取2014年1月至2016年6月我科收治的肝癌患者122例(试验组),入组标准:①经病理学诊断为原发性肝癌者;②患者均为首次发病,术前未行介入、放化疗等其他治疗;③临床资料完整者;④签署知情同意书者;⑤经医院伦理委员会批准。排除标准:①继发性肝癌患者;②合并其他器官恶性肿瘤患者;③妊娠或哺乳期患者;④合并神经系统及自身免疫系统疾病者;⑤临床资料不完整者。试验组122例,男72例,女50例;年龄35~75岁,平均(56.41±8.66)岁;肿瘤直径<5 cm者67例,≥5 cm者55例;肿瘤组织分化程度:高分化33例,中分化41例,低分化48例;TNM分期:Ⅰ~Ⅱ期50例,Ⅲ~Ⅳ期72例;淋巴结转移:有53例,无69例。同时,另选取我院体检中心健康体检人员(对照组)80例,男50例,女30例;年龄35~70岁,平均(52.47±7.61)岁。两组受试者的年龄、性别相比,差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法 肝癌患者均在入院后空腹状态下抽取外周静脉血5 ml,对照组于体检当日采集空腹外周静脉血5 ml,收集血样,3 000 r/min 离心10 min,取上清液置于-80℃冰箱保存待测。采用酶联免疫吸附法检测两组受试者血清uPA、sPD-L1水平。血清uPA试剂盒购自上海晶抗生物工程有限公司,血清sPD-L1试剂盒购自上海鑫乐生物科技有限公司。所有操作过程均按照试剂盒说明书严格进行。
1.3 患者随访 采用门诊和电话方式对122例肝癌术后患者随访36个月,第1、2年每3个月随访1次,第3年每6个月随访1次。每次患者门诊复查时行腹部超声、CT等检查,观察并记录肝癌患者术后生存情况,随访截止时间为2019年8月。
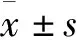
2 结果
2.1 试验组与对照组受试者血清uPA、sPD-L1表达水平比较 见表1。
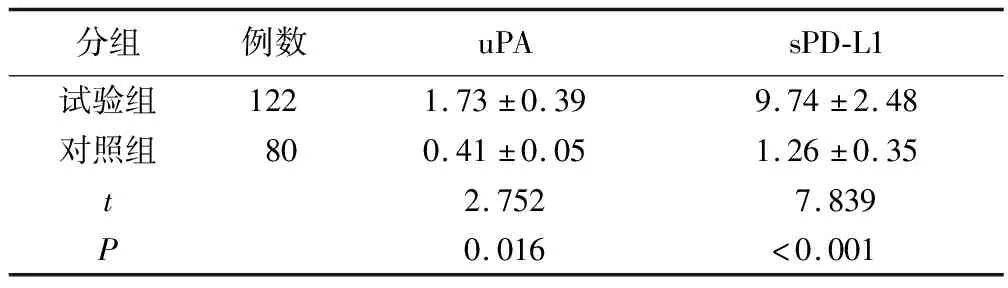
表1 两组受试者血清uPA、sPD-L1水平比较 (ng/ml)
2.2 肝癌患者临床病理特征与血清uPA、sPD-L1水平的关系 肝癌患者的血清uPA、sPD-L1水平与TNM分期、组织分化程度、淋巴结转移和门静脉癌栓有关,差异有统计学意义(P<0.05);肝癌患者的血清uPA、sPD-L1水平与肿瘤直径无关(P>0.05),见表2。
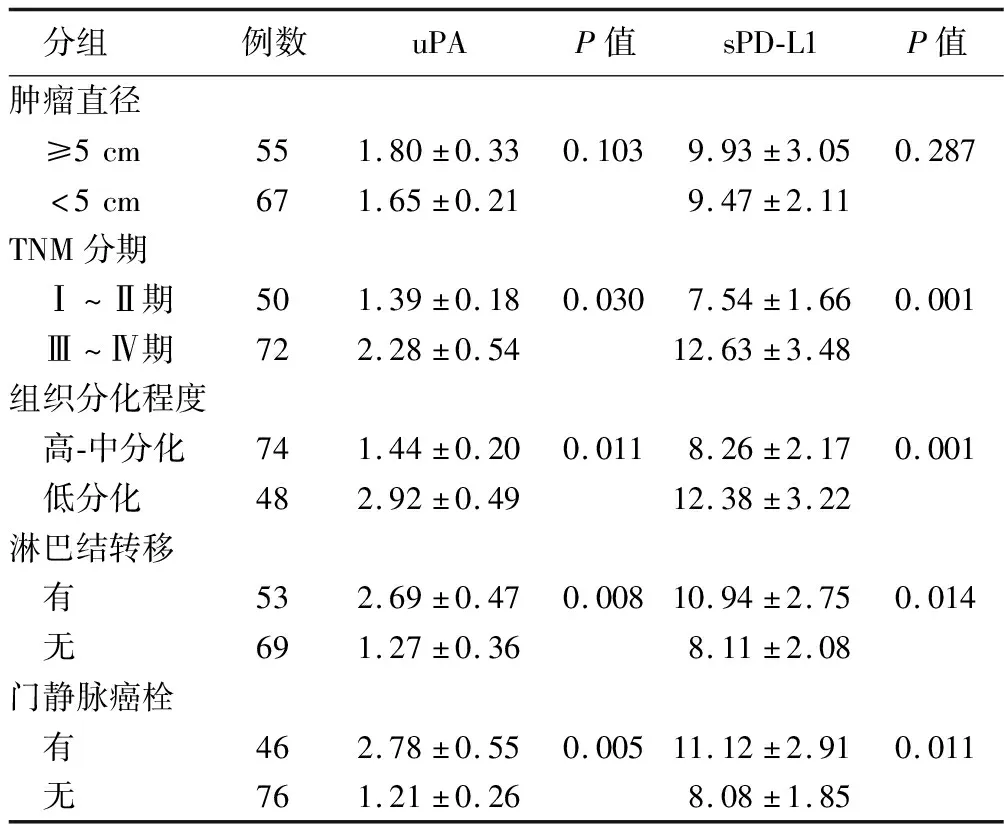
表2 肝癌患者临床病理特征与血清uPA、sPD-L1的关系 (ng/ml)
2.3 肝癌不同预后患者血清uPA、sPD-L1水平比较 122例肝癌术后患者随访36个月,其中死亡54例,存活68例。肝癌死亡患者血清uPA、sPD-L1水平高于存活患者,差异有统计学意义(P<0.05),见表3。
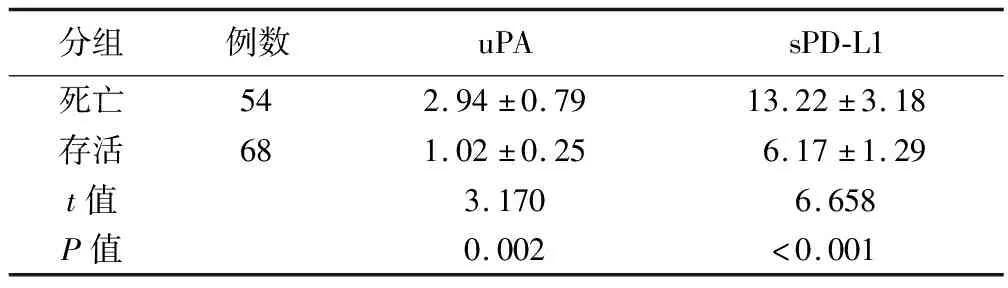
表3 肝癌患者不同预后血清uPA、sPD-L1比较 (ng/ml)
2.4 血清uPA、sPD-L1预测肝癌患者不良预后的ROC曲线分析 ROC曲线分析显示:血清uPA预测肝癌术后患者不良预后的曲线下面积为0.823(95%CI0.733~0.913,P<0.001),敏感度和特异度分别为81.0%和73.7%,最佳截断值为1.81;血清sPD-L1曲线下面积为0.892(95%CI0.825~0.958,P<0.001),敏感度和特异度分别为83.3%和78.9%,最佳截断值为10.53,见图1。
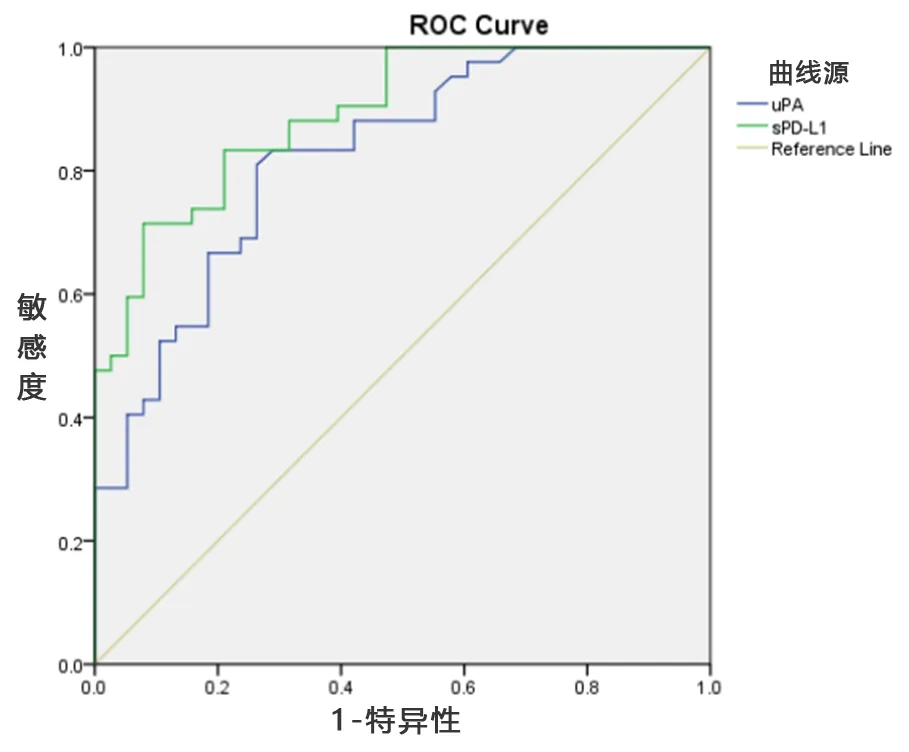
图1 血清uPA、sPD-L1预测肝癌患者不良预后的ROC曲线分析
2.5 肝癌患者血清uPA、sPD-L1表达水平与生存率的关系 根据血清uPA、sPD-L1最佳截断值,将肝癌患者分为血清uPA高表达组(uPA≥1.81 ng/ml)71例和血清uPA低表达组(uPA<1.81 ng/ml)51例、血清sPD-L1高表达组(sPD-L1≥10.53 ng/ml)74例和血清sPD-L1低表达组(sPD-L1<10.53 ng/ml)48例。Kaplan-Meier生存曲线分析示:uPA高表达组患者的生存率(40.85%)低于uPA低表达组患者的生存率(76.47%)(χ2=12.40,P=0.001);sPD-L1高表达组患者的生存率(43.24%)低于sPD-L1低表达组患者的生存率(75.00%)(χ2=6.756,P=0.009),见图2。
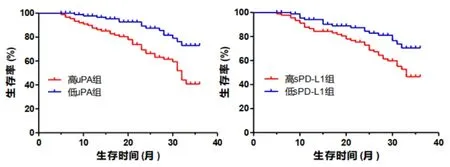
图2 肝癌患者血清uPA、sPD-L1表达水平与生存率的关系
3 讨论
原发性肝癌是我国常见恶性肿瘤之一,其早期发病隐匿,大部分患者确诊时,病情已发展到晚期,且肿瘤容易通过淋巴、血液系统转移,大部分患者的生存预后较差。近年来随着人们生活方式和饮食改变,肝癌的发病也呈逐年增加的趋势,严重影响人们的生命安全。目前,手术、放化疗等方式治疗肝癌取得一定进展,但肿瘤切除后仍易复发、转移,肝癌患者的生存率较差,我国肝癌患者5年生存率不到20%[8]。因此,寻找鉴定肝癌患者生存预后的血清标志物,对肝癌的临床治疗和决策具有重要意义。
uPA一种多功能的丝氨酸蛋白酶,uPA可以通过降解细胞外基质和基膜(如波形蛋白和纤连蛋白),参与上皮-间质转化来加速肿瘤转移并促进肿瘤血管生成[9]。同时,uPA也可通过激活蛋白酶纤溶酶来诱导肿瘤进展和转移。研究表明:uPA可与uPAR结合产生的纤溶酶具有传递信号作用,且能作用于多种信号通路,使肿瘤细胞出现趋化、迁移、增殖等生物效应行为,与肿瘤预后密切相关[10]。研究发现:乳腺癌组织中uPA表达升高,与乳腺癌的侵袭转移有关,是乳腺癌患者预后不良的检测指标之一[11]。Tsai等[12]报道,肝癌患者血清uPA水平明显升高,血清uPA是影响肝癌患者不良预后的独立危险因素。sPD-L1是通过基质金属蛋白酶对mPD-L1的蛋白水解切割而释放的,可参与机体T细胞的免疫功能调节,且与多种疾病的发生发展有关。sPD-L1是调控机体血管再生、细胞凋亡的生物蛋白标志物,其水平值的变化能够反映机体新生血管、细胞凋亡能力[13]。同时,sPD-L1在肿瘤微环境中的细胞表达对肿瘤控制和肿瘤发生起重要作用[14]。而sPD-L1水平升高也是肿瘤引起的系统性炎症的一种信号。Liu等[15]研究发现,神经胶质瘤患者血清sPD-L1水平升高与肿瘤侵略性生物学活性有关,sPD-L1是诊断神经胶质瘤的生物标志物。sPD-L1在预测恶性肿瘤患者的治疗反应和预后方面也起着至关重要的作用。Chang等[16]报道,sPD-L1是肝癌术后患者生存预后的独立危险因素,可预测肝癌患者生存期。
本研究结果显示,肝癌组患者血清uPA、sPD-L1水平高于对照组,与肝癌患者TNM分期、组织分化程度、淋巴结转移和门静脉癌栓有关。肝癌死亡患者血清uPA、sPD-L1水平高于存活患者,说明血清uPA、sPD-L1与肝癌患者的病情进展有关。El-Gebaly等[17]研究发现肝癌患者的血清sPD-L1水平高于对照组,与Child-Pugh评分和ALBI分级有关。Kaplan-Meier生存分析显示:肝癌患者uPA高表达患者的生存率低于uPA低表达患者的生存率,肝癌患者sPD-L1高表达患者的生存率低于sPD-L1低表达患者的生存率,差异有统计学意义,提示血清uPA、sPD-L1水平升高与肝癌患者的不良预后有关,与既往研究报道相一致[12,17]。ROC曲线结果显示血清uPA、sPD-L1预测肝癌患者不良预后的曲线下面积大于0.05,说明血清uPA、sPD-L1预测肝癌根治术患者不良预后具有可行性。
综上所述,肝癌患者血清uPA、sPD-L1水平升高,与患者TNM分期、组织分化程度、淋巴结转移和门静脉癌栓有关,血清uPA、sPD-L1水平越高,肝癌患者死亡风险越高,说明血清uPA、sPD-L1可作为肝癌患者临床预后的评估指标。
