我国四大麦区小麦籽粒镰刀菌毒素检测与污染分析
2021-06-29徐哲刘太国刘博高利陈万权
徐哲 刘太国 刘博 高利 陈万权
摘要 :为明确自然发病条件下我国小麦主产区小麦籽粒镰刀菌毒素污染情况,用超高效液相色谱串联质谱仪(UPLC-MS/MS)测定了长江中下游冬麦组(CZX)、黄淮冬麦区南片冬水组(HNS)、黄淮冬麦区北片水地组(HBS)、北部冬麦区水地组(BBS)180份小麦样品中DON、3ADON、15ADON、T-2、HT-2和ZEN共6种镰刀菌毒素含量并对其进行比较分析。结果显示:来自CZX小麦籽粒中的DON、3ADON与ZEN毒素含量显著高于其他麦区;T-2毒素在CZX小麦籽粒中含量显著低于其他麦区;15ADON毒素含量在HNS与CZX、HBS与BBS以及CZX与BBS差异不显著,其他麦区间该毒素含量差异显著,15ADON在HNS含量最高;检出率方面,HT-2毒素均未检出;ZEN、3ADON检出率较低,DON、15ADON和T-2毒素的检出率较高。
关键词 :超高效液相色谱串联质谱; 镰刀菌毒素; 小麦
中图分类号:
S 435.121.45
文献标识码: A
DOI: 10.16688/j.zwbh.2020045
Determination and contamination analysis of Fusarium mycotoxins in
wheat grains from four different wheat regions
XU Zhe1,2, LIU Taiguo1,2,3*, LIU Bo1, GAO Li1, CHEN Wanquan1,3*
(1. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. Key Laboratory of Biological Hazard Factors (Plant Source) Control of Agricultural Products Quality and Safety, Ministry of Agriculture and Rural Affairs, Beijing 100193, China; 3. National Agricultural Experimental Station for Plant Protection at Gangu, Gansu Province, Ministry of Agriculture and Rural Affairs, Tianshui 741200, China)
Abstract
To clarify the contamination level of Fusarium mycotoxins in major wheat-producing zones under natural infected condition in China, ultra performance liquid chromatography-tandem mass spectrometery was used to detect six kinds of mycotoxins including DON,3ADON,15ADON,T-2,HT-2 and ZEN in 180 wheat cultivars, which come from the winter wheat of the middle and lower reaches of Yangtze River (CZX), the irrigated winter wheat in south of Huang-Huai region (HNS), the irrigated winter wheat in north of Huang-Huai region (HBS), the irrigated winter wheat in north of China(BBS). The results showed the contamination of DON, 3ADON and ZEN toxins in CZX was significantly higher than that in other regions, and the contamination of T-2 toxin from CZX was lower than that in other regions. There was no significant difference in the contamination of 15ADON toxin between HNS and CZX, HBS and BBS, CZX and BBS, while there was significant difference between the other wheat regions. The contamination of 15ADON toxin was highest in HSN. HT-2 toxin was not detected. The detection rate of ZEN and 3ADON was relatively low, while that of DON, 15ADON and T-2 toxin was high.
Key words
UPLC-MS/MS; Fusarium mycotoxin; wheat
小麥赤霉病又叫麦穗枯、烂麦头等[1],是由亚洲镰刀菌Fusarium asiaticum和禾谷镰刀菌F.graminearum引起的一种典型的气候性病害,主要发生于我国长江中下游麦区和东北东部春麦区等温暖湿润地区[2],近年来在我国黄淮海麦区的发生也逐渐加重。赤霉病的发生频率与危害范围逐年增加,在赤霉病暴发年份,小麦产量损失严重,并且残留在小麦中的镰刀菌毒素对食品产生严重污染,危害人畜健康[3]。小麦赤霉病菌产生的脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、玉米赤霉烯酮(zearalenone,ZEN),T-2([3-hydroxy-4-15-diacetoxy-8ct-(3-methyl butyryloxy) 12,13-epoxytrichothec-9-ene])和HT-2(T-2的脱乙酰形式,是T-2的主要代谢产物)这4种镰刀菌毒素对小麦污染情况最为严重[4]。
脱氧雪腐镰刀菌烯醇又名呕吐毒素,人畜误食DON污染的食物会产生发烧、呕吐、反应迟钝等中毒症状[5],DON还具有很强的细胞毒性,破坏种子的细胞结构,对人类的细胞周期产生影响[6],诱发恶性肿瘤等疾病。联合国粮食和农业组织在报告中指出,欧盟对未加工的非硬质小麦、燕麦现行DON毒素限量标准为1 250 μg/kg,我国规定在小麦、玉米中DON的限量标准为1 000 μg/kg。3-乙酰脱氧雪腐镰刀菌烯醇(3-acetyl-deoxynivalenol,3ADON)和15-乙酰脱氧雪腐镰刀菌烯醇(15-acetyl-deoxynivalenol,15ADON)为DON的两种衍生物,我国规定这两种衍生物污染总量需低于1 mg/kg[7]。
玉米赤霉烯酮又名F-2毒素,具有很强的致癌性,并且会对动物体内雌性激素的分泌造成影响,进而引发雌性动物的生殖障碍,导致胚胎无法正常发育[8]。我国规定小麦、玉米中ZEN含量应低于60 μg/kg[7]。镰刀菌产生T-2毒素的能力由环境与病原菌种类决定,T-2毒素会引发人畜出现恶心、食欲不振、身体疲惫等症状,严重时会引起细胞癌变[9]。T-2毒素代谢后可产生HT-2毒素,毒性相对弱于T-2。目前,我国颁布了T-2毒素的检测标准,并未出台T-2和HT-2毒素在粮食中的限量标准[10]。
镰刀菌产生的毒素对公共健康带来危害,加大对镰刀菌毒素含量关注度与风险评估已经刻不容缓。王晓云等对我国6个小麦产区小麦的镰刀菌毒素含量检测结果发现DON污染率达到60%以上[11];Han等在来自上海的38份小麦样品中均检出DON、3ADON和15ADON 3种毒素[12];2010年-2012年Ji等对江苏省小麦中的毒素含量进行连续检测,DON检出率在50%~100%之间,毒素含量最高达到41 157.03 μg/kg,ZEN毒素含量也呈现逐年增加的趋势[13];贺玉梅等检测了北京市174份小麦样品中T-2毒素含量,检出率达到90.8%以上[14]。小麦籽粒中镰刀菌毒素含量日益增加成为我国农产品质量安全的重要问题。
加强镰刀菌毒素含量的评估离不开检测方法的支持,关于镰刀菌毒素的测定方法多种多样。生物学测定是通过检测生物材料(器官、组织、细胞)随毒素的变化而反映出的各项生理生化指标,该技术操作简单,适合毒素的初步筛选,但是专一性差,容易受到假阳性物质的干扰[9]。酶联免疫吸附法(ELISA)是免疫学检测的基本方法,具有特异性高、灵敏度强、成本低等优点[15],但是在检测过程中需要依赖抗原和抗体的特异性结合[16]。高效液相色谱法(HPLC)可以用来检测热稳定性较差、不易挥发的物质[17],此外,高效液相色谱与质谱仪联用,具有高效、快速、稳定等优点[18],提高了检测的灵敏度与准确性[19],还能够实现对多种毒素的同步检测[20],成为当今农产品中毒素检测的主流技术。
本研究运用超高效液相色谱串联四级杆质谱(ultra performance liquid chromatography-tandem mass spectrometery,UPLC-MS/MS)技术,在我国长江中下游麦区等赤霉病主要发病地区以及发病呈现加重趋势的黄淮海麦区,选取4个小麦主要种植区内共180份小麦样品进行镰刀菌毒素检测,以期通过准确可靠的镰刀菌毒素检测方法,明确4个小麦主要种植区镰刀菌毒素含量和分布情况,为我国小麦加工生产提供参考依据。
1 材料与方法
1.1 材料
供试小麦籽粒:180份小麦籽粒样品来自北京、天津、河北、河南、山东、山西、陕西、江苏、安徽、湖北、上海、浙江共12个省市的有关小麦育种单位,种子采收自育种圃,未施用过杀菌剂。样品按来源和参试组别分为长江中下游冬麦组(CZX)17份、黄淮冬麦区南片冬水组(HNS)121份、黄淮冬麦区北片水地组(HBS)32份、北部冬麦区水地组(BBS)10份。
试剂:乙腈(acetonitrile)、甲醇(carbinol)均为色谱纯,德国默克公司;DON、3ADON、15ADON、ZEN、T-2、HT-2等6种标准品,纯度均不低于99%,青岛普瑞邦公司。
仪器:超高效液相色谱串联四级杆质谱(UPLC-MS/MS),沃特世科技(上海)有限公司;研磨器,德国IKA集团;电子天平,梅特勒托利多仪器(上海)有限公司;Milli-Q超纯水机,美国Millipore公司;高通量組织研磨仪,美国SPEXGENO/Grinder公司;冷冻离心机,北京天林恒泰科技有限公司;恒温摇床,上海智城;Bond Elut Mycotoxin多功能净化柱,美国Agilent Technologies公司。
1.2 方法
1.2.1 液相色谱分析条件
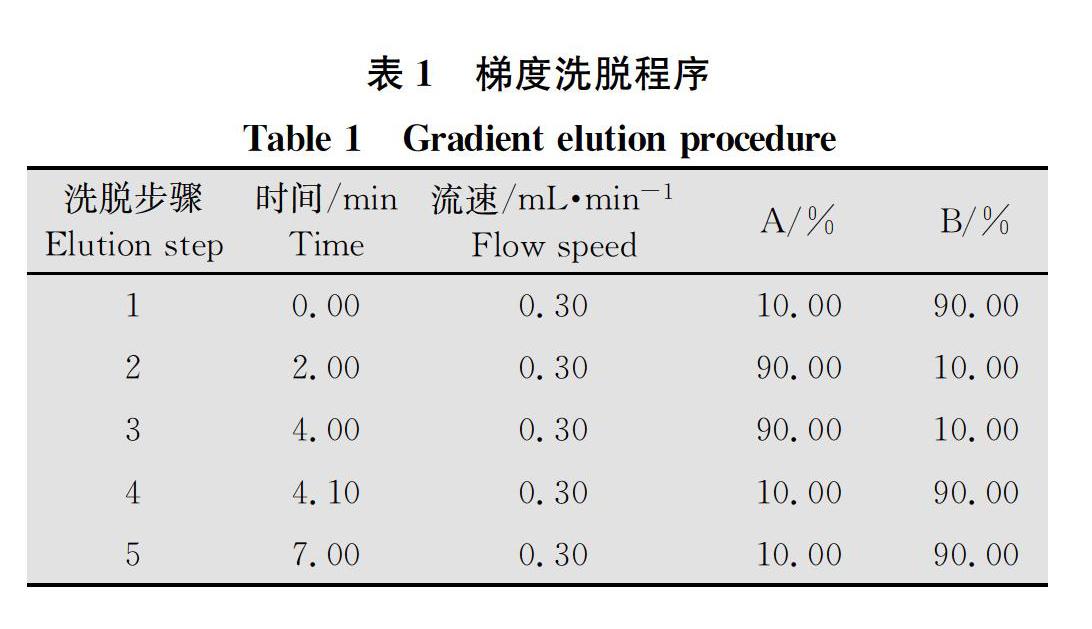
ACQUITY UPLCBEH C18(2.1 mm×100 mm,1.7 μm)色谱柱,沃特世科技(上海)有限公司;流动相:纯乙腈(A),4 mmol/L乙酸铵(B);进样量:2 μL;柱温:40℃。梯度洗脱程序见表1。
1.2.2 质谱分析条件
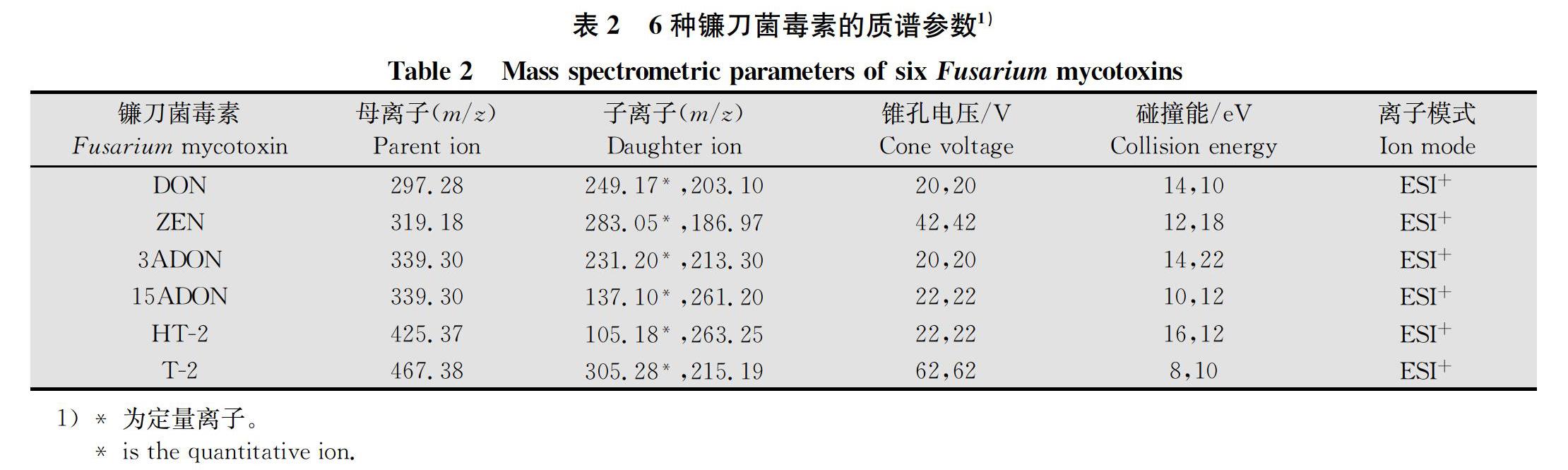
离子源:电喷雾离子源(ESI),正离子模式;喷雾电压3 000 V;干燥气(氮气)流速600 L/h;干燥气(氮气)温度350℃。
1.2.3 6种毒素的标准曲线
用80%的乙腈水溶液,将 DON、ZEN、3ADON、15ADON、T-2、HT-2等6种标准品逐级稀释成1 000、500、200、100、50、20、10 μg/kg的混合标准溶液,按照优化好的液相色谱条件和质谱条件进行测定。
1.2.4 供试小麦样品前处理和添加回收检测试验
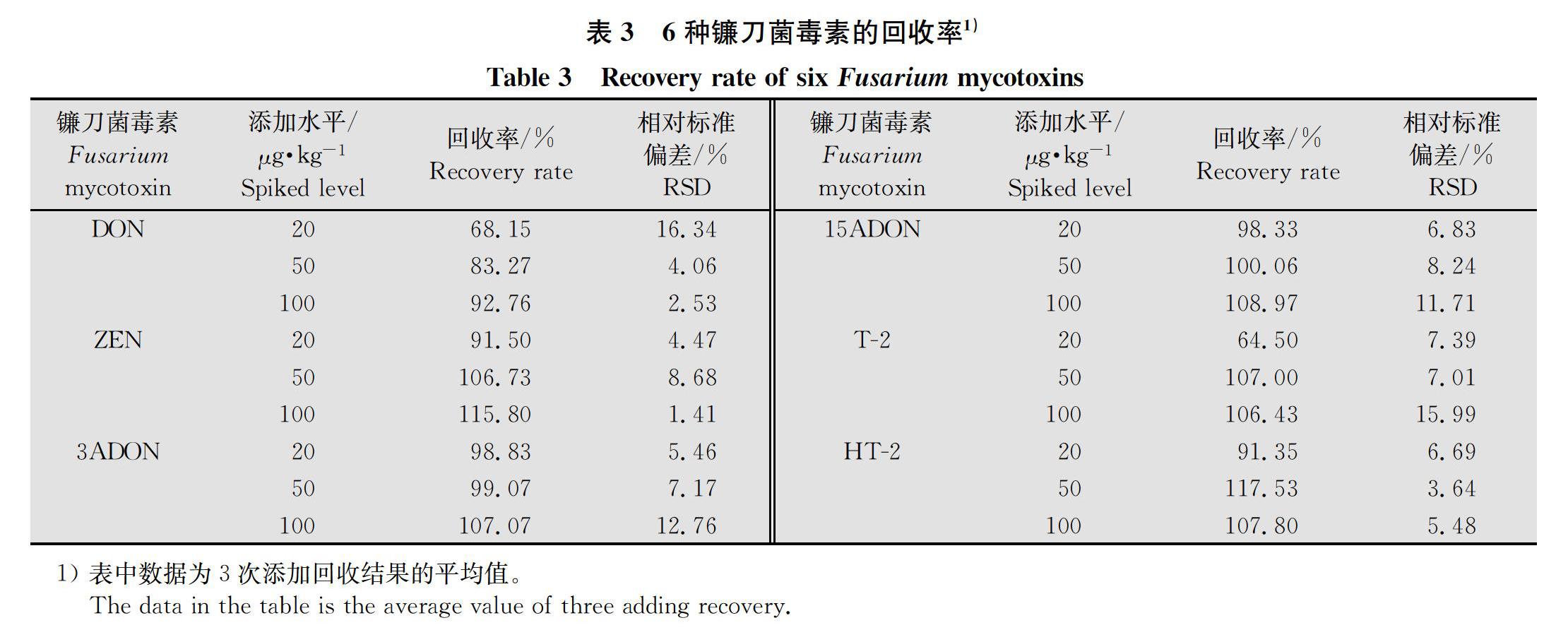
供试小麦样品前处理:随机取参试小麦籽粒样品50 g,用IKA研磨仪将小麦籽粒研磨至细粉状,准确称量5.0 g粉碎均匀的样品,放于50.0 mL聚乙烯离心管中,加入25.0 mL 80%的乙腈溶液进行提取,1 600 r/min匀浆2 min,180~200 r/min振荡2 h后,4 000 r/min低温离心10 min。吸取上清液,依次通过多功能净化柱和0.22 μm有机微孔过滤器,用2 mL进样瓶收集滤液,供UPLC-MS/MS分析。每份小麦样品重复3次。添加回收率检测:选择空白基质小麦样品,将6种毒素按照低(20 μg/kg)、中(50 μg/kg)、高(100 μg/kg)3个水平进行添加,不同组分每个浓度设置3个重复。将上述处理好的样品按照优化好的液相色谱条件和质谱条件进行测定。
1.3 数据处理
使用R3.6.1软件对180份小麦样品中的镰刀菌毒素含量数据进行处理和统计分析,计算样品中6种镰刀菌毒素含量的最大值、最小值、平均值、检出率等参数,对不同地区间6种毒素进行单因子方差分析,采用Tukey检验方法进行差异显著性检验。
2 结果与分析
2.1 检测方法验证
6种毒素DON、ZEN、3ADON、15ADON、T-2、HT-2的3次回收结果稳定,平均回收率分别81.39%、104.68%、101.66%、102.45%、92.64%、105.56%,平均相对标准偏差(RSD)分别为7.64%、4.85%、8.46%、8.93%、10.13%、5.27%,6种毒素回收率与相对标准偏差均满足欧盟Commission Regulation(EC)No 401/2006的相关规定[21](表3)。
2.2 6种毒素标准曲线的建立
根据UPLC-MS/MS检测结果,以标准溶液的浓度(x)为横坐标,6种毒素对应的峰面积(y)为纵坐标,绘制标准曲线进行校正。根据3倍信噪比(S/N)得到各毒素的检出限(LOD);根据10倍信噪比(S/N)得到各毒素的定量限(LOQ)。6种毒素在正离子条件下有良好的线性关系,所绘制的标准曲线相关系数均大于0.999 0(表4)。从结果来看,本试验中采用的液相色谱串联质谱分析方法可靠,试验可行性高,可为后续建立6种镰刀菌毒素检测方法提供指导。
2.3 供试小麦样品毒素的污染情况
在180份小麦籽粒样品中,DON、15ADON和T-2毒素的污染率较高,分别为100.00%、8722%、95.00%;ZEN、3ADON污染率较低,其中,3ADON毒素只在长江中下游冬麦组和黄淮冬麦区南片冬水组分别检测出8份和4份,其他麦区供试样品均未检出,该毒素污染率为6.70%;ZEN毒素在4个麦区的检出率也不高,长江中下游
冬麦组样品中检测到7份,而在黄淮冬麦区南片冬水组121个样品中只检测到1份,在黄淮冬麦区北片水地组只检测到1份,北部冬麦区水地组未检出,污染率为5.03%。在4组供试小麦品种籽粒中均未检测到HT-2毒素。在检出的DON样品中,有10份供试样品DON含量超出国家限量标准(1 000 μg/kg),其余样品含量均在限量标准以内(表5)。
2.4 6种镰刀菌毒素在我国4个小麦主产区的分布情况
来自长江中下游冬麦组小麦籽粒中DON、3ADON与ZEN毒素含量显著高于其他麦区(P<0.05);T-2毒素在长江中下游小麦籽粒中含量显著低于其他麦区(P<0.05);15ADON毒素含量在黄淮冬麦区南片冬水组与长江中下游冬麦组、黄淮冬麦区北片水地组与北部冬麦区水地组以及长江中下游冬麦组与北部冬麦区水地组差异不显著(P>0.05),其他麦区间该毒素含量差异显著(P<0.05)。DON毒素在长江中下游冬麦组样品中平均含量最高,为990.78 μg/kg;T-2毒素在長江中下游冬麦组样品中平均含量最低,为14.10 μg/kg;15ADON在黄淮冬麦区南片冬水组平均含量最高,为147.87 μg/kg,在黄淮冬麦区北片水地组平均含量最低,为56.11 μg/kg;3ADON毒素在长江中下游冬麦组8份样品中含量平均值为6.60 μg/kg,在黄淮冬麦区南片冬水组4份样品中含量平均值为0.32 μg/kg,其他麦区供试样品均未检出;ZEN毒素在长江中下游冬麦组7份样品中含量平均值为3.81 μg/kg,黄淮冬麦区南片冬水组和黄淮冬麦区北片水地组各有1份检测出,浓度分别为0.02 μg/kg和0.08 μg/kg,北部冬麦区水地组样品未检出(表6)。
3 讨论
赤霉病的发生,不仅会降低小麦产量,影响小麦品质,而且对人畜健康存在很大的危害[22]。在全国范围内,赤霉病年均发病面积超过533.3万hm2,超过小麦种植面积的20%[23]。并且,世界上每年约有1/4的粮食受到已确认的真菌毒素的污染[24]。一直以来,我国对于小麦赤霉病的防控主要通过选用抗耐病品种、适时播种、肥水管理等农业防治和药剂防治相结合[25]。但是,在加强防控的同时,还需要提高粮食中镰刀菌毒素的检测水平。目前,我国对于谷物中镰刀菌毒素含量限量标准的规定还不完善,存在已有毒素限量标准针对性不强,T-2、HT-2等部分毒素限量标准缺失的问题[26]。因此,需要提高对镰刀菌毒素含量的关注度,保障人与动物的食品安全。
本研究中,DON毒素含量与检出率都高于其他毒素,并且15ADON毒素含量与检出率高于3ADON毒素。有研究表明,镰刀菌菌株产毒类型与禾谷镰刀菌毒素化学型具有一定的关联性[27]。小麦赤霉病主要由禾谷镰刀菌F.graminearum和亚洲镰刀菌F.asiaticum引起,其中北方麦区以禾谷镰刀菌为优势种群,南方麦区以亚洲镰刀菌为优势种群[28]。禾谷镰刀菌又主要分为3种化学型,分别是产DON毒素和较多15ADON毒素的15ADON化学型;产DON毒素和较多3ADON毒素的3ADON化学型;不产DON毒素的NIV化学型[29]。供试的180份小麦籽粒样品中多为15ADON化学型。从抗病品种来看,虽然小麦品种抗病性与赤霉病发病有明显正相关性[30],但小麦品种抗病性与毒素积累量表现出的相关性并不高,抗病品种只能在一定程度上降低毒素的积累量,并不能完全阻止毒素的产生[31]。因此,尽管在一些小麦产区内种植抗赤霉病的品种,但是DON等镰刀菌毒素的积累问题依然不容小觑。另外,贮存过程中,部分小麦品种的DON毒素浓度会发生变化。当小麦含水量保持在17%~19%时,DON毒素含量随存储时间的推移会不断升高[32]。本研究中T-2毒素在供试小麦籽粒中的污染率也较高,需要引起关注。T-2毒素的产生易受环境影响,在变温、低温、含水量高、中性和酸性条件下更容易产生,碱性、低水分及持续高温会抑制菌株产毒[33]。
就目前我国赤霉病的发病情况来看,气候湿润的长江中下游区域,是赤霉病发生的主要地区[25]。随着全球气候变暖等因素,赤霉病也逐渐向北方地区扩展。在2012年的赤霉病大流行中, 山东南部和西南部较重, 河南整体偏重, 安徽和江苏普遍严重[2]。不考虑贮存过程中的毒素含量变化,小麦赤霉病的发病情况越重,毒素污染程度就越重,毒素含量就越高。从不同麦区毒素含量的比较分析来看,长江中下游冬麦组与黄淮冬麦区南片冬水组毒素含量较高,这与吴杰等[34]、马玉彤等[35]的研究结果和我国小麦赤霉病地区流行规律具有一致性。因此,在长江中下游赤霉病高发地区和黄淮海等部分发病较重的北部麦区,应适时早播,使小麦抽穗扬花期避开赤霉病发病时间;及时调查,尽早掌握病害发生情况;选准药剂,适时综合防控[23]。同时加强镰刀菌毒素含量检测,即使在赤霉病发生不严重的年份也要及时检测,提升对赤霉病致病种及小麦籽粒中毒素含量的关注度,避免毒素对人畜健康造成危害。
参考文献
[1] 郎立云. 小麦赤霉病的发生情况和防治对策[J]. 基层农技推广, 2019, 7(1): 7576.
[2] 程顺和, 张勇, 别同德,等.中国小麦赤霉病的危害及抗性遗传改良[J]. 江苏农业学报, 2012, 28(5): 938942.
[3] 孙悦. 黄淮麦区小麦中镰刀菌的分离及其产毒控制[D]. 杨凌: 西北农林科技大学, 2018.
[4] 姚振宇. 贮存期小麦中镰刀菌毒素含量的变化和毒素治理方法研究[D]. 扬州: 扬州大学, 2016.
[5] NIDERKORN V, BOUDRA H, MORGAVI D P. Binding of Fusarium mycotoxins by fermentative bacteria in vitro [J]. Journal of Applied Microbiology, 2006, 101(4): 849856.
[6] TIEMANN U, VIERGUTZ T, JONAS L, et al. Influence of the mycotoxins alpha-and beta-zearalenol and deoxynivalenol on the cell cycle of cultured porcine endometrial cells [J]. Reproductive Toxicology, 2003, 17(2): 209218.
[7] 尚艳娥,杨卫民. CAC、欧盟、美国与中国粮食中真菌毒素限量标准的差异分析[J]. 食品科学技术学报, 2019, 37(1): 1015.
[8] 李顺意, 于秋香, 向腊,等. 真菌毒素玉米赤霉烯酮生物降解的研究进展[J]. 生物工程学报, 2018, 34(4): 489500.
[9] 吴杰. 小麦镰刀菌毒素的检测及其毒素污染分析[D]. 保定: 河北大学, 2009.
[10]王文珺, 孙双艳, 叶金, 等. 我国现行真菌毒素检测标准概述[J]. 食品安全質量检测学报, 2019, 10(4): 837847.
[11]王晓云, 于雅琴, 俞琼. 2005年中国居民膳食DON污染调查及暴露评估[J]. 长治医学院学报, 2007, 21(2): 101103.
[12]HAN Zheng, NIE Dongxia, EDIAGE E N, et al. Cumulative health risk assessment of co-occurring mycotoxins of deoxynivalenol and its acetyl derivatives in wheat and maize: case study, Shanghai, China [J]. Food and Chemical Toxicology, 2014, 74: 334342.
[13]JI Fang, XU Jianhong, LIU Xin, et al. Natural occurrence of deoxynivalenol and zearalenone in wheat from Jiangsu province, China [J]. Food Chemistry, 2014, 157: 393397.
[14]贺玉梅, 张泽, 贾珍珍. 北京市粮库库存小麦中T-2毒素的污染情况调查[J]. 中国食品卫生杂志, 1998, 10(6): 2426.
[15]高艳, 陶维春, 王睿, 等. 高效液相色谱法与酶联免疫法检测小麦中呕吐毒素含量的比较研究[J]. 种子科技, 2018, 36(9): 102103.
[16]KUZDRALINSKI A, SOLARSKA E, MUSZYNSKA M. Deoxynivalenol and zearalenone occurence in beers analysed by an enzyme-linked immunosorbent assay method [J]. Food Control, 2013, 29(1): 2224.
[17]鲍蕾, 张艺兵, 刘心同, 等. 高效液相色谱法检测出入境粮谷中的T-2毒素[J]. 检验检疫科学, 2005, 15(2): 4951.
[18]BERTHILLER F, SCHUHMACHER R, BUTTINGER G, et al. Rapid simultaneous determination of major type A-and B-trichothecenes as well as zearalenone in maize by high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography A, 2005, 1062(2): 209216.
[19]罗毅, 郑集声, 杨进生. 八种镰刀菌毒素的电子捕获气相色谱分析[J]. 环境化学, 1989, 8(6): 2731.
[20]SOLEIMAN Y F, JINA P S, FARIDA H A, et al. A UPLC-MS/MS for simultaneous determination of aflatoxins, ochratoxin A, zearalenone, DON, fumonisins, T-2 toxin and HT-2 toxin, in cereals [J]. Food Control, 2012, 25(2): 647653.
[21]THE COMMISSION OF THE EUROPEAN COMMUNITIES. Commission Regulation (EC) No 401/2006 of 23 February 2006 laying down the methods of sampling and analysis for the official control of the levels of mycotoxins in foodstuffs [S]. Official Journal of the European Union, 2006, 70: 1234.
[22]于思勤, 马忠华, 张猛, 等. 河南省小麦赤霉病发生规律与综合防治关键技术[J]. 中国植保导刊, 2019, 39(2): 5360.
[23]陈云, 王建强, 杨荣明, 等. 小麦赤霉病发生危害形势及防控对策[J]. 植物保护, 2017, 43(5): 1117.
[24]苏福荣, 王松雪, 孙辉, 等. 国内外粮食中真菌毒素限量标准制定的现状与分析[J]. 粮油食品科技, 2007, 15(6): 5759.
[25]闫向泉, 朱伟, 孟自力. 小麦赤霉病的发生及综合防控[J]. 现代农业科技, 2019(24): 86.
[26]于鸿飞. 国内外小麦粉标准的差异及我国现行小麦粉标准的修订研究[D].杨凌: 西北农林科技大学, 2011.
[27]张伟. 山东省小麦镰刀菌毒素污染状况及其产毒镰刀菌种群研究[D].泰安: 山东农业大学, 2019.
[28]罗文, 张昊, 许景升, 等. 长江中下游地区亚洲镰刀菌NX-2毒素群体的检测[J]. 植物保护, 2016, 42(2): 192197.
[29]樊平声. 小麦赤霉病和DON毒素研究进展[J]. 江苏农业科学, 2010(5): 182184.
[30]陈怀谷, 蔡志祥, 陈飞, 等. 不同小麦品种抗赤霉病性类型和抗毒素积累能力分析[J]. 植物保护学报, 2007, 34(1): 3236.
[31]封薇. 小麦中镰刀菌毒素污染和脱氧雪腐镰刀菌烯醇(DON)积累分析[D].成都: 四川农业大学, 2010.
[32]马义东. 小麦储存期间DON毒素含量的变化规律探讨[J]. 粮食科技与经济, 2019, 44(2): 6970.
[33]李静. 谷物与饲料中T-2毒素免疫检测技术研究[D]. 北京: 中國农业科学院, 2014.
[34]吴杰, 刘太国, 高利, 等. 小麦四种镰刀菌毒素的ELISA检测及毒素污染分析[J]. 植物保护学报, 2009, 36(2): 106112.
[35]马玉彤, 刘太国, 文才艺, 等. 我国不同麦区小麦镰刀菌毒素检测及毒素污染分析[J]. 植物保护学报, 2019, 46(2): 266273.
(责任编辑:田 喆)
