棉铃虫小分子热激蛋白sHSP22.0基因的克隆及表达谱分析
2021-06-29杨朔刘少凯赵少轩朱宇辰徐磊李童云刘晓光安世恒魏纪珍
杨朔 刘少凯 赵少轩 朱宇辰 徐磊 李童云 刘晓光 安世恒 魏纪珍


摘要 :棉鈴虫Helicoverpa armigera是一种重要的农业害虫,本文旨在研究小分子热激蛋白在其生长发育过程、抵御高温及Cry1Ac杀虫蛋白中的功能。利用PCR结合RACE技术克隆了棉铃虫sHSP22.0(small heat shock protein 22.0)基因,通过生物信息学软件分析了棉铃虫sHSP22.0基因序列,利用实时荧光定量qRT-PCR分析了该基因在棉铃虫不同生长发育阶段和组织中的表达模式;并分析了该基因受高温及Cry1Ac全长蛋白的诱导效应。获得了棉铃虫sHSP22.0(GenBank登录号: XP_021196802.1) 761 bp cDNA片段,其开放阅读框576 bp,编码191个氨基酸,具有小分子热激蛋白典型的α-晶体结构域(α-crystallin domain,ACD)。sHSP22.0在棉铃虫4龄和5龄期特异性表达,尤其在5龄幼虫的表皮、中肠和后肠内特异性表达。该小分子热激蛋白受温度和Cry1Ac全长蛋白的诱导后显著高表达。sHSP22.0不仅在暴食期及肠道内特异性表达,而且响应Cry1Ac全长蛋白的诱导,表明它在棉铃虫消化吸收及抵御外源物的活动中可能起到重要的作用。
关键词 :棉铃虫; 小分子热激蛋白; sHSP22.0; 温度; Cry1Ac全长蛋白
中图分类号:
Q 966
文献标识码: A
DOI: 10.16688/j.zwbh.2020009
Molecular cloning and expression profiling of small heat shock protein 22.0 in
Helicoverpa armigera (Lepidoptera: Noctuidae)
YANG Shuo, LIU Shaokai, ZHAO Shaoxuan, ZHU Yuchen, XU Lei, LI Tongyun,
LIU Xiaoguang, AN Shiheng, WEI Jizhen*
(State Key Laboratory of Wheat and Maize Crop Science, College of Plant Protection, Henan Agricultural University, Zhengzhou 450002, China)
Abstract
Helicoverpa armigera is an important agricultural pest. This study aims to explore the functions of small heat shock protein 22.0 gene (sHSP22.0) in the growth and development of cotton bollworm, and its role in suffering the high temperature and Cry1Ac protein. The full-length cDNA sequence of sHSP22.0 gene was cloned from H.armigera by using PCR and RACE (rapid amplification of cDNA ends) technology, and the sHSP22.0 gene was analyzed by bioinformatics related molecular software. Real-time quantitative PCR (qRT-PCR) was used to assess the expression patterns of sHSP22.0 in different developmental stages and tissues of cotton bollworm. Meanwhile, the expression levels of sHSP22.0 were also checked in the larval after heat and full-length Cry1Ac protein treatments. The results showed that the full-length cDNA sequence of sHSP22.0 (GenBank accession no: XP_021196802.1) was 761 bp with an open reading frame (ORF) 576 bp in length, encoding 191 amino acids, and it had the typical α-crystallin domain (ACD). The sHSP22.0 gene was specially expressed in 4th and 5th instar larvae, and especially expressed in midgut, hindgut and cuticle of 5th instar larvae. After the heat and full-length Cry1Ac protein treatments, sHSP22.0 showed special expression in 5th instar larvae. The sHSP22.0 gene specially expresses in the gluttony period and gut of H.armigera, and importantly, it is induced by full-length Cry1Ac protein. All the results indicate sHSP22.0 may participate in the activities of the digestion and absorption, and may have the function in defensing against exogenous substrates.
Key words
Helicoverpa armigera; small heat shock protein; sHSP220; temperature; full-length Cry1Ac protein
热激蛋白(heat shock proteins,HSPs)在生物体内广泛存在,以应激蛋白和分子伴侣的方式响应外界生物和非生物因子的压力,参与蛋白质的装配、折叠和跨膜传导等众多的生物过程[12]。按照序列的同源性及分子量的大小,热激蛋白常被分为4类:HSP90(85~90 kDa)、HSP70(68~73 kDa)、HSP60和小分子量sHSP家族[3]。在自然界中,昆虫个体较小又是变温动物,由于长期适应环境的变化,昆虫体内进化出了种类繁多的热激蛋白[4]。其中小分子热激蛋白(sHSP)的数目尤为繁多,它们具有保守的α-晶状体结构域,但相对于大分子的热激蛋白,其序列不保守且功能复杂。小分子热激蛋白的发现也较晚,1974年科学家才从黑腹果蝇Drosophila melanogaster中发现了小分子热激蛋白[5],对小分子热激蛋白的研究较少。后随着测序技术的发展,更多的小分子热激蛋白被鑒定出来,例如在家蚕Bombyx mori中发现了16种sHSP,小菜蛾Plutella xylostella中鉴定出15种sHSP,另外棉铃虫Helicoverpa armigera中也发现了8种sHSP[68]。研究发现这些小分子热激蛋白在生物体内表达模式多种多样,推测它们可能在昆虫的发育过程和各种生理活动中具有重要的功能,例如调节昆虫的生长发育和繁殖[912]、抵御温度变化[1315]、参与昆虫的滞育[1617]和抵御农药的危害等[18]。
棉铃虫是一种重要的农业害虫,为害棉花、玉米、花生等几百种农作物[1920]。近20多年来,人们主要通过种植转苏云金芽胞杆菌Bacillus thuringiensis(Bt)杀虫蛋白基因的作物来防治棉铃虫。然而,棉铃虫的发生随着我国农业种植结构的调整产生了明显的变化,玉米、花生、蔬菜等非Bt作物种植面积增加,棉铃虫寄主植物发生了转变,从而致使其种群密度不断增加,为害加重[21]。因此对棉铃虫的研究和防治仍然任重而道远。
在棉铃虫中,不同分子量的热激蛋白逐渐被鉴定出来,但是具体每种热激蛋白的功能研究还处于初级阶段。棉铃虫热激蛋白HSP70和HSP21.4基因在棉铃虫滞育蛹的脑中高表达[2223],随后研究发现热效应因子HSF1(heat shock factor 1)在棉铃虫滞育阶段调控Hsp70的上调表达,参与了棉铃虫滞育[24]。棉铃虫热激蛋白Hsp19.5、Hsp19.7、Hsp22.0、Hsp272、Hsp60、HSC70、Hsp200、Hsp20.7、Hsp20.8、Hsp21.4、HSC90基因响应光胁迫,这些热激蛋白以不同的方式协调保护昆虫免受紫外线的伤害[8]。经37℃到42℃热激处理后,棉铃虫幼虫唾液腺中,Hsp70和Hsp64高丰度表达,但在幼虫的马氏管、睾丸和脂肪体中Hsp70几乎不表达而Hsp64高水平表达[25],这预示着不同的热激蛋白在不同的组织中可能发挥不同的功能。棉铃虫Hsp70和Hsp90在温度高于38℃时表达量会随温度的升高逐渐升高,这可能与环境温度适应相关[26]。蛋白质组学研究表明,棉铃虫HSP70可与Cry1Ac蛋白结合[27],Cry1Ac杀虫蛋白处理后,棉铃虫幼虫HSP70基因的表达量降低[28]。
上述对棉铃虫热激蛋白的鉴定和功能研究在一定程度上丰富了热激蛋白的研究。但是随着气温的变化及转cry1Ac基因的棉花在我国的全面推广等,来自外界的环境压力迫使棉铃虫快速适应环境变化,而热激蛋白在棉铃虫抵御环境压力中的功能还急需研究,这对棉铃虫的种群控制具有重要的意义。在本研究中,我们通过分子生物学手段,克隆了棉铃虫的一个小分子热激蛋白sHSP22.0基因,分析了它在棉铃虫不同发育历期和组织中的表达谱,并比较了其在受到高温和Cry1Ac全长蛋白诱导时的表达情况,为丰富棉铃虫热激蛋白的研究及棉铃虫的防控提供了理论基础。
1 材料与方法
1.1 供试棉铃虫及Bt杀虫蛋白
本研究中供试棉铃虫为未接触任何生物杀虫剂或化学杀虫剂的棉铃虫敏感种群LF品系(中国农业科学院植物保护研究所棉花害虫组梁革梅研究员赠予),幼虫取食棉铃虫人工饲料,成虫取食10%的糖水,于室内相对湿度(75±10)%,温度(27±2)℃和光周期L∥D=14 h∥10 h条件下连续饲养15年[29]。
Cry1Ac全长蛋白购于北京绽诺思特生物科技有限公司。
1.2 样品准备
1.2.1 棉铃虫各发育阶段和组织样品的准备
饲养棉铃虫,分别收集1龄(20头)、2龄(10头)、3龄(5头)、4龄(3头)、5龄(3头)、蛹(3头)和成虫(3头),为1个生物学重复,用于研究sHSP22.0基因在棉铃虫各发育阶段的表达模式。取5龄第2天棉铃虫10头,在冰上解剖棉铃虫的前肠、中肠、后肠、马氏管和表皮。解剖后,前肠、中肠和后肠用4℃预冷的0.7% NaCl溶液洗去内含物,用滤纸吸干水分后保存备用,用于比较不同组织中sHSP22.0基因的表达差异。上述样品一经处理后,立即放入液氮冷冻,再转放到-80℃冰箱中保存备用,3次生物学重复。
1.2.2 高温处理样品的准备
取27℃正常饲养的5龄棉铃虫,放入40℃培养箱,处理1 h和2 h后,立即放入液氮中冷冻,再转存到-80℃冰箱中保存备用。同样取生长状况一致的棉铃虫,于27℃分别处理1 h和2 h为对照。每个处理包括4次生物学重复,每个重复取样3头。
1.2.3 Cry1Ac处理样品的准备
饲养棉铃虫,取5龄第1天棉铃虫,饥饿24 h后,转到含30 μg/mL Cry1Ac全长蛋白(经预试验,该浓度是处理5龄棉铃虫幼虫7 d后LC30的剂量)或不含Cry1Ac全长蛋白的人工饲料上,饲喂1 h和2 h后,立即转移到冰上解剖取中肠,步骤同1.2.1。每个处理包括4次生物学重复,每个重复取样10头。
1.3 总RNA的提取和cDNA合成
以上各备用样品总RNA的提取采用TRIzol法,按Invitrogen的操作说明提取。RACE扩增所用的cDNA模板的合成参考SMART-RACE cDNA Amplification Kit 说明书操作,样品为棉铃虫5龄幼虫的中肠组织。荧光定量qRT-PCR所用cDNA模板依照SuperReal PreMix(Probe)说明书合成。
1.4 棉铃虫sHSP22.0全长基因克隆
根据前期实验室得到的棉铃虫的转录组数据[30],获得sHSP22.0的部分序列,利用软件Primer 5.0设计特异性5′RACE引物sHSP22.0-RACE-5′(表1),以敏感棉铃虫cDNA为模板,扩增其5′端序列。PCR的反应体系为25 μL:1 μL cDNA,2.5 μL 10×Buffer, 0.25 μL LATaq,0.5 μL sHSP22.0-RACE-5′引物(10 mmol/L),2.5 μL UPM,18.25 μL无菌水。PCR反应程序:94℃预变性4 min;94℃变性30 s,72℃ 延伸3 min, 循环5次;94℃变性30 s,70℃ 退火30 s, 72℃延伸3 min,循环5次;94℃变性30 s,68℃ 退火30 s, 72℃延伸3 min,循环35次;72℃延伸10 min。PCR产物经1.2%琼脂糖凝胶电泳检测,切割目的条带,送北京博迈德基因技术有限公司进行序列测定。测序成功后拼接序列,设计特异性引物sHSP22.0-ORF-F和sHSP22.0-ORF-R(表1),以棉铃虫中肠cDNA为模板,扩增其开放阅读框,PCR的反应体系为25 μL: 1 μL cDNA, 0.5 μL sHSP22.0-ORF-F引物(10 mmo/L)和0.5 μL sHSP22.0-ORF-R引物(10 mmo/L),1 μL dNTPs,2.5 μL 10×EasyTaq Buffer,0.25 μL EasyTaq E,19.25 μL无菌水。PCR反应程序:94℃预变性4 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,循环35次;72℃延伸10 min。反应结束后,如上述方法检测并测序。
1.5 序列分析和系统发育树的构建
利用基因探索者软件分析sHSP22.0基因,预测其开放阅读框长度,并对阅读框进行翻译;利用在线软件(https:∥web.expasy.org/compute pi/)和SWISS-MODEL分析该小分子热激蛋白的相对分子量、等电点和结构域;再在NCBI数据库中进行BLASTp 同源序列分析,选取同源性较高的不同昆虫的小分子热激蛋白,利用MEGA 7(7014)软件,选用Jones-Taylor-Thornton(JTT)模型,利用最大相似法(maximum likelihood method)构建系统进化树进行聚类分析。
1.6 荧光定量RT-PCR分析
根据上述扩增得到的棉铃虫sHSP22.0的cDNA序列,送Invitrogen公司设计并合成Taqman探针sHSP22.0-RTPCR-P(5′端用FAM标记,3′端用MGB标记)及荧光定量RT-PCR的特异性引物sHSP22.0-RTPCR-F和sHSP22.0-RTPCR-R(表1)。熒光定量采用双内参法,内参基因分别为棉铃虫Actin基因(GenBank 登录号:X97615.1) 和glyceraldehyde-3-phosphate dehydrogenase(GAPDH基因)(GenBank 登录号 JF417983.1)。20 μL RT-PCR反应体系包括正向和反向引物(10 μmol/L)各0.6 μL,探针(10 μmol/L)0.4 μL,MaximaR Probe/ROX qPCR Master Mix(2×)10 μL,cDNA2 μL和无菌水6.4 μL。于7500 Fast实时荧光定量PCR仪(美国ABI公司)中进行扩增。反应程序为:95℃预变性10 min;95℃变性3 s,60℃退火/延伸30 s,循环40次。qRT-PCR进行3次技术重复。数据分析使用相对定量分析方法,计算公式采用2-ΔΔCt法[31]。
1.7 数据处理
利用DPS7.05软件对试验数据进行方差分析,其中不同发育阶段,不同组织,温度或Cry1Ac全长蛋白不同处理时间之间的方差分析采用单因素Tukey法,在P<0.05水平进行显著性分析。
2 结果与分析
2.1 棉铃虫sHSP22.0基因序列及系统进化位置
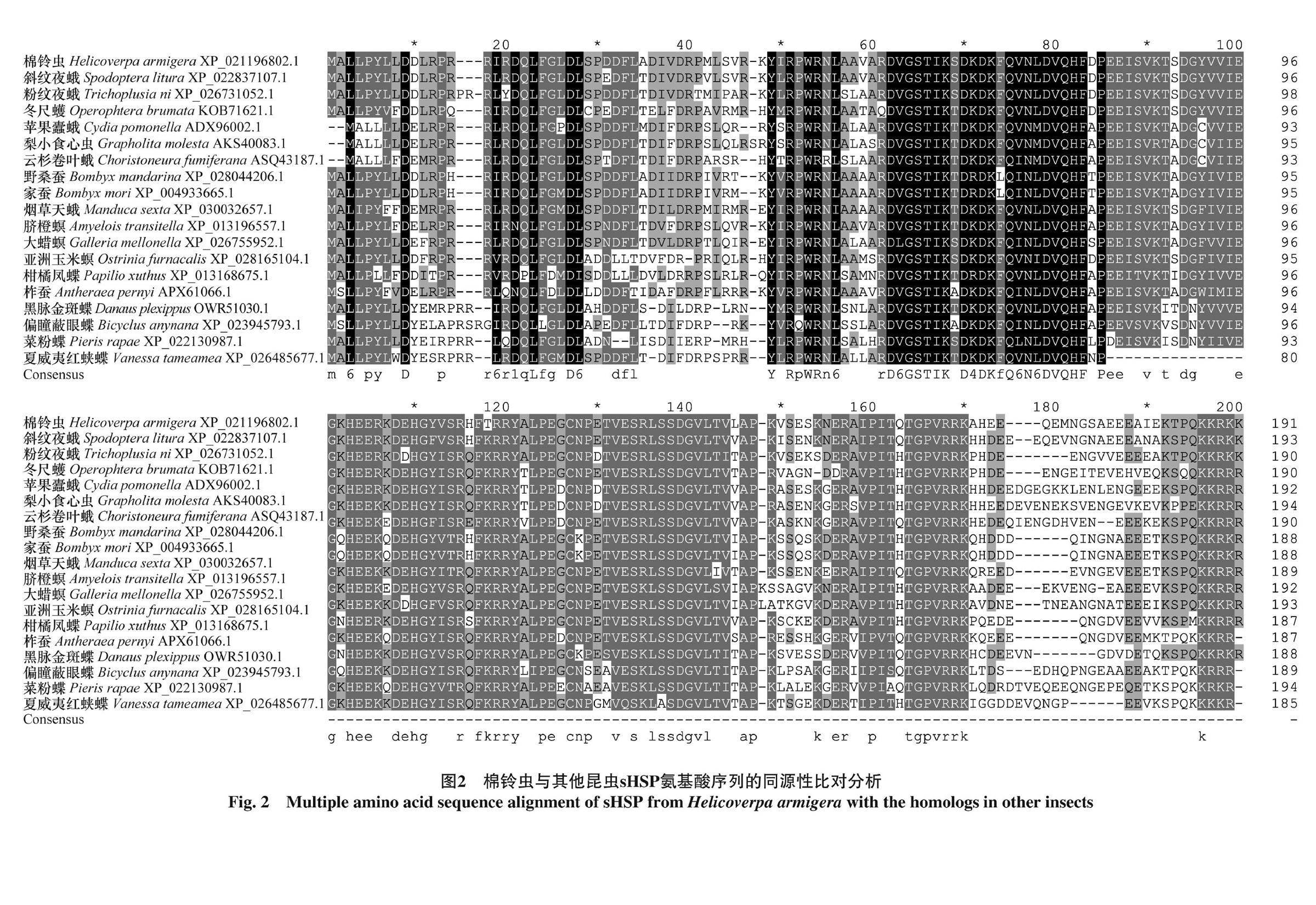
从棉铃虫中肠组织cDNA中扩增得到一条761 bp的基因序列,开放阅读框为576 bp,编码191个氨基酸,GenBank登录号为XP_021196802.1。在线软件预测其蛋白分子量为22.0 kDa,等电点为6.54。同时对该基因结构域的预测分析表明它具有可变的N-末端区域(氨基酸残基1—49),小分子热激蛋白保守的α-晶状体结构域(氨基酸残基 50—159),以及C-末端区域(氨基酸残基160—191)(图1),属于典型的小分子热激蛋白,我们将其命名为sHSP22.0。
在NCBI数据库中进行BLASTp 同源序列分析,棉铃虫sHSP22.0的氨基酸序列与其他18种昆虫的序列同源性较高,与小分子热激蛋白具有类似的α-晶状体结构域(图2)。但是,棉铃虫sHSP22.0与不同昆虫的sHSPs比较,N端差异显著(图2);同时,sHSP22.0与不同分子量的热激蛋白间C-端也存在较大差异(图2)。通过比对分析,棉铃虫sHSP22.0的氨基酸序列与斜纹夜蛾Spodoptera litura l(2)efl(protein lethal(2)essential for life-like,l(2)efl,同属小分子的热激蛋白家族基因)氨基酸序列同源性在90%以上;与其他被比较的鳞翅目夜蛾科昆虫的氨基酸同源性在70%以上(图2)。
利用MEGA 7(7. 0.14)软件,采用最大似然法进一步分析了棉铃虫sHSP 22.0基因的进化关系,我们以白符跳Folsomia candida为外群,将棉铃虫sHSP22.0氨基酸序列与18种昆虫的相近基因的氨基酸序列进行了进化树分析(图3)。结果表明,棉铃虫sHSP22.0与鳞翅目昆虫的sHSP聚在了同一进化支上,其中与已经鉴定的斜纹夜蛾S.litura l(2)efl的进化关系最近,其次是烟草天蛾M.sexta l(2)efl(图3)。这与上述氨基酸序列同源性分析结果一致。
2.2 sHSP22.0在棉铃虫不同发育期和组织中的表达
通过qRT-PCR分析,sHSP22.0的表达主要在幼虫4龄和5龄阶段,在幼虫的低龄期、蛹和成虫中均未检测到sHSP22.0的表达(图4a)。进一步分析sHSP22.0基因在棉铃虫5龄幼虫各组织中表达的情况,发现该基因在中肠、后肠和表皮中均有表达,后肠中表达量最高,其次是表皮和中肠中,但是在前肠和马氏管中没有检测到其表达(图4b)。
2.3 sHSP22.0在棉铃虫受高温和Cry1Ac全长蛋白诱导时的表达差异
40℃处理后,sHSP22.0基因的表达显著上调,特别是在处理1 h时,表达量显著上调6 240.28倍(F=365.16, P=0.000 1)(图5a)。除此之外,sHSP22.0基因的表达还受到Cry1Ac全长蛋白的诱导,棉铃虫在取食Cry1Ac全长蛋白后1 h和2 h,该基因均显著上调表达(F=22.185,P=0.000 3),最高在1 h时表达量上调20.53倍(图5b)。
3 讨论
通过分析棉铃虫热激蛋白sHSP22.0的基因序列,发现其是典型的小分子热激蛋白家族的基因,也具有α-晶状体结构域。小分子热激蛋白的N端多变[3],同源序列分析表明不同热激蛋白分子间的N端差异也较大。本研究中棉铃虫sHSP22.0与其他被比较的小分子量热激蛋白间C-端也存在较大差异,这可能是由于被鉴定的小分子热激蛋白数量有限,sHSP22.0与被比较的其他鳞翅目昆虫的sHSP之间在分子量上存在差异,也可能是由于小分子热激蛋白的多样性造成的[4]。尽管被比较的小分子热激蛋白存在一定的差异,但是棉铃虫sHSP22.0与其他鳞翅目昆虫的小分子热激蛋白仍具有较高的同源性,并聚为一支。
在棉铃虫1龄、2龄和3龄幼虫,蛹和成虫,以及在5龄期的马氏管和前肠均没有检测到sHSP22.0基因的表达。这种小分子热激蛋白基因在某些发育阶段或组织中不表达的现象在小菜蛾中也有报道,其中sHSP18.8在小菜蛾幼虫3龄和4龄阶段不表达,sHSP19.23和sHSP23.4在卵中不表达[32]。热激蛋白在一些发育阶段不表达可能预示着它们没有参与这个阶段的生理生化活动。sHSP22.0基因在棉铃虫幼虫4龄和5龄期特异性表达,这种小分子热激蛋白在特定的幼虫期表达的现象在其他昆虫中也普遍存在。例如,地中海实蝇Ceratitis capitata的2个hsp23基因在幼虫阶段高表达[33]。组织特异性分析发现sHSP22.0基因在5龄棉铃虫中肠和后肠中特异性表达,这种组织特异性表达同样也有报道,例如家蚕的sHSP20.4在中肠内特异性高表达[17],小菜蛾的4个小分子热激蛋白基因sHSP19.5、sHSP20.1、sHSP21.6和sHSP21.8在腸道内的表达高于其他组织[32]。基因的阶段性或组织特异性表达往往预示着它可能参与到了该阶段或组织中的生命活动。棉铃虫作为重要的农业害虫,主要危害阶段是幼虫期,尤其4龄和5龄是棉铃虫的暴食阶段,也是棉铃虫重要营养阶段。棉铃虫sHSP22.0基因在这个阶段的特异性表达,尤其在肠道内的相对高表达,表明sHSP22.0基因在棉铃虫消化吸收以及抵御外源物等活动中可能起到重要的作用。sHSP22.0基因除了在肠道内特异性表达外,还在棉铃虫表皮中表达。小分子热激蛋白在表皮中特异性表达的现象在小菜蛾中也有报道,Chen 等[32]在小菜蛾中鉴定到了5种小分子热激蛋白在表皮中超表达。表皮是昆虫抵御外界侵入的重要保护屏障,sHSP22.0基因在表皮中的特异性表达,再次表明它可能参与昆虫抵御外源物过程。根据热激蛋白的功能研究,推测它可能通过维持昆虫正常的器官功能或作为蛋白质的重要分子伴侣保护蛋白质的正常功能的方式抵御外界侵害[35]。
热激蛋白分子受高温诱导表达的反应是昆虫适应温度变化的重要保护机制。热激蛋白的表达受温度的诱导,但是表达一般具有瞬时性,短则几分钟就可以检测到昆虫体内热激蛋白表达量增加,长则在1~2 h时积累量会达到高峰,随后会显著下降[36]。棉铃虫热激蛋白sHSP22.0具有热激蛋白分子典型的小分子结构[3738],而且我们发现其表达水平在受温度诱导1 h后显著上调6 240.28倍。高温可以诱导小分子热激蛋白的表达,这种现象在其他昆虫中也较为常见,例如高温可以显著诱导小菜蛾12种小分子热激蛋白基因表达[32],腰腹长体茧蜂Macrocentrus cingulum的Hsp23.8和柞蚕Antheraea pernyi的Hsp21经热激后也可迅速上调表达[3940]。自然界中,温度在调控生物的生理生化过程中起着重要的作用,尤其对于昆虫这种变温动物。棉铃虫热激蛋白sHSP22.0快速显著地响应温度的诱导,表明它在帮助棉铃虫适应不利条件,保护自身正常生理活动中起到非常重要的作用。
本研究中棉铃虫sHSP22.0也响应Cry1Ac全长蛋白的诱导,1 h时表达可上调20.53倍。据报道云杉夜蛾Choristoneura fumiferana取食亚致死剂量的Cry1Ab全长蛋白后,HSP90的表达量显著上调[41]。这表明棉铃虫sHSP22.0在抵御Cry1Ac全长蛋白的作用过程中可能起到重要的作用。然而,另有研究报道棉铃虫取食Cry1Ac全长蛋白后,HSP70的表达量降低[28]。这显示小分子热激蛋白与大分子热激蛋白的功能可能存在差异,对于棉铃虫sHSP220具体在棉铃虫抵御高温和Cry1Ac全长蛋白中如何发挥功能还需要进一步的深入研究。
参考文献
[1] JIANG Jianjun, HUANG Lifeng, CHEN Hongsong, et al. Identification of reference genes and expression analysis of heat shock protein genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae), after exposure to heat stress [J]. Acta Entomologica Sinica, 2015, 32(5): 633639.
[2] SHI Jinxuan, FU Mingjun, ZHAO Chao, et al. Characterization and function analysis of Hsp60 and Hsp10 under different acute stresses in black tiger shrimp, Penaeus monodon [J]. Cell Stress and Chaperones, 2015, 21(2): 295312.
[3] DENLINGER D L. Regulation of diapause [J]. Annual Review of Entomology, 2002, 47(1): 93122.
[4] BUBLIY O A, LOESCHCKE V. Variation of life-history and morphometrical traits in Drosophila buzzatii and Drosophila simulans collected along an altitudinal gradient from a Canary island [J]. Biological Journal of the Linnean Society, 2005, 84(1): 119136.
[5] TISSIRES A, MITCHELL H K, TRACY U M. Protein synthesis in salivary glands of Drosophila melanogaster: Relation to chromosome puffs [J]. Journal of Molecular Biology, 1974, 84(3): 389398.
[6] LI Ziwen, LI Xue, YU Quanyou, et al. The small heat shock protein (sHSP) genes in the silkworm, Bombyx mori, and comparative analysis with other insect sHSP genes [J/OL]. BMC Evolutionary Biology, 2009, 9(1): 215.DOI: 10.1186/147121489215.
[7] 夏曉峰, 林海兰, 郑丹丹, 等. 小菜蛾热休克蛋白基因的鉴定及其表达模式分析[J]. 昆虫学报, 2013, 56(5): 457464.
[8] 王丽君. 棉铃虫响应光胁迫的特点及分子机制研究[D]. 武汉: 华中农业大学, 2018.
[9] GLASER R L, LIS J T. Multiple, compensatory regulatory elements specify spermatocyte-specific expression of the Drosophila melanogaster hsp26 gene [J]. Molecular and Cellular Biology, 1990, 10(1): 131137.
[10]MARIN R, VALET J P, TANGUAY R M. Hsp23 and Hsp26 exhibit distinct spatial and temporal patterns of constitutive expression in Drosophila adults [J]. Developmental Genetics, 1993, 14(1): 6977.
[11]MICHAUD S, MORROW G, MARCHAND J, et al. Drosophila small heat shock proteins: cell and organelle-specific chaperones? [J]. Progress in Molecular and Subcellular Biology, 2002, 28: 79101.
[12]TAKAHASHI K H, RAKO L, TAKANO-SHIMIZU T, et al. Effects of small Hsp genes on developmental stability and microenvironmental canalization [J/OL]. BMC Evolutionary Biology, 2010, 10: 284.DOI: 10.1186/1471214810284.
[13]GARCZYNSKI S F, UNRUH T R, GUDOT C, et al. Characterization of three transcripts encoding small heat shock proteins expressed in the codling moth, Cydia pomonella (Lepidoptera: Tortricidae) [J]. Insect Science, 2011, 18(5): 473483.
[14]LIU Zhaohua, XI Dongmei, KANG Mingjiang, et al. Molecular cloning and characterization of Hsp27.6: the first reported small heat shock protein from Apis cerana cerana [J]. Cell Stress & Chaperones, 2012, 17(5): 539551.
[15]KING A M, MACRAE T H. Insect heat shock proteins during stress and diapause [J]. Annual Review of Entomology, 2015, 60(1): 5975.
[16]RINEHART J P, LI A, YOCUM G D, et al. Up-regulation of heat shock proteins is essential for cold survival during insect diapause [J]. Proceedings of the National Academy of Sciences, 2007, 104(27): 1113011137.
[17]SARAVANAKUMAR R, PONNUVEL K M, QADRI S M H. Expression of metabolic enzyme genes and heatshock protein genes during embryonic development in diapause and non-diapause egg of multivoltine silkworm Bombyx mori [J]. Biologia, 2008, 63(5): 737744.
[18]DOGANLAR O, DOGANLAR Z B. Responses of antioxidant enzymes and heat shock proteins in Drosophila to treatment with a pesticide mixture arch [J]. Archives of Biological Sciences, 2015, 67(3): 869876.
[19]WU Kongming, GUO Yuyuan. The evolution of cotton pest management practices in China [J]. Annual Review of Entomology, 2005, 50(1): 3152.
[20]WU Kongming. Monitoring and management strategy for Helicoverpa armigera resistance to Bt cotton in China [J]. Journal of Invertebrate Pathology, 2007, 95(3): 220223.
[21]陸宴辉, 姜玉英, 刘杰, 等. 种植业结构调整增加棉铃虫的灾变风险[J]. 应用昆虫学报, 2018, 55(1):1924.
[22]LU Yuxuan, XU Weihua. Proteomic and phosphoproteomic analysis at diapause initiation in the cotton bollworm, Helicoverpa armigera [J]. Journal of Proteome Research, 2012, 9(10): 50535064.
[23]BAO Bin, XU Weihua. Identification of gene expression changes associated with the initiation of diapause in the brain of the cotton bollworm, Helicoverpa armigera [J/OL]. BMC Genomics, 2011, 12: 224.DOI: 10.1186/1471216412224.
[24]CHEN Wei, GENG Shaolei, SONG Zhe, et al. Alternative splicing and expression analysis of HSF1 in diapause pupal brains in the cotton bollworm, Helicoverpa armigera [J]. Pest Management Science, 2019, 75(5): 12581269.
[25]SINGH A K, LAKHOTIA S C. Tissue-specific variations in the induction of Hsp70 and Hsp64 by heat shock in insects [J]. Cell Stress & Chaperones, 2000, 5(2): 9097.
[26]BRANCO M, ESQUVEL M G, CORTEN M, et al. Heat shock proteins expression and survival at fluctuating high temperature in the larvae of two moth species, Helicoverpa armigera and Thaumetopoea pityocampa [J]. Bulletin of Insectology, 2019, 72(1): 6168.
[27]CHEN Lizhen, LIANG Gemei, ZHANG Jie, et al. Proteomic analysis of novel Cry1Ac binding proteins in Helicoverpa armigera (Hübner) [J]. Archives of Insect Biochemistry and Physiology, 2010, 73(2): 6173.
[28]YUAN Can, DING Xuezhi, XIA Liqiu, et al. Proteomic analysis of BBMV in Helicoverpa armigera midgut with and without Cry1Ac toxin treatment [J]. Biocontrol Science and Technology, 2011, 21(2): 139151.
[29]梁革梅, 谭维嘉, 郭予元. 人工饲养棉铃虫技术的改进 [J]. 植物保护, 1999, 25(2): 1517.
[30]WEI Jizhen, LIANG Gemei, WU Kongming, et al. Cytotoxicity and binding profiles of activated Cry1Ac and Cry2Ab to three insect cell lines [J]. Insect Science, 2018, 25(4): 655666.
[31]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt [J]. Methods, 2001, 25(4): 402408.
[32]CHEN Xien, ZHANG Yalin. Identification of multiple small heat-shock protein genes in Plutella xylostella (L.) and their expression profiles in response to abiotic stresses [J]. Cell Stress and Chaperones, 2015, 20(1): 2335.
[33]KOKOLAKIS G, KRITSIDIMA M, TKACHENKO T, et al. Two hsp23 genes in the Mediterranean fruit fly, Ceratitis capitata: structural characterization, heat shock regulation and developmental expression [J]. Insect Molecular Biology, 2009, 18(2): 171181.
[34]CHEN Wenbo, LIU Chenxi, XIAO Yutao, et al. A toxin-binding alkaline phosphatase fragment synergizes Bt toxin Cry1Ac against susceptible and resistant Helicoverpa armigera [J/OL]. PLoS ONE, 2015, 10(4): e0126288. DOI:101371/journal.pone.0126288.
[35]GU Jun, HUANG Lixia, SHEN Yong, et al. Hsp70 and small Hsps are the major heat shock protein members involved in midgut metamorphosis in the common cutworm, Spodoptera litura [J]. Insect Molecular Biology, 2012, 21(5): 535543.
[36]KIMPEL J A, NAGAO R T, GOEKJIAN V, et al. Regulation of the heat shock response in soybean seedlings [J]. Plant Physiology, 1990, 94(3): 988995.
[37]KRIEHUBER T, RATTEI T, WEINMAIER T, et al. Independent evolution of the core domain and its flanking sequences in small heat shock proteins [J]. FASEB Journal, 2010, 24(10): 36333642.
[38]BASHA E, ONEILL H, VIERLING E. Small heat shock proteins and α-crystallins: dynamic proteins with flexible functions [J]. Trends in Biochemical Sciences, 2012, 37(3): 106117.
[39]XU Pengjun, XIAO Jinhua, LIU Li, et al. Molecular cloning and characterization of four heat shock protein genes from Macrocentrus cingulum(Hymenoptera: Braconidae) [J]. Molecular Biology Reports, 2012, 37(5): 22652272.
[40]LIU Qiuning, ZHU Baojian, DAI Lishang, et al. Overexpression of small heat shock protein 21 protects the Chinese oak silkworm Antheraea pernyi against thermal stress [J]. Journal of Insect Physiology, 2013, 59(8): 848854.
[41]MEUNIER L, PREFONTAINE G, VAN MUNSTER M, et al. Transcriptional response of Choristoneura fumiferana to sublethal exposure of Cry1Ab protoxin from Bacillus thuringiensis [J]. Insect Molecular Biology, 2006, 15(4): 475483.
(責任编辑:杨明丽)
