CuAl2O4尖晶石结构对浆态床一氧化碳加氢性能的影响
2021-06-29闫鹏泉王竟荣沈亚星左志军高志华
闫鹏泉,王竟荣,沈亚星,左志军,高志华,黄 伟
(太原理工大学省部共建煤基能源清洁高效利用国家重点实验室,太原 030024)
铜基尖晶石CuX2O4(Al,Fe和Cr等)为立方晶格型的复合氧化物,其中Cu2+占据四面体位置,稳定在氧化物晶格结构中,不仅保持了Cu2+的高分散度,而且使其在参与反应的过程中被缓慢还原,从而避免了Cu 物种快速烧结[1,2].Cu 基尖晶石作为催化剂的报道非常多.Fukunaga 等[3]研究发现,与CuO/Mn3O4催化剂相比,CuMn 尖晶石催化剂还原后Cu 的分散度更高,表现出更高的甲醇重整活性.Faungnawakij 等[4]制备的CuFe 尖晶石催化剂用于催化二甲醚重整反应,具有较高的活性和优异的寿命.Bahmanpour等[5]通过原位形成CuAl尖晶石,在逆水气变换反应中显示出高活性和高稳定性.
本课题组[6~11]一直从事浆态床反应器中一氧化碳加氢制备低碳醇和二甲醚的研究,针对浆态床的使用特性发明了专门的催化剂制备方法—完全液相法.前期工作发现,采用完全液相法在高压(1~4 MPa)下热处理前驱体,获得的CuZnAl浆状催化剂中含有CuAl2O4尖晶石物相.研究表明该物相存在时,CuZnAl 浆状催化剂催化合成气制备低碳醇的性能会大幅度提高,C2+OH 占总醇质量分数从25.8%最高可提升至65.9%[12].但是,目前尚不能实现通过完全液相法来控制CuZnAl 浆状催化剂中CuAl2O4尖晶石的结构和含量,因此对于CuAl2O4尖晶石在CuZnAl浆状催化剂这一复杂体系中发生的结构变化和所起到的作用尚不清楚.
尖晶石常规制备方法主要包括固相法和液相法.固相法[13]是将尖晶石相应的2种金属元素的硝酸盐、金属氧化物、氢氧化物等直接经球磨混合均匀,再高温焙烧得到尖晶石的方法,该方法简单、高效和绿色.液相法包括共沉淀法[14]、浸渍法[15]、溶胶-凝胶法[16]及水热法[17]等.液相法的原料主要为硝酸盐,通过添加沉淀剂或络合剂、旋蒸或离心除去溶剂、干燥、研磨和焙烧得到尖晶石.液相法虽然操作复杂,但使用不同的沉淀剂或络合剂制备得到的尖晶石具有不同的结构,表现出的催化性能也有所差别.Gao等[14,18]分别通过柠檬酸法、共沉淀法和固相法制得CuAl尖晶石,并将其用于甲醇-水蒸气重整反应.研究发现,固相法制得的CuAl尖晶石具有更大的比表面积、更小的晶粒尺寸,表现出最优的催化稳定性.
本文采用固相法、共沉淀法、柠檬酸法和溶胶-凝胶法制备了具有完整晶型的CuAl2O4尖晶石,将其直接加入到浆态床反应器中进行一氧化碳加氢反应,寻找CuAl2O4尖晶石在反应条件下结构的变化及其与催化性能的关联,为进一步阐明CuZnAl浆状催化剂中CuAl2O4尖晶石的作用奠定了基础.
1 实验部分
1.1 试 剂
Cu(NO3)2·3H2O、Al(NO3)3·9H2O、柠檬酸和无水乙醇(A.R.级,天津市科密欧化学试剂有限公司);氨水(A.R.级,国药集团化学试剂有限公司);异丙醇铝(A.R.级,纯度≥98%,阿拉丁试剂上海有限公司);拟薄水铝石(C.P.级,Al2O3含量93.5%,淄博诺达化工有限公司);氢氧化铜(C.P.级,含量94%,阿拉丁试剂上海有限公司).
1.2 CuAl2O4尖晶石的制备
1.2.1 固相法 称取Cu/Al 摩尔比为2∶1的氢氧化铜和拟薄水铝石并均匀混合,经球磨机(行星式)球磨6 h后放入马弗炉中于900 ℃焙烧3 h,升温速率为3 ℃/min.制得的尖晶石命名为So.
1.2.2 共沉淀法 配制浓度为0.53 mol/L的硝酸铜和1.06 mol/L硝酸铝水溶液各250 mL,磁力搅拌下混后均匀后升温至90 ℃,然后将500 mL浓度为2.12 mol/L的氨水溶液缓慢滴加至上述混合溶液中.待沉淀完全后用蒸馏水离心洗涤至上层清液呈无色,离心得到的固体于80 ℃干燥12 h,然后于900 ℃焙烧3 h,升温速率为3 ℃/min.制得的尖晶石命名为Co.
1.2.3 柠檬酸法 配制浓度为0.53 mol/L的硝酸铜水溶液和1.06 mol/L硝酸铝水溶液各100 mL,磁力搅拌下混合均匀后升温至70 ℃,然后将250 mL 浓度为1.98 mol/L 的柠檬酸溶液缓慢滴加至上述混合溶液中.待滴加完全后于室温放置1 h,再经旋转蒸发仪除去溶液中大部分水分后80 ℃干燥1 d,然后于900 ℃焙烧3 h,升温速率为3 ℃/min.制得的尖晶石命名为Ci.
1.2.4 溶胶-凝胶法 取0.2 mol的异丙醇铝溶于70 mL乙醇中,电动搅拌下升温至75 ℃回流1 h.然后将硝酸铜醇溶液(0.1 mol硝酸铜溶于35 mL乙醇中)泵入上述铝溶胶中并继续回流搅拌2 h,接下来升温至85 ℃,加入150 mL 蒸馏水敞口水解1 h,在80 ℃干燥24 h,于900 ℃焙烧3 h,升温速率为3 ℃/min.制得的尖晶石命名为Sg.
1.3 CuAl2O4尖晶石的表征
在浆态床反应器中反应后的尖晶石,首先采用石油醚为溶剂索氏提取4 d,以除去残留的液体石蜡,然后自然干燥进行表征.晶相结构使用DX-2700型X射线衍射仪(XRD,丹东方圆仪器有限公司)测定,仪器功率为40 kV×30 mA,CuKα射线(λ=0.154184 nm),扫描范围5°~85°,扫描速率8°/min,CuAl2O4尖晶石的晶粒大小由谢乐公式计算得到.织构参数使用QDS-30 型物理吸附仪(美国Quantachrome公司)测定,样品首先在200 ℃脱气4 h,然后用液氮保温,氮气为吸附质进行测定,比表面积由BET(Brunauer-Emmett-Teller)方法得到,最可几孔径和孔容由BJH(Barret-Joyner-Halenda)方法得到.扫描电子显微镜(SEM)图像表征用JSM-6010PLUS/LV型发射电子显微镜,在观察之前对样品进行喷金处理,使获得的图像有良好的分辨率.透射电子显微镜(TEM)图像通过JEM-2100型透射电子显微镜(日本JEOL公司)捕获,加速电压为300 kV,先将样品放置于乙醇中进行超声处理,然后沉积在Cu微网格上进行观察.氨气程序升温脱附-质谱(NH3-TPD-MS)测试在TP-5080型多功能吸附仪(天津先权仪器有限公司)上测定,将100 mg样品在He气吹扫下升温至280 ℃并维持30 min,降温至50 ℃后切换NH3气吸附30 min,再用He气吹扫50 min后以10 ℃/min的速率升温至800 ℃,用QIC-20型质谱仪(MS,英国Hiden 公司)检测脱附出的NH3信号.氢气程序升温还原(H2-TPR)测试在TP-5000 型多功能吸附仪(天津先权仪器有限公司)上测定,将50 mg样品在He气吹扫下升温至150 ℃并维持30 min,待温度降低至50 ℃后切换为5%H2-N2混合还原气,再以10 ℃/min 的速率升温至800 ℃,用热导检测器检测信号.采用X射线光电子能谱仪(XPS,美国ThermoFischer公司,ESCALAB 250Xi)进行XPS测试,分析室真空度为8×l0-10Pa,激发源采用AlKα射线(hv=1486.6 eV),工作电压为12.5 kV,灯丝电流为16 mA,并进行10 次左右循环的信号累加,通能(Passing-energy)为30 eV,步长为0.1 eV.以表面污染碳C1s峰(284.8 eV)作荷电效应矫正.
1.4 CuAl2O4尖晶石的活性评价
在浆态床装置上进行CuAl2O4尖晶石催化一氧化碳加氢反应的活性评价.将制得的CuAl2O4尖晶石直接均匀分散在300 mL 液体石蜡中(固含率为10%),然后置于500 mL 的高压反应釜内进行活性评价.反应条件如下:CuAl2O4尖晶石不进行预还原处理,合成气总流量为150 mL/min,其中H2/CO 的体积比为2.反应温度为280 ℃,压力4 MPa.所有活性评价数据均是在反应进行1 d后开始采集,反应连续评价6 d.气相产物中的H2,CO 和CO2热导用检测器(TCD,TDX-01,上海星铱色谱仪器科技有限公司)检测,烃类、未冷凝的醇类以及二甲醚用火焰离子化检测器(FID,HP-PLOT/Q,安捷伦科技有限公司)检测.液相产物24 h 冷凝收集一次,通过FID 检测器检测.CO 转化率(XCO,%)和产物选择性(Si,%)计算公式如下:

式中:XCO为CO 的转化率;Si为组分i的选择性;i为气相和液相产物中除CO 外的所有含C 化合物;n(CO)out(mol)为出口气体中CO的量;ni(g)(mol)是出口气体中i组分碳原子的摩尔数;ni(l)(mol)是液相中i组分碳原子的摩尔数.
2 结果与讨论
2.1 XRD和氮气物理吸附表征
图1(A)和(B)分别为所有催化剂反应前后的XRD谱图.反应前各催化剂,在2θ=31.29°,36.87°,44.84°,55.70°,59.40°,65.29°,74.18°和77.41°(PDF No.71-0967)处均出现明显的CuAl2O4尖晶石特征衍射峰,说明制得的CuAl2O4晶型完整.Ci和Sg样品中伴随有微弱的CuO衍射峰,这是由于CuAl2O4尖晶石是CuO和Al2O3在固-固相互作用下形成的,当生成的CuAl2O4尖晶石足够多或Al2O3含量较低时,CuAl2O4层会抑制CuO向Al2O3载体中扩散[19].同时由表1中不同CuAl2O4尖晶石催化剂反应前后的织构参数可见,CuAl2O4晶粒尺寸存在较大差别,4 种样品尖晶石的平均粒径大小顺序为Ci>Sg>Co>So.在反应后谱图[图1(B)]中,CuAl2O4的特征衍射峰消失,出现了Cu0和γ-Al2O3的衍射峰,表明CuAl2O4在一氧化碳加氢反应过程中被还原生成Cu0和γ-Al2O3[20].4种样品的Cu0衍射峰有明显差异:So样品的Cu0衍射峰强度最大且峰形尖锐;Ci和Sg样品的Cu0衍射峰强度减弱,峰形尖锐但有所宽化;Co样品的Cu0衍射峰强度大幅度减弱,峰形钝化.除此之外,So 样品还在2θ=36.52°,42.42°和61.55°处(PDF No.05-0667)出现了Cu2O特征衍射峰.

Fig.1 XRD patterns of different CuAl2O4 spinels before(A)and after(B)the reaction
由表1可知,So和Co样品具有高的比表面积和孔容,So样品具有最大的最可几孔径(30.3 nm),而Ci和Sg样品的比表面积和孔容极小.反应后,So和Co样品的各项织构参数没有明显变化,而Ci和Sg样品的比表面积和孔容明显增大,同时最可几孔径显著下降.

Table 1 Texture parameters of different CuAl2O4 spinels
2.2 SEM表征
图2 为不同CuAl2O4尖晶石的SEM 照片.从图中可以看到,So 样品颗粒分布密集,以小颗粒(<10 μm)为主,在颗粒间存在着少量团聚不紧密的絮状物[图2(A,A′)];Co样品颗粒分布稀疏,大颗粒变多(>10 μm),但颗粒间絮状物密集[图2(B,B′)];Ci 和Sg 样品绝大部分为表面光滑的大颗粒,颗粒间只有零星的絮状物[图2(C,C′)和(D,D′)].絮状物可能是少量的CuO或Al2O3,反应前So和Co样品的XRD谱图中没有观察到CuO和Al2O3的衍射峰,进一步说明体系中CuO和Al2O3高度分散或以无定形的状态存在.絮状物的存在使得So和Co样品具有较大的比表面积、孔容和孔径,而Ci和Sg样品反应后比表面积和孔容明显增大,正是由于反应前致密的CuAl2O4尖晶石结构分解引起的.

Fig.2 SEM images of different CuAl2O4 spinels before reaction with different magnifications
2.3 TEM表征
图3 为不同CuAl2O4尖晶石的TEM 照片.So 样品呈现出不规则片状堆积,在边缘处可以观察到少量单独存在的片状,其直径主要分布在20~30 nm之间[图3(A)];Co样品同样也是不规则片状堆积,但堆积更加密集,很难观察到单独的片状存在[图3(B)];Ci和Sg样品团聚明显,堆积成一整块,Ci样品可以观察到一定的层次感[图3(C)],而Sg样品几乎观察不到小块的片状结构[图3(D)].TEM观察到的形貌特征证实了4种样品团聚程度的差异,团聚程度从大到小依次为Sg>Ci>Co>So.
在高分辨透射电子显微镜(HRTEM)照片中,So[图3(A′)]和Co[图3(B′)]样品都明显出现了晶格间距为0.24和0.28 nm的晶格条纹,对应于尖晶石CuAl2O4的(311)面和(220)面[21].Ci[图3(C′)]和Sg[图3(D′)]样品中只发现了对应于尖晶石CuAl2O4(220)面的晶格条纹,没有发现CuAl2O4的(311)面,推测可能与它们的高度团聚有关.

Fig.3 TEM and HRTEM images of different CuAl2O4 spinels before reaction
2.4 NH3-TPD-MS表征
反应前催化剂的NH3-TPD-MS 表征几乎检测不到脱附峰.反应后所有催化剂均有2 个NH3脱附峰(图4),表明存在2种不同的酸性中心.低温185 ℃附近的脱附峰对应弱酸中心,高温520 ℃附近的脱附峰对应强酸中心.由此可见,CuAl2O4尖晶石在反应过程中还原分解生成的γ-Al2O3提供了酸性中心.

Fig.4 NH3-TPD-MS spectra of different CuAl2O4 spinels after reaction
2.5 H2-TPR表征
图5(A)为不同CuAl2O4尖晶石催化剂反应前的H2-TPR谱图.反应前出现3个还原峰,分别命名为α1(170~220 ℃),α2(230~280 ℃)和β(350~600 ℃).其中α1和α2的还原峰均可归属于CuO物种的还原,但是α1还原峰代表高分散CuO物种的还原,α2还原峰则代表晶粒尺寸大的CuO 物种的还原,β还原峰归属于CuAl2O4的还原[19,22].Co 样品只在区域α1有还原峰,说明CuO 分散性高.依据H2-TPR 谱图中H2消耗量可计算出CuAl2O4物种占所有铜物种的摩尔分数[CuAl2O4/(CuO+CuAl2O4)],So,Co,Ci 和Sg 样品分别为85.0%,81.6%,71.9%和80.7%,表明不同方法制备CuAl2O4的纯度有所差异,固相法最佳.
图5(B)为不同CuAl2O4尖晶石催化剂反应后的H2-TPR 谱图.CuAl2O4尖晶石的还原峰几乎消失不见,而在180 ℃附近铜的非尖晶石氧化物的还原峰面积明显增大,说明CuAl2O4尖晶石被分解还原.Agzamova 等[23]报道,CuAl2O4尖晶石在6 MPa,超过800 ℃的条件下能分解生成CuO和Al2O3.本实验条件下,由于反应气氛(CO+H2)的存在,使得CuAl2O4尖晶石在4 MPa,280 ℃就发生分解.对还原峰进行分峰拟合并结合反应后XRD谱图[图1(B)]和CuLMM谱图[图6(C)],可以将还原峰大致归属为3类:Ⅰ可归属于CuO物种的还原;Ⅱ可归属于高分散Cu2O物种的还原;Ⅲ可归属于Cu2O晶体的还原.Co,Ci和Sg样品反应后均出现了CuO和高分散Cu2O物种的还原峰,表明以上3种尖晶石分解产生的部分CuO不易被还原,CuO还原峰温度从高到低依次为Co>Ci>Sg;而So样品中没有出现CuO的还原峰,可见其分解产生的CuO完全被还原,同时发现So中出现了高分散Cu2O和晶体Cu2O的还原峰,这与反应后So样品的XRD谱图出现Cu2O衍射峰相吻合.

Fig.5 H2-TPR spectra of different CuAl2O4 spinels before(A)and after(B)the reaction
2.6 XPS表征
为了进一步探究催化剂在反应前后表面元素化学价态以及存在形式的变化,对催化剂进行了XPS表征,结果见图6和表2.反应前Cu2p[图6(A)]在结合能941~943 eV处有明显的伴峰,表明催化剂表面有Cu2+.对Cu2p3/2处的峰进行分峰拟合,发现结合能分别在934.8 和933.6 eV 附近出现2 个峰,其中高结合能的峰归属于CuAl2O4,低结合能的峰归属于CuO[24].通过面积比计算得到各样品表面CuAl2O4的摩尔分数,从大到小依次为So>Co>Ci>Sg(表2).通过对比反应前Cu2p3/2的XPS和H2-TPR结果可知,4 种样品表相CuAl2O4含量均有所降低,其中So,Co,Ci 和Sg 样品CuAl2O4表相摩尔分数依次减少8.4%,12.1%,16.9%和28.4%,相对应4 个样品中表相CuO 含量依次增大8.4%,12.1%,16.9%和28.4%.由此可见,不同的制备方法导致尖晶石和CuO表面富集能力不同.
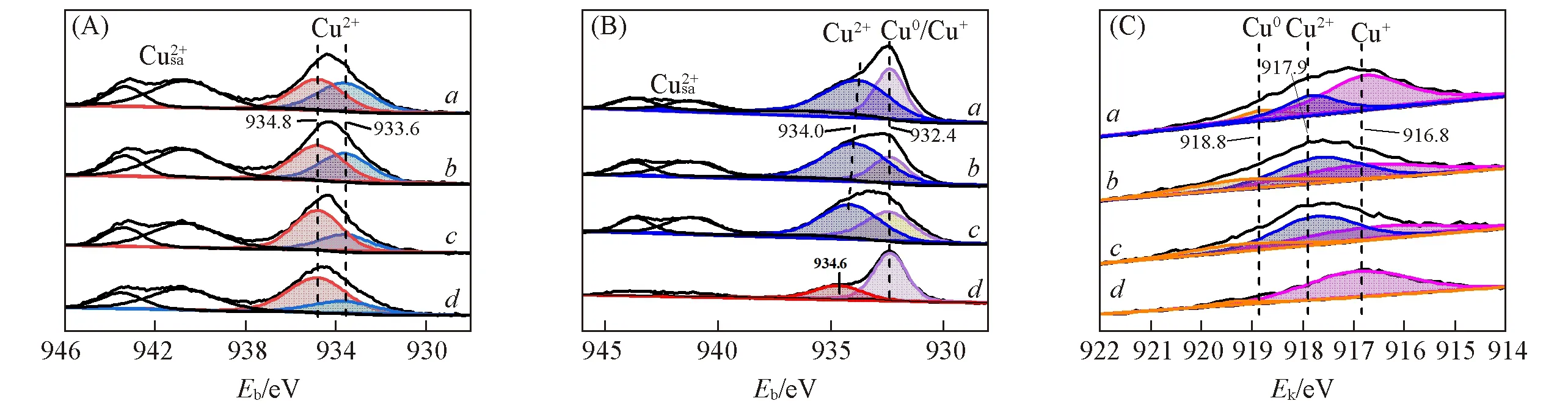
Fig.6 XPS spectra of different CuAl2O4 spinels before(A)and after(B,C)the reaction

Table 2 XPS analysis of different CuAl2O4 spinels
反应后[图6(B)]Cu2p伴峰强度减弱,同时Cu2p3/2峰向低结合能端移动.Co,Ci和Sg样品在结合能为932.4和934.0 eV附近出现2个峰.结合能为932.4 eV的峰可归属于Cu0或Cu+,由于Cu+和Cu0的Cu2p3/2结合能只相差了0.1 eV,需要通过CuLMM 来加以区分.对CuLMM[图6(C)]进行分峰拟合后,Co,Ci和Sg样品在俄歇动能为916.8,917.9和918.8 eV 附近均出现峰,可分别归属于Cu+,Cu2+和Cu0[4,25,26].结合能在934.0 eV附近的峰可归属于CuO的Cu2+,相比于反应前其结合能升高是由于尖晶石分解产生的CuO与γ-Al2O3之间有较强的相互作用.这3个样品中CuO物种结合能从高到低依次为Co>Ci>Sg,这与它们反应后在H2-TPR中CuO还原温度大小顺序一致,说明结合能越高,相互作用力越强,越难还原.与Co,Ci 和Sg 样品不同,虽然So 样品也在932.4 eV 附近出现Cu0或Cu+的峰,但是其CuLMM[图6(C)]分峰拟合后在916.8和918.8 eV 附近出现峰,没有在917.9 eV出现属于CuO的Cu2+动能峰,证明反应后So中不存在CuO,完全还原为Cu0或Cu+,这与前面的H2-TPR结论一致.值得注意的是,So样品在结合能为934.6 eV附近出现归属于CuAl2O4的峰,证明还有部分尖晶石没有完全分解.
进一步研究发现,CuAl2O4尖晶石分解和还原能力的不同直接影响反应后样品表面不同价态铜物种的含量(见表2).So样品中CuAl2O4尖晶石难于分解,在反应过程中逐步释放的CuO全部被还原,且还原为Cu+占比远高于Cu0,Cu+在表面富集导致了反应后尖晶石的结合能略微下降[4].而Co,Ci和Sg样品中的CuAl2O4尖晶石易于分解成为CuO,但是部分CuO 没有被还原,样品表面Cu+/Cu0比例明显低于So样品.
2.7 活性评价
图7为CuAl2O4尖晶石催化一氧化碳加氢反应的活性评价结果.从图7(A)中发现,So的CO转化率仅为10.6%,而其它3 个样品均表现出较高的CO 转化率,其中Co 的CO 转化率最高,达到59.1%.有研究者认为,Cu0物种在一氧化碳加氢反应中起到了吸附活化CO分子和解离H2的作用[7,27,28].通过表2可知,So 样品表面Cu0摩尔占比远小于其它3 种样品,导致其CO 转化率低.Burch 等[29]研究发现,Cu/ZnO催化剂催化合成气制甲醇反应的活性和Cu0分散度之间有良好的线性关系,分散度越高反应活性越大.结合反应后XRD表征分析,Co样品的Cu0衍射峰强度弱,半峰宽增大,说明其Cu0分散度明显优于其它样品,所以具有最高的CO转化率.

Fig.7 Activity evaluation results of CO hydrogenation over different CuAl2O4 spinels
4种CuAl2O4尖晶石催化剂的烃类产物符合ASF(Anderson-Schulz-Flory)分布.二甲醚(DME)选择性均达到了38%以上(不考虑CO2),Ci样品的DME选择性最高,达到72.9%.这是因为尖晶石在反应过程中分解还原产生的Cu0和γ-Al2O3存在着较强的相互作用,其中Cu0是合成气生成甲醇的活性位点,γ-Al2O3是一种常见的甲醇脱水活性组分,由于甲醇合成组分和甲醇脱水组分两者之间存在较强的相互作用,更有利于发挥协同作用生成DME.So催化剂CO转化率低,导致生成的甲醇量少,从而甲醇脱水反应的推动力小,DME选择性最低.结合前面的NH3-TPD-MS表征结果,没有发现DME选择性与强酸量、弱酸量以及二者比值之间存在规律性变化.目前,关于酸性和二甲醚选择性之间的关系存在不同的观点.Kim 等[30]认为强酸中心最多的H-ZSM5(30)作为甲醇脱水催化剂时,DME 选择性最高;Mao 等[31]研究发现HZSM-5 分子筛表面的弱酸位和中等强度酸位是甲醇脱水生成二甲醚的活性中心,强酸位是二甲醚进一步反应生成烃类的活性中心;Frusteri等[32]认为DME的生成既取决于催化剂的酸性,也取决于金属活性中心的浓度.结合本文研究结果,推测DME的选择性不仅与酸性和金属活性中心浓度有关,同时与CuAl2O4尖晶石分解生成的γ-Al2O3和CuO的相互作用强弱有关.
在图7(B)中,4种样品C2+OH占总醇比由大到小依次为So>Co>Ci>Sg.So样品C2+OH占总醇的比值达到了31.1%,其中仅乙醇就占到25.8%.结合表征分析,So样品在反应后表面可还原Cu+物种占比最高,据文献报道[7,33,34],Cu0和Cu+是合成C2+OH的双活性中心,发挥协同作用生成C2+OH.Ma等[35,36]和Tan等[37]认为Cu+物种通过极化C=O键促进了CHxO中C—O的断裂,增加了—CHx含量.Cu0活化生成的*CO 结合—CHx生成—CHxCO,最后加氢生成C2+OH.从图7(B)中发现,样品的DME 选择性越大,C2+OH占比越小.DME是甲醇在酸性位点上脱水生成的,而—CHxO是合成甲醇和C2+OH所需的共同中间体,所以DME和C2+OH存在竞争关系.
研究发现,Cu+/Cu0的比值是影响产物分布的关键因素之一,Cu+/Cu0占比高有利于C2+OH 的生成,Cu+/Cu0占比低有利于DME 的生成,而Cu+/Cu0的比值与尖晶石分解还原能力密切相关.Scheme 1 为CuAl2O4尖晶石的分解还原示意图.CuAl2O4尖晶石在4 MPa和280 ℃的反应条件下会分解生成具有相互作用的CuO 和γ-Al2O3,释放出来的CuO 在一氧化碳加氢气氛下发生不同程度的还原.难分解的CuAl2O4尖晶石释放的CuO 全部被还原,且更易还原生成Cu+,有利于C2+OH 生成(Path Ⅰ);容易分解的CuAl2O4尖晶石在反应过程中仍存在部分CuO 未被还原,且还原生成的Cu+含量减少,Cu0含量增多,并有助于Cu0与γ-Al2O3更好地发挥协同作用生成DME(Path Ⅱ).除了Cu+/Cu0比例,织构参数也对产物分布存在影响.Sg 和Ci 样品表面的Cu+/Cu0虽然区别明显,但是活性基本持平.从氮气吸附-脱附结果来看,两者反应后的孔径和孔容都比较小,小的孔径不利于原料气在催化剂孔道内扩散,小的孔容则增加了空间对反应产物大小的限制,不利于反应产物向长链碳的方向生成[9,38].由此可见,Cu-Al2O4尖晶石的孔容孔径和Cu+/Cu0共同作用影响了一氧化碳加氢的活性和选择性.

Scheme 1 Decomposition and reduction diagram of CuAl2O4 spinel
3 结 论
CuAl2O4尖晶石因其结构特殊,在使用前不经过预还原处理,在一氧化碳加氢反应过程中逐步释放活性组分.不同方法制得的催化剂不仅织构参数存在区别,而且表面CuAl2O4尖晶石富集程度不同,其分解和还原难易程度出现差异,两方面共同作用最终影响其催化性能.固相法制得的尖晶石表面富集最多,反应过程中难于分解,分解释放的CuO易被还原成为Cu+,同时具有较大的孔容和孔径,有利于C2+OH的生成,但CO转化率偏低.共沉淀法、柠檬酸法和溶胶-凝胶法制得的催化剂CuAl2O4尖晶石易于分解,但是还原后Cu+占比降低,Cu0占比提高,Cu0和γ-Al2O3发生协同作用提高了DME的选择性.
