朱砂叶螨各发育阶段内参基因评估及筛选
2021-06-29谢道燕江秀均杨振国柴建萍
倪 婧,谢道燕,江秀均,杨振国,柴建萍
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101)
荧光定量PCR技术(qRT-PCR)因定量准确、灵敏度高、重现性高等优点,成为基因表达差异检测、基因分型、甲基化检测、基因表达水平等研究中的重要技术手段,但该技术在操作过程中对样品RNA质量、纯度要求较高,为减少不同样品间提取的RNA质量、纯度、反转录效率等操作过程中的误差,在qRT-PCR试验中还需引入一个或几个表达稳定的内参基因作为参照物对表达结果进行校正和标准化处理[1,2],因而引入的内参基因在试验样品中的表达稳定性决定基因定量结果的准确性。
理想的内参基因应符合以下几个条件:在生物体内表达量适中;表达水平与生物体内细胞周期及细胞活化与否无关;在生物体内不同类型组织细胞、不同生长发育阶段表达量都相对恒定,无显著性差异;且不受任何内源性或外源性因素的影响,均能稳定表达。目前常用的内参基因有延伸因子1(elongation factor-1 alpha,ELFn)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、琥珀酸脱氢酶复合体A亚基(succinate dehydrogenase complex subunit A,SDHA)、α微管蛋白(tubulin alpha-1 chain,α-tubulin)、β-肌动蛋白(β-Actin)、5.8S核糖体RNA(5.8Sribosomal RNA,5.8SrRNA)等基因[3,4]。常用的内参基因虽然均能在生物体内稳定表达,但并非所有内参基因都完美的适用于任何生物体,因此在不同的生物样本及特定试验条件下,要得到准确的定量结果,科学筛选内参基因以最优选择匹配试验是非常必要的[5-7]。
朱砂叶螨是世界重大害螨之一,危害农林作物范围较广,对哒螨灵、乐果、阿维菌素、毒死蜱、甲氰菊酯、敌敌畏、辛硫磷等多种常用药剂产生了较高的抗药性。有研究表明,朱砂叶螨抗甲氰菊酯品系中最理想的内参基因为RPS18和5.8S rRNA基因组合,而在卵、幼螨、若螨和成螨4个不同螨态中则为RPS18和α-TUB基因组合[8,9]。二斑叶螨抗甲氰菊酯品系α-TUB基因最稳定[10],在抗季酮酸类品系中Ubiquitin和β-actin基因为最适内参基因[11],在抗阿维菌素品系中最佳内参基因为ELFn[2];柑橘全爪螨在不同药剂选择压力和外界胁迫下,最理想的内参基因组合为ELFn和GAPDH[12]。炔螨特曾被认为是安全、低毒、高效且不易产生抗药性的药剂,但在近年的研究中发现各地区各植物上的朱砂叶螨对炔螨特也表现出不同程度的抗药性,对炔螨特抗药性的相关分子机制研究需要用到荧光定量PCR技术,但对炔螨特抗药性的朱砂叶螨品系及各发育阶段的最佳内参基因无直接参考依据。本研究利用geNorm软件,对朱砂叶螨敏感品系及抗炔螨特品系各发育阶段中6个常用内参基因的表达稳定性进行评估,筛选出各品系、各发育阶段的最佳内参基因,为以后开展朱砂叶螨对炔螨特抗药性相关分子机制研究选择内参基因提供参考依据。
1 材料与方法
1.1 供试朱砂叶螨
朱砂叶螨敏感品系采自重庆市北碚区田间,在人工气候室内[(25±1)℃,60%~80%RH,L∶D=14 h∶10 h]持续用新栽无虫豇豆苗(Vigna sinensis)继代饲养多年,不喷施任何药剂,作为相对敏感品系。
朱砂叶螨抗炔螨特品系:从上述敏感品系中分离出部分朱砂叶螨作为起始材料,以炔螨特为选择药剂,在人工气候室内[(25±1)℃,60%~80%RH,L∶D=14 h∶10 h]喷施炔螨特,连续多代选育出对炔螨特有较强抗性的朱砂叶螨。
1.2 主要试剂盒
RNeasy Plus Micro Kit,PrimeScriptTMRT reagent Kit Perfect Real Time,SYBR®Premix Ex TaqTMII。
1.3 方法
1.3.1 朱砂叶螨敏感品系和抗炔螨特品系各发育阶段供试螨获取 参照叶碟法并加以改进饲养各发育阶段的朱砂叶螨,取7~10 cm的培养皿若干,把滤纸剪成直径6~8 cm大小的圆形纸碟,在培养皿内先铺上适当大小的脱脂棉,再把滤纸平铺在脱脂棉上,加清水至饱和,将新栽的无虫豇豆苗叶片剪成直径5.0 cm大小,背面朝上正面紧贴滤纸平铺,形成孤岛状,防止叶螨逃离。分别将敏感品系和抗炔螨特品系3~5日龄的活泼雌成螨用毛笔挑至叶蝶上,每个叶蝶接入40~50头雌成螨,置于(25±1)℃、RH 60%~80%、光照周期14L∶10D的光照培养箱内,产卵24 h后移除叶蝶上的雌成螨,依次收集不同发育阶段的螨。
卵的收集:产卵后待卵发育至3日龄时,用毛笔轻轻挑取约4 000粒卵于1.5 mL离心管中,用于RNA的提取。
幼螨的收集:部分卵留在叶蝶上继续孵化为黄白色,3对足幼螨,孵化后12 h内用毛笔挑取活动期的幼螨约2 500头至1.5 mL离心管中,用于RNA的提取。
若螨的收集:剩余幼螨继续在叶蝶上发育1 d成为4对足若螨(1龄若螨),用毛笔挑取约1 000头于1.5 mL离心管中,用于RNA的提取。
雌成螨的收集:剩余若螨再经过3 d发育为成螨(3日龄),用毛笔挑取约200头雌成螨于1.5 mL离心管中,用于RNA的提取。
1.3.2 实时荧光定量PCR内参基因引物设计 参照孙伟[9]和高新菊[10]设计的内参基因引物,其中6个常用的内参基因备选(表1)。

表1 朱砂叶螨内参基因qRT-PCR引物序列
1.3.3 朱砂叶螨两个品系各发育阶段总RNA提取及反转录 使用Qiagen公司RNeasy Plus Micro Kit试剂盒提取敏感品系和抗炔螨特品系卵、幼螨、若螨、雌成螨总RNA,并进行质量检测。使用TAKARA公司PrimeScriptTMRT reagent Kit Perfect Real Time试剂盒反转录RNA合成第一链cDNA。
1.3.4 内参基因引物熔解曲线分析及标准曲线建立 熔解曲线和标准曲线是判断设计合成的引物是否具有特异性及较高扩增效率的重要指标。
熔解曲线分析:以敏感品系雌成螨cDNA为模板,在实时荧光定量PCR仪中进行内参基因引物熔解曲线扩增,试验设3次技术重复,温度以0.5℃∕10 s的速度从60℃缓慢递增到95℃,连续测定样品的荧光强度以获取熔解曲线,熔解曲线为单峰且单峰前后无其他杂峰出现时对应的引物特异性强,无引物二聚体形成,无非特异性扩增。
标准曲线建立:以敏感品系雌成螨cDNA为模板,呈3倍梯度将模板稀释为4个浓度(30、3-1、3-2、3-3),将熔解曲线为单峰的内参基因引物在实时荧光定量PCR仪上进行试扩增,每个浓度梯度内设3个技术重复,对照为灭菌蒸馏水。结果以相对拷贝数为横坐标,Ct值为纵坐标建立相对定量标准曲线,当Ct值在15~30,斜率为-3.3±0.3,扩增效率在90%~110%,决定系数R2>0.99时,说明该引物扩增性较好,可用于后续试验。实时荧光定量PCR反应体系按照SYBR®Premix Ex TaqTMII试剂盒说明书在冰上配制。
1.3.5 内参基因实时荧光定量PCR检测 分别以朱砂叶螨敏感品系和抗炔螨特性品系的卵、幼螨、若螨和雌成螨cDNA为模板,进行实时荧光定量PCR检测,灭菌蒸馏水为对照。实时荧光定量PCR反应体系按照SYBR®Premix Ex TaqTM II试剂盒说明书在冰上配制。
1.3.6 内参基因稳定性评价 使用geNorm软件计算6个内参基因表达稳定度的平均值M,M值越小,该内参基因表达越稳定,再通过标准化因子配对差异分析(Vn∕n+)l来确定最适内参基因数目[13,14],ge-Norm软件以0.15为默认阈值,当Vn∕n+l<0.15时,说明没必要使用数量大于n+l个内参基因[15]。
2 结果与分析
2.1 朱砂叶螨两个品系各发育阶段总RNA纯度测定和质量检测
用微量核酸蛋白质浓度测定仪测定RNA浓度和纯度,结果显示(表2),所有提取的RNAOD260∕280在1.89~2.20,OD260∕230在1.95~2.31,说明提取的朱砂叶螨两个品系各发育阶段的RNA完整性好,可作为实时荧光定量PCR反应模板。
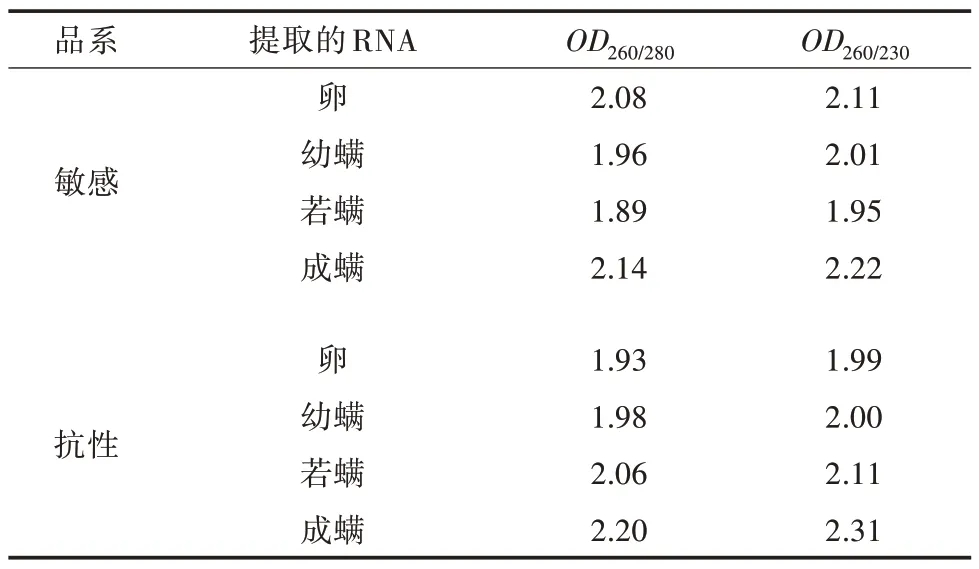
表2 各RNA纯度信息
对RNA进行琼脂糖凝胶电泳检测,结果显示(图1),28S与18S条带清晰,无拖带,且亮度比约为2∶1,5S条带较淡或几乎不见,说明RNA降解较少,质量好,可满足后续试验要求。

图1 朱砂叶螨不同品系和不同螨态总RNA电泳
2.2 内参基因引物熔解曲线及扩增效率分析
内参基因熔解曲线显示(图2),6个内参基因引物熔解曲线均为尖锐单峰,且单峰前后无其他杂峰,说明无非特异性扩增,无引物二聚体形成。标准曲线显示(表3,图3),6个内参基因重复性好,Ct值均在15~30,标准曲线方程斜率为-3.3±0.3,扩增效率为92.125%~96.588%,决定系数R2均大于0.99。以上检测结果说明合成的6个内参基因引物特异性好,符合荧光定量PCR要求。
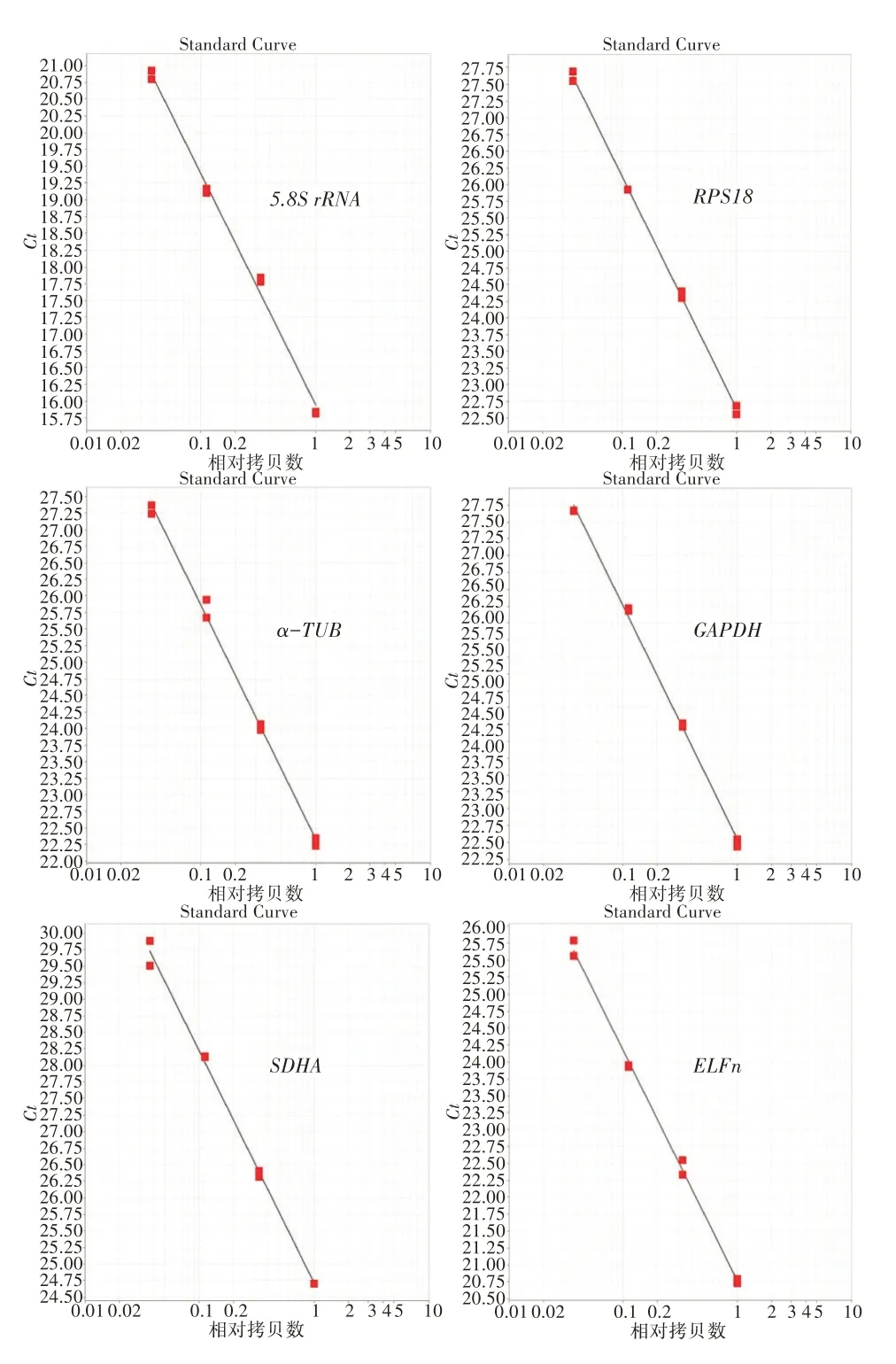
图3 朱砂叶螨内参基因qRT-PCR标准曲线

表3 朱砂叶螨内参基因qRT-PCR引物扩增效率

图2 朱砂叶螨内参基因qRT-PCR引物扩增产物的熔解曲线分析
2.3 内参基因稳定性评估
geNorm软件计算出两个品系6个候选内参基因表达稳定度为(表4,图4)RPS18>α-TUB>SDHA>5.8SrRNA>GAPDH>ELFn,软件评估结果显示,两个品系间RPS18与α-TUB内参基因组合表达稳定度较高;不同发育阶段6个候选内参基因表达稳定度为(表4,图5)α-TUB>GAPDH>RPS18>5.8S rRNA>SDHA>ELFn,软件评估结果显示不同发育阶段α-TUB与GAPDH内参基因组合表达稳定度较高。
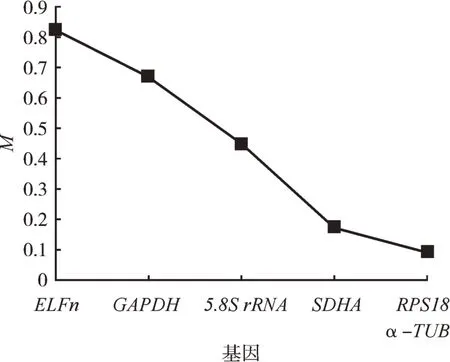
图4 朱砂叶螨两个品系候选内参基因稳定性
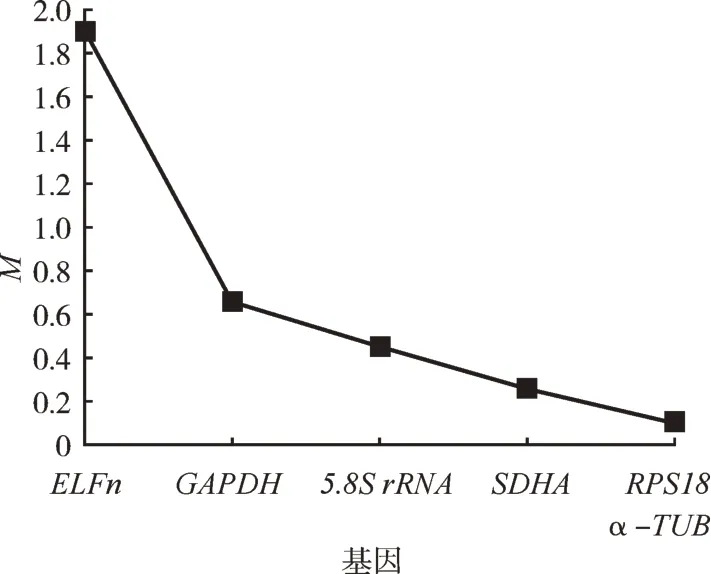
图5 朱砂叶螨不同螨态候选内参基因稳定性

表4 内参基因稳定性的评估结果
geNorm软件标准化因子配对差异分析(Vn∕n+)l得出的比值显示,两个品系中V2∕3=0.07(图6),不同发育阶段V2∕3=0.112(图7),均小于0.15的阈值,其余比值均大于0.15,说明没必要选择超过2个的内参基因参与试验,所以在两个品系及不同发育阶段不多于2个内参基因作为参照最适合。

图6 朱砂叶螨两个品系多内参参数P值
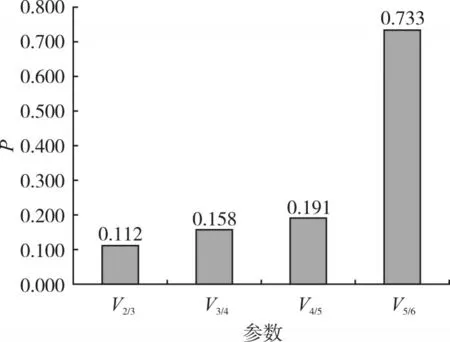
图7 朱砂叶螨不同螨态多内参参数P值
3 讨论
所有基因包括内参基因在生物体不同类型的组织、细胞、不同发育时期、不同试验条件下均存在表达差异,所以内参基因的选择并非一劳永逸的事,而是需要根据特定的生物样本及特定的试验条件进行选择。本试验通过geNorm软件筛选出朱砂叶螨敏感品系及抗炔螨特品系RPS18和α-TUB基因为最佳内参组合,在卵、幼螨、若螨、雌成螨4个发育阶段α-TUB和GAPDH基因为最佳内参组合,为后续研究朱砂叶螨对炔螨特抗药性分子机制等相关研究选择理想内参基因提供参考。
