地木耳乙醇提取物的抑菌机理及化妆品功效研究
2021-06-29汤云峰刘康欣陈雪茹金卫华唐红枫
孙 茜,张 赟,汤云峰,刘康欣,陈雪茹,金卫华,唐红枫,3
(1.湖北省疾病预防控制中心,武汉 430079;2.武汉东湖学院生命科学与化学学院,武汉 430212;3.武汉东湖学院生物医用材料创新研究所,武汉 430212)
地木耳(Nostoc communeVauch)又名地皮菜、天仙米、天仙菜、水木耳、地衣等,属于蓝藻纲念珠属植物,是念珠藻中的群体型,藻丝由50~170个营养细胞和异形胞组成[1]。地木耳广泛分布于中国各地,多生于潮湿的土壤表面和静水中,夏季雨后湿地上最常见,可固氮,也可食用。地皮菜藻体最初为球形,后生长为扁平状,常为有穿孔的膜状物或革状物,有时会出现不规则的卷曲,形似木耳,在潮湿环境中呈蓝色、橄榄色;失水干燥后藻体呈黄绿色或黄褐色。地木耳营养丰富,其中蛋白质、钙、铁、磷、维生素等含量很高,具有一定的医疗保健价值。中医认为,地木耳具有降脂明目、补虚益气、清热降火等作用[2]。由于地木耳含有海藻糖、鼠李糖、果胶多糖类、葡萄糖苷、胡萝卜素、藻蓝素以及胞外多糖等多种活性成分,所以地木耳还具有良好的抑菌、抗氧化、保湿、美白等多重功效。目前人们更多青睐的是以植物天然活性成分为原料,对人体安全无毒无副作用的化妆品、护肤品。因此,研究将从地木耳乙醇提取物抑菌机理及地木耳化妆品开发和功效测试进行探究。
1 材料与方法
1.1 材料
地木耳购于市场。试验菌种有大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillussabtilis)、金黄色葡萄球菌(Staphylococcusaureus)、绿脓杆菌(Pseudomonasaeruginosa)、白色念珠菌(Monilia albican)。
1.2 培养基
LB培养基(固体培养基加琼脂粉15~20 g):胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、水1 000 mL、自然pH,121℃高压蒸汽灭菌30 min,备用。
1.3 方法
1.3.1 地木耳乙醇提取物的制备 将新鲜的地木耳洗净,干燥粉碎;料液比1∶50用95%乙醇溶液在40℃条件下提取10 h,抽滤,收集滤液。旋转蒸发浓缩至2 g∕mL左右,用弱碱性树脂DEAE纤维素脱色,置于-4℃冰箱中保存备用[3]。
1.3.2 筛选最佳试验菌种 将保存良好的菌种活化3次,采用抑菌圈法[4]从5种供试菌中筛选最佳试验菌种,最终结果显示地木耳乙醇提取物对E.coli产生的抑菌圈最大,故后续试验均采用E.coli作为试验菌种。
1.3.3 最低抑制浓度(MIC)测定 用LB液体培养基将得到的地木耳乙醇提取物稀释2、4、8、16、32、64倍,分别向其中等量接种0.1 mLE.coli菌悬液,置于摇床中,37℃、170 r∕min培养过夜,各浓度分别做3组平行,培养后观察并判定是否长菌(其中浑浊表示显著长菌,澄清表示未长菌),确定最低抑制浓度(Minimal inhibitory concentration,MIC)[5]。
1.3.4 抑菌圈法测定抑菌效果 取50μLE.coli菌悬液涂布于LB固体平板中央。待LB固体平板将菌悬液吸收完全后,在平板中央分别贴上在稀释倍数为2、4、8、16、32倍的地木耳乙醇提取物中浸泡1 min的灭菌滤纸片,对照组贴无菌水浸泡1 min后的滤纸片。将平板于37℃恒温培养箱中培养过夜,每个浓度梯度做3个平行。测量抑菌圈大小,确定地木耳乙醇提取物对E.coli的抑菌能力[4]。
1.3.5 地木耳乙醇提取物对E.coli生长曲线的影响 接种大肠杆菌到LB液体培养基中,置于摇床在37℃、170 r∕min条件下培养,接种2 h后向试验组加入地木耳乙醇提取物(浓度由“1.3.3”的结果确定),对照组加等量无菌水,同时加入等量等浓度地木耳乙醇提取物于空白培养基以消除地木耳乙醇提取物对A600nm的影响。每隔一段时间使用分光光度计测定波长为600 nm时的吸光度(A600nm),绘制生长曲线。
1.3.6 上清液电导率的测定 试验组和对照组操作同“1.3.5”。每隔一段时间取菌悬液离心后的上清液测定电导率,制成电导率的变化曲线,确定地木耳乙醇提取物对E.coli电导率的影响。
1.3.7 上清液可溶性总糖的测定 试验组和对照组操作同“1.3.5”。每隔一段时间取菌悬液离心,采用苯酚-硫酸法[6]测其上清液可溶性总糖浓度,绘制上清液可溶性总糖浓度变化曲线,确定地木耳乙醇提取物中抑菌物质对菌悬液总糖含量的影响。
1.3.8 上清液总蛋白质的测定 试验组和对照组操作同“1.3.5”。每隔一段时间取菌悬液离心,采用考马斯亮蓝G-250法[7]测其上清液蛋白质含量,绘制上清液总蛋白质浓度变化曲线,确定地木耳乙醇提取物中抑菌物质对菌悬液总蛋白质含量的影响。
1.3.9 地木耳化妆品的制备
1)地木耳保湿精华水的制备。原料组分按重量份数计为地木耳乙醇提取物4.0~8.0,甘油9.0~12.0,十六醇6.5~9.0,白油0.5~1.0,三乙醇胺0.5~0.8,羊毛脂0.1~0.2,尼泊金丙酯0.1~0.15,去离子水90~100,香精0.1~0.3。将甘油和去离子水恒温水浴加热至85℃左右,再向其中加入十六醇、白油、三乙醇胺和羊毛脂,加热并搅拌至完全熔化。过滤并灭菌。溶液降至65℃左右时加入地木耳乙醇提取物和香精。温度降至45℃时加入尼泊金丙酯,搅拌均匀后静置,即得所需化妆品。
2)地木耳护肤霜的制备。原料组分按重量份数计为地木耳乙醇提取物4.0~8.0,去离子水70~80,甘油6.5~10,十六醇5.0~7.5,白油3.0~4.0,硬脂酸4.5~6.5,羊毛脂1.0~2.0,三乙醇胺0.3~0.6,香精0.1~0.3,尼泊金丙酯0.1~0.15。将硬脂酸、白油、羊毛脂、三乙醇胺和十六醇置于烧杯中,80~90℃水浴加热并搅拌至完全熔化,然后加入去离子水和甘油,充分搅拌后于45℃左右保温20 min。过滤并灭菌。于温度降至65℃左右时加入地木耳乙醇提取物和香精。温度降至45℃左右时再加入尼泊金丙酯,搅拌均匀后静置,即得到所需化妆品。
3)地木耳湿纸巾型面膜的制备。原料组分按重量份数计为地木耳乙醇提取物8.0~10.0,甘油6.0~7.0,十六醇5.5~7.0,羊毛脂2.5~3.0,白油0.5~1.0,无水乙醇2.0~3.0,三乙醇胺0.5~0.6,去离子水100~110,尼泊金丙酯0.1~0.15,香精0.1~0.3。将羊毛脂、十六醇、白油三乙醇胺在80~90℃下加热搅拌至完全熔化,然后加入去离子水和甘油,45℃水浴保温20 min。过滤并灭菌。于温度降至65℃左右时加入地木耳乙醇提取物和香精,继续搅拌并加入尼泊金丙酯和无水乙醇,静置,得到面膜液。将洁净无菌的市售面膜纸浸润于面膜液中,即得到所需化妆品[8,9]。
1.3.10 地木耳化妆品的性能测试
1)地木耳化妆品感官测试及pH测试。直接用目测法观察化妆品色泽、气味及膏体黏稠度、涂展性等性质;使用pH计测定pH。
2)地木耳化妆品稳定性测试。各取2份5 mL地木耳保湿精华水、5 g地木耳滋润霜、5 mL面膜液。
耐热试验:将3种化妆品中的试验组样品置于40℃电热恒温培养箱内,保温24 h后取出,恢复室温后与置于室温下24 h的对照组样品进行比较,观察其是否有浮油、变色、变稀、分层及硬度变化等现象发生。
耐寒试验:将3种化妆品中的试验组样品置于-20℃电冰箱内,保持24 h后取出,待样品恢复室温后与置于室温下24 h的对照组样品进行比较,观察其是否有浮油、变色、变稀、分层及硬度变化等现象发生。
冷热交替循环试验:将3种化妆品中的试验组样品置于40℃电热恒温培养箱内24 h,取出在室温下放置24 h,再置于-20℃冰箱中冷冻24 h。此步骤循环3次,最后与另1份置于室温下的对照组样品进行比较,观察其是否有浮油、变色、变稀、分层及硬度变化等现象发生。
离心试验:将3种化妆品中的试验组样品置于离心机中,2 000~4 000 r∕min离心30 min后,取出与另1份置于室温下的对照组样品进行比较,观察其是否有浮油、变色、变稀、分层等现象发生[10]。
3)地木耳化妆品安全性测试——斑贴试验。选择18~60岁符合试验要求的健康志愿者30名作为受试对象。选用市售合格斑试材料,将受试化妆品样品放入斑试器内,固体用量为0.03 g,液体用量为0.03 mL。空白对照孔不添加任何物质。将斑试器(加有受试化妆品样品)贴敷于受试者受试区域(前臂曲侧或背部)保持24 h。除去斑试器后,分别间隔30 min、24 h、48 h观察受试者皮肤反应[11]。
4)美白功效测试——酪氨酸酶抑制测试。黑色素合成途径中的重要限速酶是酪氨酸酶,该酶通过影响酪氨酸转化为多巴,多巴氧化为多巴醌来影响黑色素的生成[12]。参照文献[13,14],通过测定化妆品对酪氨酸酶的抑制作用来测试其美白功效。
5)保湿功效测试。健康的皮肤角质层应水分充足,皮肤水分充足可以增强皮肤弹性,减少皱纹生成和色素沉着。选好受试部位(所有志愿者受试部位相同)并做好标记。直接使用皮肤含水量测定仪测量标记区域的含水量,记录数据。前3块区域分别涂抹保湿水、护肤霜、面膜液[(2.0±0.1)mg∕cm2],第4块区域为空白对照。10 min后使用皮肤含水量测定仪进行测量,每个区域依照平行测定3次(时间分别为涂抹前、涂抹后10 min、涂抹后1 h),记录数据[15-17]。
2 结果与分析
2.1 最低抑制浓度(MIC)的确定
由表1可知,当稀释倍数在8倍及以下时,均未长菌,说明稀释8倍及以下时均有明显的抑菌作用。故可确定地木耳乙醇提取物对E.coli的最低抑制浓度(MIC)为8倍,即药物浓度为0.25 g∕mL。此结果为后续测定培养液电导率、总糖、可溶性蛋白质提供了试验基础。

表1 地木耳乙醇提取物对E.coli的最低抑制浓度试验
2.2 抑菌圈试验测定地木耳乙醇提取物的抑菌能力
由表2可知,当地木耳乙醇提取物稀释8倍及以内时均出现了明显的抑菌圈,且在稀释倍数为2、4、8倍时,抑菌圈直径呈直线下降,说明滤纸片中的抑菌物质与稀释浓度呈正相关。当稀释倍数为16倍时,有2组试验中未出现抑菌圈,表明在该稀释倍数下滤纸片中的抑菌物质的含量不足以抑制E.coli的生长和繁殖。此结果可与最低抑制浓度(MIC)的测定试验相互印证。
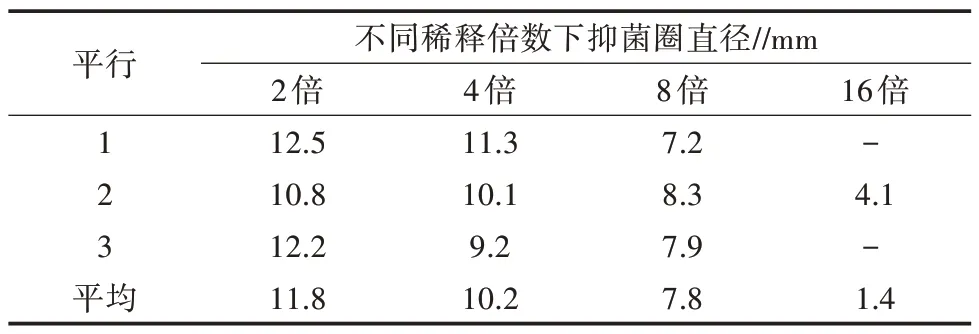
表2 地木耳乙醇提取物对E.coli的抑菌圈直径
2.3 地木耳乙醇提取物对E.coli生长曲线的影响
E.coli在接种2 h后开始进入对数生长期,对数生长期的E.coli菌体活性较高。较高的代谢水平有利于抑菌物质及时作用于菌体,故选定在接种2 h后向LB液体培养基中加入地木耳乙醇提取物,以测试各项指标,研究地木耳乙醇提取物对E.coli的抑菌机理。
由图1可知,当向菌悬液中加入地木耳乙醇提取物后(2 h),试验组E.coli繁殖基本停止,地木耳乙醇提取物加入2 h内有部分菌体死亡导致菌悬液浓度降低,即地木耳乙醇提取物可影响E.coli的正常生长。同时对照组E.coli生长状态良好,繁殖速度快,进一步证明试验组E.coli的生长停滞是由此试验的惟一变量因素导致的。

图1 地木耳乙醇提取物对E.coli生长的影响
2.4 地木耳乙醇提取物对E.coli液体培养基上清液电导率的影响
细胞膜能维持细胞内环境稳定。当细胞膜被破坏时,细胞质中大量电解质将进入到液体培养基中,导致培养基的电导率上升。此时,可通过测定培养物上清液电导率来反映细菌细胞膜渗透性的变化情况[18-20]。
由图2可知,当向菌悬液中加入地木耳乙醇提取物后,LB液体培养基上清液电导率开始升高,且随着地木耳乙醇提取物对E.coli作用时间的延长而持续升高,这说明加入地木耳乙醇提取物后E.coli细胞膜被破坏而发生胞质渗漏,且发生胞质渗漏的速度不断加快。加入地木耳乙醇提取物4 h后,试验组上清液的电导率达到最大值,说明此时已经导致大部分菌体细胞破损,地木耳乙醇提取物能在短时间内破坏E.coli细胞壁,达到抑菌的目的。

图2 地木耳乙醇提取物对E.coli培养液电导率影响
2.5 地木耳乙醇提取物对E.coli液体培养基上清液可溶性总糖含量的影响
E.coli会储备糖类作为能源储备物质,当其膜结构完整性遭到破坏时,细胞内的物质(如糖类等)会进入培养基中,导致培养基中可溶性总糖浓度上升。可通过观测培养物上清液中可溶性总糖浓度的变化,间接反映细菌膜结构的完整性[21,22]。
由图3可知,在加入地木耳乙醇提取物之后,E.coli培养物上清液中的可溶性总糖浓度开始升高,说明加入地木耳乙醇提取物后部分细胞开始渗漏出糖类进入培养基。在加入地木耳乙醇提取物4 h左右,E.coli培养物上清液中可溶性总糖浓度达到最大值,说明此时大部分E.coli细胞膜遭到破坏,菌体内容物逐渐渗漏到胞外。同时对照组培养物中可溶性总糖浓度因E.coli的正常生长繁殖消耗而逐渐降低。此结果与上述试验中电导率的结果一致。

图3 地木耳乙醇提取物处理后E.coli培养液中可溶性总糖含量的变化
2.6 地木耳乙醇提取物对E.coli液体培养基上清液蛋白质含量的影响
由图4可知,在加入地木耳乙醇提取物后,E.coli培养物上清液中的可溶性蛋白质含量开始显著升高,说明加入地木耳乙醇提取物导致部分细胞的细胞膜遭到破坏从而使蛋白质流出[23]。同时对照组因为E.coli的正常生长繁殖消耗导致培养基中蛋白质含量有所降低。

图4 地木耳乙醇提取物处理后E.coli培养液中蛋白质含量的变化
2.7 地木耳化妆品的性质测试
2.7.1 感官测试及pH的测定结果 通过对地木耳化妆品的感官测试和pH测定,发现制备的化妆品均符合国家化妆品标准,具体结果见表3。

表3 感官测试及p H的测定结果
2.7.2 稳定性测试结果 通过稳定性测试,发现制备的化妆品的稳定性均表现良好,在改变温度以及离心的条件下,其性能均可保持稳定(表4)。

表4 地木耳化妆品的稳定性测试结果
2.7.3 安全性测试结果 斑贴试验结果表明,未出现红斑、水肿、丘疹、水疱等不良反应,也未出现过敏反应。在使用地木耳化妆品时,觉得涂抹部位滋润清凉舒适。由此可以初步判断地木耳化妆品对人体皮肤没有危害,无毒副作用。
2.7.4 地木耳化妆品功效测试
1)美白功效。从测试结果来看,地木耳化妆品对酪氨酸酶活性均有一定抑制作用,其中地木耳湿纸巾型面膜对酪氨酸酶的抑制作用最好(图5)。若长期使用此类护肤品可以达到一定的美白效果。
2)保湿功效。由表5可知,每个地木耳化妆品涂敷的部分含水量远高于空白对照部分,说明地木耳化妆品能有效补充皮肤流失的水分,保持肌肤弹性。涂敷1 h后,试验组皮肤含水量仍高于空白对照组,可使皮肤长期处于水分充足的状态,预防皮肤皲裂。

表5 保湿试验结果 (单位:%)
3 结论
地木耳乙醇提取物有良好的抑菌性,对E.coli的最低抑制浓度(MIC)为0.25 g∕mL。E.coli在经过地木耳乙醇提取物处理后会发生胞质渗漏,发挥作用速度较快,且随着作用时间的延长胞质渗漏现象越来越明显,在加入地木耳乙醇提取物4 h后大部分菌体细胞膜破损,能在短时间内达到抑菌的目的。
所制备的地木耳化妆品的感官评价和pH均符合国家化妆品标准,并在改变温度和离心的情况下均表现出了良好的稳定性。
地木耳化妆品对皮肤无刺激也无过敏反应,安全无毒副作用,其对酪氨酸酶也具有一定的抑制作用,还能提高皮肤含水量且失水率小,体现了其美白功效和保湿功效。
地木耳是一种含有多种营养成分并具有良好抑菌效果的天然植物,有较高的药用价值。地木耳化妆品具有滋润、美白、保湿等多重护肤功效。如今,人们越来越青睐于绿色环保、天然健康的化妆品[24],地木耳化妆品很符合人们的需求。在实际生产应用中,地木耳活性成分提取方式简单,易于掌握,未来在食品、药品、化妆品等领域具有广阔的开发前景和应用价值。
