红毛藻多糖的提取工艺优化及其抗氧化活性
2021-06-29吴云辉阎光宇张怡评晋文慧
吴云辉,阎光宇,余 蕾,张怡评,杨 婷,晋文慧
(1.厦门海洋职业技术学院,海洋生物学院,福建 厦门 361100; 2.自然资源部第三海洋研究所,海洋生物资源开发利用工程技术创新中心,福建 厦门 361005; 3.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361005)
红毛藻(Bangiafusco-purpurea)俗称红发菜、牛毛藻、牛毛海苔,属红藻门(Rhodophyta)、原红藻纲(Florideophyceae)、红毛菜目(Bangiales)、红毛菜科(Bangiaceae)、红毛菜属(Bangiaatropurpurea)植物。红毛藻主产于莆田湄洲、南日岛一带海域,颜色褐红,细如毛发,含有丰富的钙质和各种维生素,年产量约为80~100 t(干重)。目前主要作为食品原料销售,每吨红毛藻的价格为(10~30)×104元,然而,关于红毛藻精深加工产品尚未见到[1]。近年来,研究发现红毛藻中含有丰富的多糖类成分,这种成分具有降血压、降血脂、防止动脉粥样硬化等多种生物活性[1-2]。海藻多糖的提取及活性研究一直是藻类资源研究与开发的热点,但由于红毛藻价格较高,关于红毛藻多糖的提取工艺及开发应用的研究报道较少。本文对红毛藻多糖提取工艺中的料液比、温度、时间三个因素进行单因素实验考察,并通过正交实验优选最佳提取工艺,试制样品,而后对其体外抗氧化活性进行评价,以期为红毛藻多糖的进一步开发应用提供依据。
1 材料与方法
1.1 材料与试剂
干红毛藻,购自福建莆田南日镇。
1,1-二苯基-2-三硝基苯肼(DPPH),分析纯,Sigma公司;葡萄糖、浓硫酸、苯酚、乙醇、水杨酸、双氧水、七水硫酸亚铁等试剂均为分析纯,中国医药集团。
1.2 仪器
UH5300紫外-可见分光光度计,日本HITACHI公司;H1650-V离心机,湖南湘仪实验仪器开发有限公司;SQP电子天平,赛多利斯科学仪器(北京)有限公司;QL-901漩涡混合器,海门市其林贝尔仪器制造有限公司;HH-ZK2恒温水浴锅,巩义市予华仪器有限公司;DHG-9030A电热鼓风干燥箱,上海精宏实验设备有限公司;DFT-200粉碎机,温岭市林大机械有限公司。
1.3 方法
1.3.1 多糖含量测定方法
精密称量葡萄糖,用水配制成0.1 mg/mL标准溶液,分别取0、0.2、0.4、0.6、0.8、1.0 mL标准溶液置于20 mL具塞试管,加水至1.0 mL,配成 0、0.02、0.04、0.06、0.08、0.10 mg/mL系列葡萄糖标准溶液,再依次加入1.0 mL 5%苯酚水溶液(g/W)和5 mL浓硫酸,每个样品加水补足至总体积10 mL,涡旋混匀后于30℃水浴反应20 min,之后在 490 nm 测定吸光度[2],以吸光度为纵坐标、葡萄糖浓度为横坐标绘制标准曲线。
1.3.2 红毛藻多糖提取
将干燥的红毛藻用粉碎机粉碎,过筛(40目)。称取红毛藻粉末1.0 g,置于100 mL三角烧瓶中,按照料液比1∶40(W/V)加入40 mL蒸馏水后,于80℃水浴加热提取2.0 h,纱布过滤,离心取上清液,量取滤液体积并测定吸光度以计算红毛藻多糖提取量。
1.3.3 提取液中多糖含量的测定
取红毛藻多糖提取液0.5 mL,按照1.3.1方法依次加入1.0 mL 5%苯酚水溶液(g/V)和5 mL浓硫酸,加水补足至10 mL,涡旋混匀,于30℃水浴反应20 min后,在490 nm 测定吸光度[3],代入葡萄糖标准曲线,求算提取液浓度,并计算提取液中红毛藻多糖提取量。
多糖提取量(mg/g)=M1×V1/M2
(1)
式(1)中,M1:从标准曲线上计算出样品溶液的含量(mg/mL);M2:取样量(g);V1:样品定容体积(mL)。
1.3.4 红毛藻多糖提取单因素实验
以料液比、提取温度、提取时间作为考察因素,以红毛藻多糖提取量为指标进行单因素实验。
1)考察料液比对红毛藻多糖提取量的影响
精密称取1.0 g红毛藻粉末12份,每个条件平行3份,按照料液比1∶30、1∶40、1∶50 和 1∶60(W/V),分别依次加入 30、40、50、60 mL的蒸馏水,在80℃水浴条件下提取2.0 h,按照1.3.1方法每组平行测定3次。
2)考察提取时间对红毛藻多糖提取量的影响
精密称取 1.0 g红毛藻粉末12份,每个条件平行3份,分别加入40 mL(料液比1∶40)蒸馏水,于80℃水浴条件下提取,再分别于0.5、1.0、1.5、2.0 h时停止提取,离心取上清液,按照1.3.1方法每组平行测定3次。
3)考察提取温度对红毛藻多糖提取量的影响
精密称取 1.0 g 红毛藻粉末12份,每个条件平行3份,分别加入 40 mL(料液比1∶40)蒸馏水,并分别于70、80、90、100℃下提取1.5 h,离心取上清液,按照1.3.1方法每组平行测定3次。
1.3.5 红毛藻多糖提取工艺优化
在单因素实验的基础上,以红毛藻多糖提取量为考察指标,以提取温度、提取时间、料液比为因子进行L9(34)正交实验,以确定红毛藻多糖的最佳提取工艺。

表1 正交实验因素水平表
1.3.6 提取工艺验证
为验证建立的最佳提取工艺,本实验进行3次平行实验。称取1.0 g红毛藻3份,按照建立的最佳提取工艺进行提取,并按照1.3.1方法平行测定3次。
1.3.7 红毛藻多糖的抗氧化活性实验
1)红毛藻多糖清除DPPH自由基的能力测定
分别用5支7 mL离心管移取0.04 mg/mL DPPH-乙醇溶液1.5 mL,再依次加入0.2、0.4、0.6、0.8、1.0 mL红毛藻多糖溶液(浓度为2 mg/mL),并用水补足至3.0 mL,静置30 min后在517 nm处测定溶液吸光度,计算红毛藻多糖对DPPH自由基的清除率[4-5]。
清除率(%)=[1-(A1-A2)/A0]×100
(2)
式(2)中,A0为未加红毛藻多糖溶液DPPH溶液的吸光度;A1为加红毛藻多糖溶液后DPPH溶液的吸光度;A2为红毛藻多糖溶液的吸光度。
2)红毛藻多糖清除羟基自由基的能力测定
分别向5支离心管加入0.2、0.4、0.6、0.8、1.0 mL红毛藻多糖溶液(浓度为5 mg/mL),用蒸馏水补足至1.0 mL,然后每支离心管分别加入0.3 mL 6 mmol/L FeSO4、1.5 mL 6 mmol/L水杨酸,摇匀,最后加入30% H2O2启动反应,静置10 min后在510 nm处测定吸光度,计算红毛藻多糖对羟基自由基的清除率[6-7]。
清除率(%)=(A0-A1+A2)/A0×100
(3)
式(3)中,A0为未加红毛藻多糖溶液时羟基溶液的吸光度;A1为加红毛藻多糖溶液后羟基溶液的吸光度;A2为红毛藻多糖溶液的吸光度。
2 结果
2.1 多糖标准曲线测定
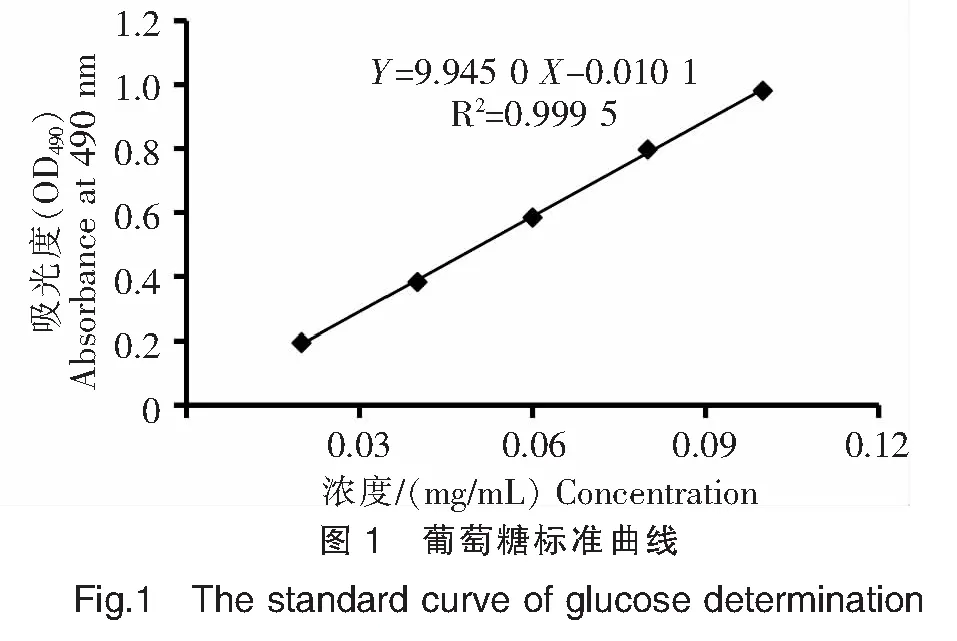
根据1.3.1方法得到回归曲线方程,如图1所示,Y=9.945 0X-0.010 1(Y为吸光值,X为葡萄糖浓度),相关系数R2=0.999 5。
2.2 红毛藻多糖提取单因素实验
2.2.1 料液比对红毛藻多糖提取量的影响
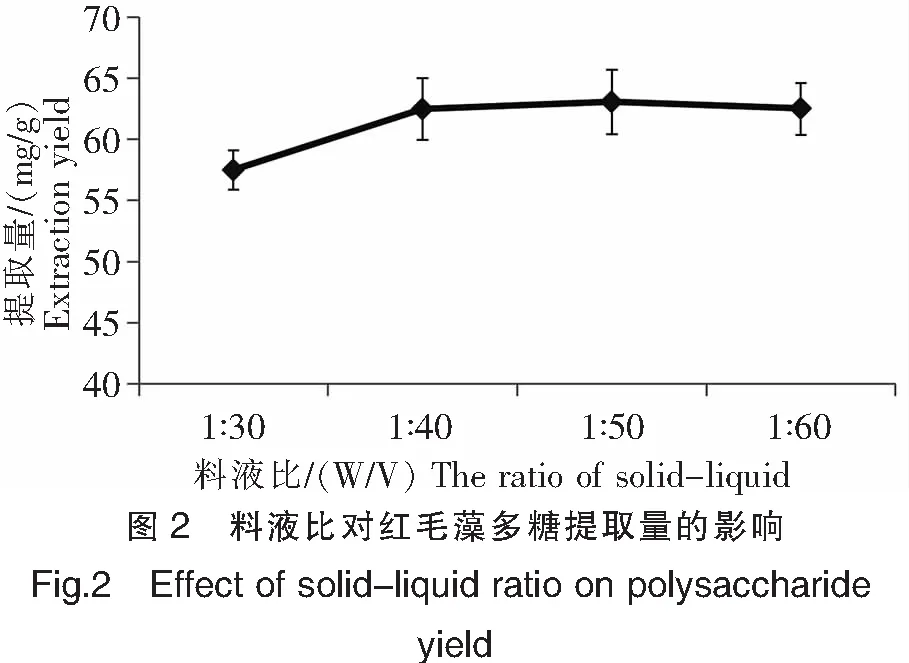
在水浴温度80℃、提取时间2.0 h的条件下,分别以料液比1∶30、1∶40、1∶50 和 1∶60(W/V)提取红毛藻多糖,结果如图2所示。由图2可知,当料液比从1∶30到1∶50,红毛藻多糖的提取量呈上升趋势,以1∶30到1∶40上升的趋势较大,之后上升趋势较慢,基本上趋于平衡状态。这主要是因为随着料液比的增加,溶解的多糖也增多,且在一定范围内增加提取液的体积可以增大溶剂与提取物的接触面积,使水溶性的多糖能够较多地溶出,于是产生了随水量增加而多糖提取量升高的现象,但是当料液比增加到可以溶解所有能被提取出的多糖时,继续增加水量,所溶解的多糖也不会再增加,出现了继续加水而多糖提取量趋于平稳的现象。考虑后续多糖提取液浓缩干燥等能耗因素,料液比以1∶40为最佳。
2.2.2 提取时间对红毛藻多糖提取量的影响
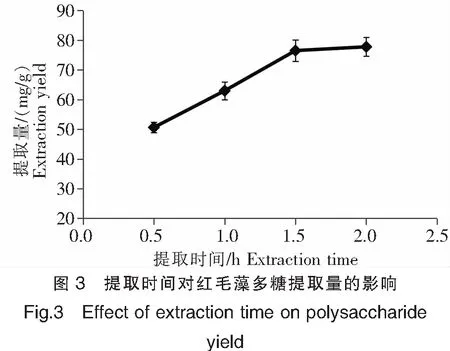
在水浴温度80℃、料液比1∶40的条件下,分别于0.5、1.0、1.5、2.0 h时停止提取红毛藻多糖,结果如图3所示。由图3可以看出,随着提取时间的延长,多糖提取量在0.5 h到1.5 h逐渐增加,但在1.5 h 到2.0 h过程中,多糖的提取量基本不增加。这可能是因为在提取初期,多糖能够被不断提取出来,但是随着时间延长,多糖提取量逐渐升高而不再有明显的变化,所以尽管时间延长也无法再提高多糖提取量。同时,也有可能是加热过久导致部分多糖降解被破坏,从而导致提取量稍微下降。因此,提取时间选择1.5 h 为最佳。
2.2.3 提取温度对红毛藻多糖提取量的影响
在料液比1∶40、提取时间1.5 h的条件下,分别于70、80、90、100℃下提取红毛藻多糖,结果如图4所示。由图4可知,随着提取温度的升高, 多糖含量逐渐增大, 在90℃后多糖含量略微减少。这是因为多糖的溶解度随着温度的升高而升高,使得在一定范围内多糖提取量随温度升高而升高,但是当温度继续升高时,由于多糖的热不稳定性导致其发生分解,且温度过高会消耗能量,多糖提取量呈下降趋势。考虑到经济成本和防止多糖在高温下遭受破坏,提取温度不宜过高,选择最佳提取温度为90℃。

2.3 红毛藻多糖提取工艺优化
在单因素实验的基础上,以红毛藻多糖提取量为考察指标,以提取温度、提取时间、料液比为因子进行L9(34)正交实验,以确定红毛藻多糖的最佳提取工艺,正交实验结果见表2、表3。
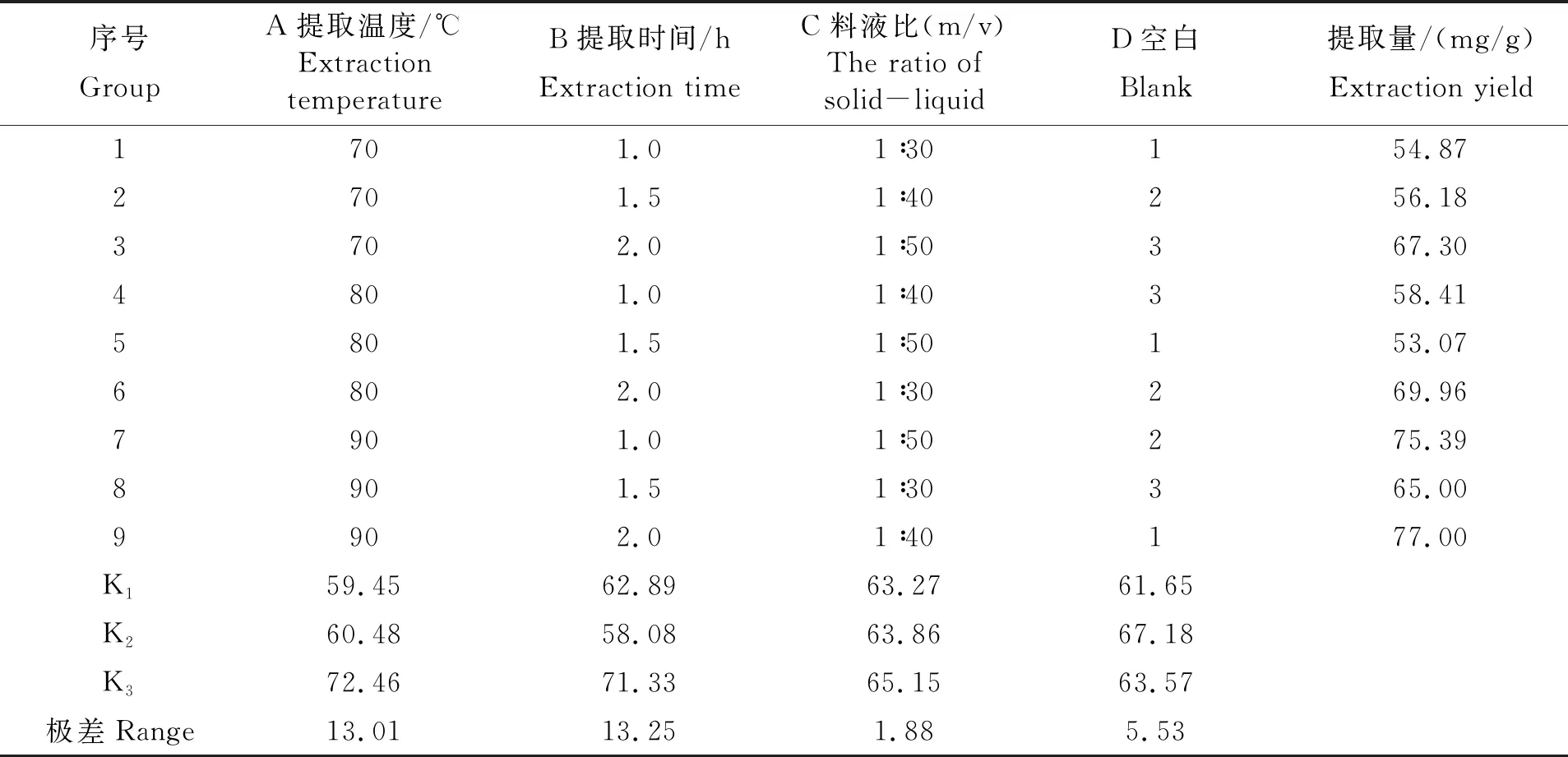
表2 L9(34)正交实验结果
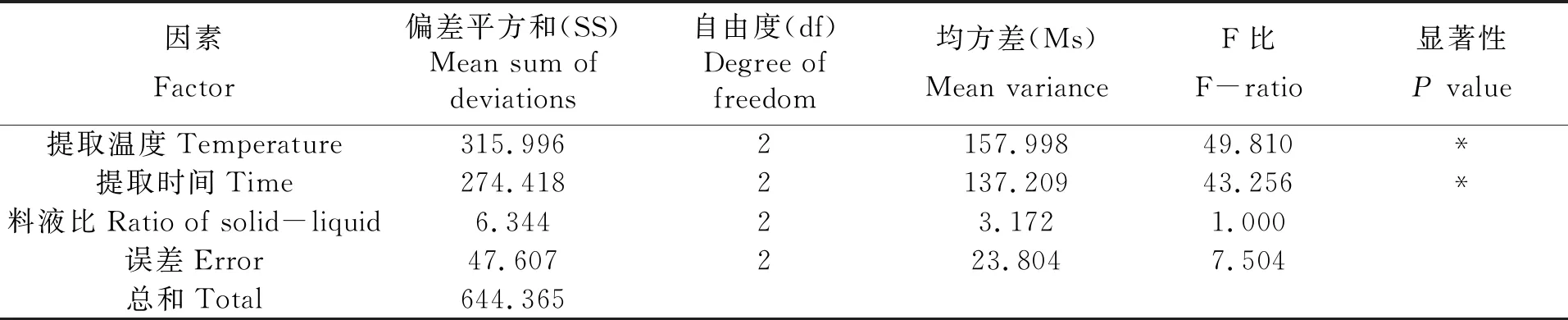
表3 正交实验方差分析表
由表2正交实验结果直观分析可得,提取温度和提取时间对红毛藻多糖的提取量影响较显著,而料液比对红毛藻多糖的提取量影响最小。通过优化的最佳提取工艺为A3B3C2,即以料液比为1∶40、在90℃下提取2.0 h为最佳提取工艺。通过表3正交实验方差分析结果进一步表明,提取温度与提取时间对红毛藻多糖的提取量起主要作用。
2.4 提取工艺验证
从表4提取工艺验证实验结果可知,3份样品的红毛藻多糖的平均提取量为77.57 mg/g,RSD为2.80%,表明所建立的红毛藻多糖提取工艺稳定可行。
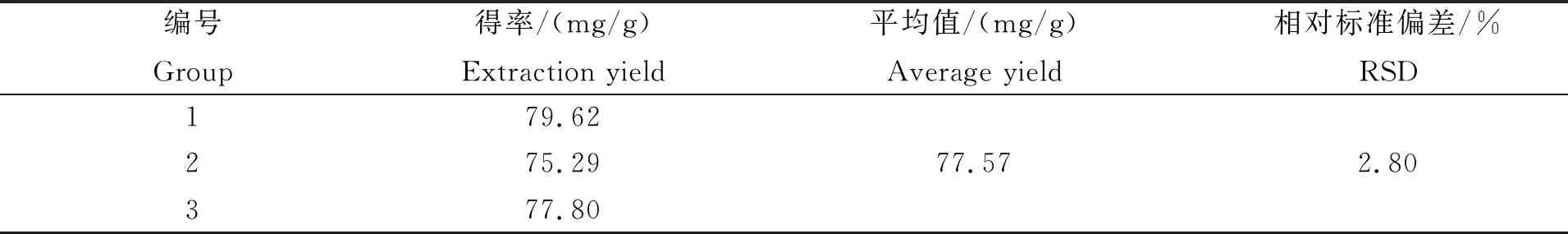
表4 验证实验
2.5 红毛藻多糖的抗氧化活性实验
2.5.1 红毛藻多糖清除DPPH自由基的能力测定
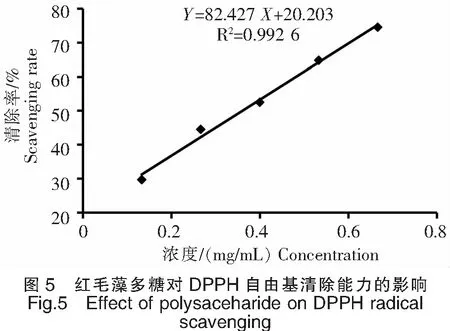
由实验结果(图5)可知随着样品浓度的增加,样品的清除率也在不断增加,说明红毛藻多糖清除DPPH自由基呈剂量依耐型关系。根据样品的浓度与清除率曲线结果可得,红毛藻多糖清除DPPH自由基的IC50值为0.36 mg/mL。
2.5.2 红毛藻多糖清除羟基自由基的能力测定
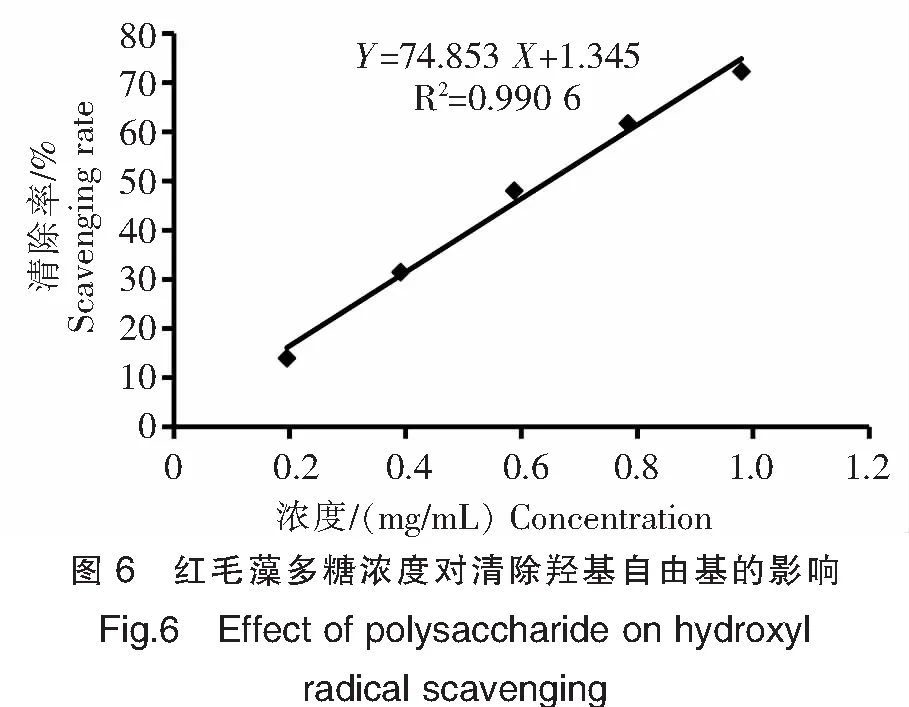
由实验结果(图6)可知红毛藻多糖对羟基自由基的清除率随着浓度的增加而提高,表明红毛藻多糖浓度与羟基自由基的清除率呈正相关。根据样品的浓度与清除率曲线结果可得红毛藻多糖清除羟基自由基的IC50值为0.65 mg/mL。
3 讨论
海藻多糖是藻类植物中重要的组成成分之一,约占干重的20%~70%,它是一类混合物,是海藻细胞间和细胞内所含的各种高分子碳水化合物的总称[8]。研究表明,海藻多糖具有广泛的生物学活性,包括抗病毒、抗肿瘤、免疫调节、降血脂和降血糖等[9-13],因而其有望被开发成为保健品或者药品,为实现产业可持续发展提供有益的参考[14]。
本实验通过单因素实验并结合正交实验设计优化红毛藻多糖的提取工艺,最后确定红毛藻多糖最佳提取工艺为料液比1∶40、在温度为90℃下提取2.0 h。抗氧化活性研究表明红毛藻多糖能有效清除DPPH自由基,其 IC50值为0.36 mg/mL;红毛藻多糖清除羟基自由基的IC50值为0.65 mg/mL。本研究可为红毛藻多糖的高值化开发应用提供理论依据,也为海藻多糖的应用前景[15]提供了理论参考。
