60Co-γ射线对日本囊对虾诱变子代遗传多样性和生长的影响
2021-06-29郑雅友李正良
刘 波,郑雅友,李正良
(福建省水产研究所,福建 厦门 361013)
日本囊对虾(Marsupenaeusjaponicus)是我国较重要的养殖虾类之一,养殖过程中种质不断衰退,病害频发,其种质的优劣已经成为影响产业可持续发展的关键因素[1]。研究表明,水生生物对病害的易感和缓慢的生长与其群体较低的遗传多样性水平密切关系[2]。60Co-γ射线诱变在育种实践和遗传学研究中有着广泛应用,已在农作物育种中被大量使用,并取得良好的经济效益和社会效益[3]。但是,相关技术手段在水生生物遗传选育的领域使用较少:刘晓等利用60Co-γ射线对成体长牡蛎进行了照射,研究了射线对长牡蛎生长的影响规律[4];笔者记录了60Co-γ射线对日本囊对虾诱变不同实验组的孵化率、存活率[5],总体来说,现阶段可查阅的相关文献资料较少。本文主要探讨了在不同诱变剂量下60Co-γ射线对日本囊对虾诱变子代遗传和生长的影响,采用AFLP分子标记技术从分子水平对各组诱变子代的遗传差异进行分析,旨在为增加日本囊对虾子代群体的遗传多样性水平提供参考数据。
1 材料与方法
1.1 材料
1.1.1 诱变子代的来源
日本囊对虾的亲本为性腺发育良好、处于繁殖期的个体,体长为23~27 cm,共75尾。诱变子代为亲本经过60Co-γ射线照射后孵化的苗种,在土池中培育90 d后随机采集各实验组样本(各30尾)进行体质量测量,并采集肌肉样本,制备高质量大片段基因组DNA样本(共40份)备用。
1.1.2 实验器材
钴60治疗机:国产FCC8000型;PCR仪:Biometra公司的T3型;紫外分光光度计:Varian公司的Cary 50型;高压电泳仪:BIO-RAD公司的PowerPac 3000型;垂直电泳槽:BIO-RAD公司的Sequi-Gen GT型;超净工作台:净化设备工程有限公司的SW-CJ-1F型;台式高速冷冻离心机:Eppendorf公司的5810R型;生物分析仪:Agilent公司的2100型。
1.1.3 试剂
Taq聚合酶(Fermentas公司);GeneRuler 50 bp DNA Ladder(Fermentas公司);组织/细胞DNA(小量)抽提试剂盒(上海华舜生物工程有限公司);AFLP Analysis SystemⅠ试剂盒(Invitrogen公司)。
1.2 方法
1.2.1 亲虾的处理及苗种培育
日本囊对虾剪除眼柄后暂养于厦门市水产研究所前埔实验场24 m2水泥池内,连同对照组在内共设置5个实验组,每组15尾。亲虾性腺成熟后在厦门大学附属第一医院进行60Co-γ射线照射,诱变剂量为50、100、1 000、1 500 cGy,剂量率为3.4 cGy/sec。
收集照射后当天产卵亲虾的受精卵,放置于半吨桶,按照常规的对虾苗种繁育技术规范培育,仔虾达到P20阶段时,将上述苗种以15尾/m2(根据网箱面积计算)的养殖密度放置于室外土池中,使用2.5 m×2.5 m×2.0 m的塑胶网箱(各实验组均设置3个平行)在同一水体中培育3个月(使用相同品牌、相同饵料量进行培育),每天投饵2次,各实验组日投饵率均相同。
1.2.2 诱变子代基因组DNA的制备
各实验组共随机采集40尾诱变子代(每组8尾),经过蒸馏水洗涤后,剪下肌肉组织约25 mg,在液氮中研磨成白色粉末。使用上海华舜生物工程有限公司的组织/细胞DNA(小量)抽提试剂盒进行基因组DNA的提取。提取出来的DNA通过紫外分光光度计测定DNA浓度,将各组DNA用超纯水稀释为10 μg/mL的模板DNA;琼脂糖凝胶电泳和生物分析仪2100检测DNA完整性。
1.2.3 AFLP反应
双酶切:取基因组DNA 100 ng,加入EcoR1和Mse1两种内切酶各1 U和相应的缓冲液,在37℃条件下反应2 h。酶切后在70℃下作用15 min使酶失活。
连接:在20 μL反应体系中,含有双酶切后的模板DNA 10 μL、T4连接酶1 U,连接缓冲液10 μL,在20℃条件下反应2 h。连接反应产物取5 μL用TE稀释10倍备用,其余部分-20℃保存。
预扩增反应条件如下:94℃ 2 min;(94℃ 30 s,56℃ 60 s,72℃ 60 s)×20 cycles;预扩增反应产物取3 μL用TE稀释50倍备用,其余部分-20℃保存。
选择性扩增反应条件如下:94℃ 2 min;(94℃ 45 s,65~56℃ 45 s,72℃ 90 s)×13个循环;(94℃ 30 s,56℃ 30 s,72℃ 60 s)×23个循环;72℃ 2 min。
EcoR I 接头(Adapter):5’-CTCGTAGACTGCGTACC,CATCTGACGCATGGTTAA-’5。
Mse I 接头(Adapter):5’-GACGTGAGTCCTGAG,TACTCAGGACTCAT-’5。
预扩增引物(Pre-amplification primers)序列:E05’-GACTGCGTACCAATTC-3’M05’-GATGAGTCCTGAGTAA-3’
选择性扩增引物(Selective-amplification primers)序列:
E-ACA/M-CAG E-ACT/M-CAT
E-AGC/M-CTG E-AGA/M-CTT
E-AGA/M-CAG E-ACC/M-CAC
E-ACC/M-CTT E-AGG/M-CAC
E-ACA/M-CAA E-AAG/M-CAT
制胶:将玻璃板清洗干净,用75%酒精擦洗一遍。在较长的玻璃板涂一层硅烷黏合剂。晾干后将两块玻璃板夹好,封住底边。配制6%变性聚丙稀酰胺凝胶,灌胶。水平放置1 h等待凝胶凝固。
电泳:AFLP扩增产物在电泳前加入4μL上样缓冲液,在PCR仪上95℃变性5 min,冰浴10 min。胶凝固后先进行预电泳,电泳时电压2 000 V,功率70 W,电流55 mA。当凝胶温度上升至50℃时,取4 μL变性好的样品加入电泳槽中电泳。电泳功率70 W,电压2 000 V 左右,电流55 mA,电泳大约1.5 h,电泳缓冲液为1×TBE。
染色:将凝胶冷却5 min,然后浸泡在10%的乙酸中进行固定,置于水平摇床上振摇约30 min;取出凝胶,用预冷的蒸馏水冲洗2次,放入银染液中,再置于摇床上振摇约30 min;取出凝胶,用预冷的蒸馏水冲洗2次,浸入显色液中至显出清晰的条带,放入10%乙酸溶液中中止显色,观察并拍照。
1.2.4 数据的统计
当某一扩增片段出现时记为1,不出现时记为0,将AFLP指纹图谱中分子量从50 bp到2 000 bp之间的条带转换成数字矩阵,根据Nei M等[6]和Lynch M[7]的计算公式,计算各个实验组迁移率不同的扩增片段数目、多态性片段(谱带)数目及其比例、组内和组间扩增片段的相似系数、组间的遗传距离[8]等各项参数,并对诱变子代的扩增图谱进行比对(组内和组间),得到遗传距离矩阵,通过扩增位点的数量、多态率等参数评估诱变组与对照组之间的遗传结构。
遗传距离等数据的有关计算公式如下:
相似系数 Sij=2Nij/(Ni+Nj)
(1)
遗传距离 D=-ln S
(2)
多态率 p=x/r
(3)
式中Nij为群体i与j共有的片段数量,Ni、Nj分别为群体i与j各自具有的片段数量;S为相似系数;x为具有多态性的位点,r为扩增出来的总位点数。
数据通过Microsoft Excel 2007进行计算;利用UPGMA法进行聚类分析。
2 结果
2.1 诱变子代的AFLP扩增结果
本文共筛选了20对选择性引物,并从中选择了10对选择性扩增引物对日本囊对虾诱变子代5组40份模板DNA进行AFLP扩增,每个引物均能扩增出重复性良好的特定扩增产物,表现出一定程度的多态性。日本囊对虾10对引物在分子量50 bp到2 000 bp之间共检测出447个位点,其中多态位点299个,占66.9%。引物扩增的位点数为36~55个,平均44.7个。表1列出了10对选择性扩增引物对诱变子代基因组DNA的扩增情况。PCR扩增产物进行变性聚丙稀酰胺凝胶电泳后的结果如图1所示。
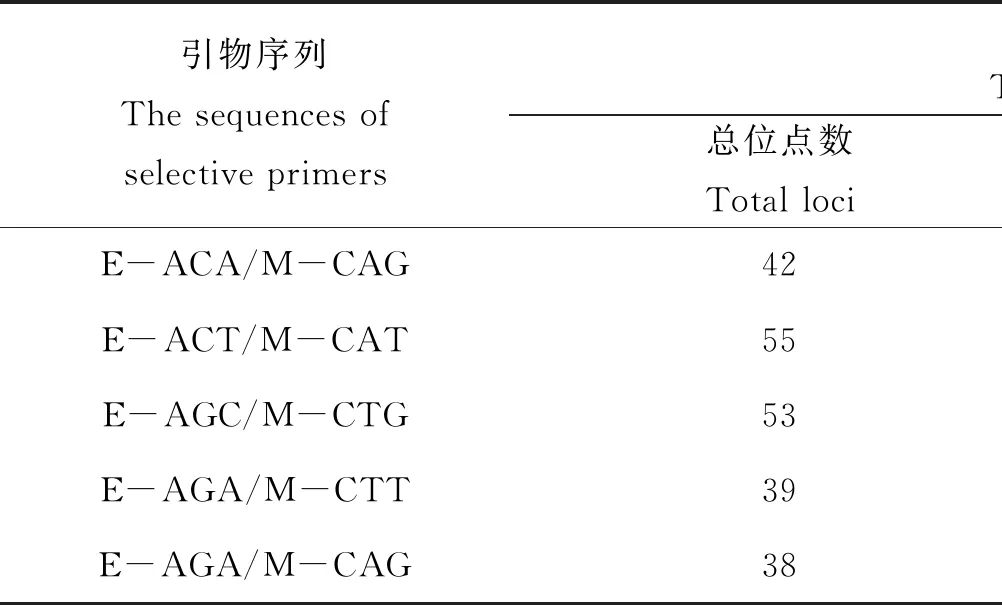
表1 选择性扩增的引物序列及日本囊对虾诱变子代基因组DNA的扩增情况

续表1

注:M为50 bp DNA Ladder;1~8为诱变组4(1 500 cGy);9~16为诱变组3(1 000 cGy);17~24为诱变组2(100 cGy);25~32为诱变组1(50 cGy);33~40为对照组。
2.2 诱变子代各实验组遗传相似系数及遗传距离的分析结果
根据各位点扩增产物的有无按1、0进行统计,建立数据矩阵,计算遗传相似系数、遗传距离等参数,日本囊对虾诱变子代各实验组遗传相似系数的变化范围从0.873 7(诱变组2组内的统计结果)一直到0.894 7(诱变组4和对照组之间的统计结果)。经过单因素方差分析检测其差异显著性,发现这些数据差异并不显著,从群体水平来看,日本囊对虾的诱变子代与正常对照组相比(P>0.05),并没有显著的遗传差异。表2列出了日本囊对虾对照组和各诱变组组内及组间的遗传相似系数与遗传距离数据,图2为利用UPGMA法得到的遗传距离聚类图。
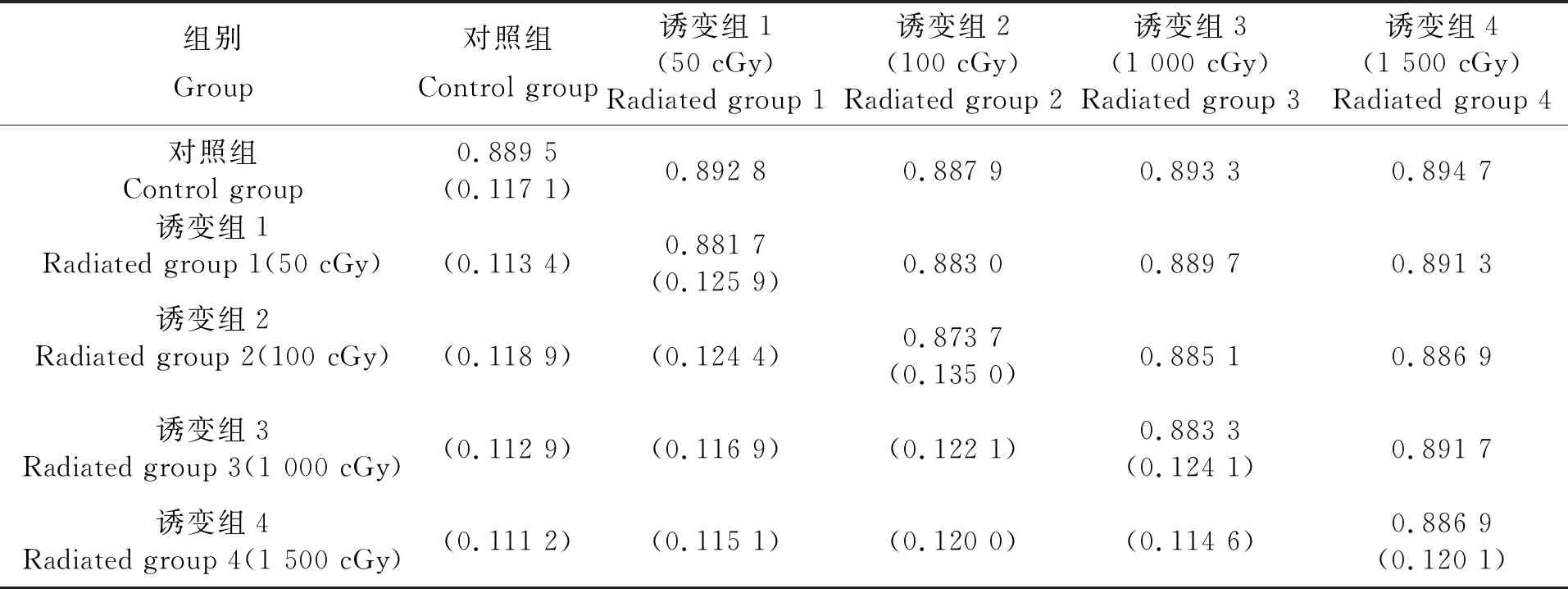
表2 日本囊对虾诱变子代各实验组的遗传相似系数(上三角)和遗传距离(下三角)

注:1为对照组;2为诱变组1(50 cGy);3为诱变组2(100 cGy);4为诱变组3(1 000 cGy);5为诱变组4(1 500 cGy)。
2.3 诱变子代各实验组生长的影响分析
随机采集日本囊对虾诱变子代各实验组样本各30尾,在电子分析天平上进行体质量称量。实验数据通过SPSS 19.0进行单因素方差分析(表3),作图在Microsoft Excel 2007进行。实验数据表明对照组的生长是各实验组中生长速度最快的一组,且对照组与诱变组4(1 500 cGy)的生长速度具有显著性差异(P<0.05)。

表3 日本囊对虾诱变子代在土池培育90 d各实验组平均体质量

续表3

3 讨论
辐射对生物遗传的影响表现在多个方面,包括DNA单链断裂、双链断裂、碱基的损伤、DNA与DNA交联及DNA和蛋白质交联等,能够有效地增加种群的遗传多样性水平,结合人工选育技术可筛选出符合人们生产需要的新品种或新品系[9]。1927年Muller首次报道了X射线能够诱导果蝇产生大量多变类型的突变,其后大量研究以农作物为对象开展起来[10],现阶段诱变育成的作物品种中使用60Co-γ射线辐照的占75.0%~84.2%[11]。现在,辐射开始被应用在水生生物的遗传选育当中[12-13]。
AFLP即扩增片段长度多态性(Amplified fragments length polymorphism)技术,是当前检测遗传多样性较有效的手段之一[14],人们仅需要少量的DNA就可以提供极为丰富的遗传信息。AFLP技术现已被广泛应用于动、植物的种系与个体鉴别、基因定位克隆,以及种群遗传结构与遗传多样性的研究[15-18]。本研究的AFLP扩增结果说明了AFLP是一种能够有效检测种群内遗传差异的分子标记技术。
本文利用大量基因位点的遗传信息研究辐射诱变引起的遗传差异,根据Nei M等[6]的报道,当基因位点足够多时仅用1个样本代表这个分类单元得到的系统发育图都是可信的。本文的研究结果表明,日本囊对虾诱变子代各实验组组内及组间的遗传相似系数及遗传距离的差异并不显著(P>0.05),利用UPGMA法对日本囊对虾诱变子代各实验组遗传距离的平均值进行聚类分析,发现各实验组之间遗传距离的差异都小于0.01。但是,在每对引物扩增出的基因型(单个个体扩增谱带的组合型式)在诱变组中发现有部分个体的基因型和其他个体的基因型具有较为明显的差异,而在对照组中并没有发现类似的现象。结合笔者已发表的有关日本囊对虾在无节幼体阶段的论文中相应遗传相似系数和遗传距离具有较为显著的差异这一实验现象来分析[5],认为经过辐射诱变处理后产生变异的个体在生长过程中其体内的自我修复机制可能会对产生变异的基因序列进行修复,在无法修复时甚至可能造成个体的死亡。因此,结合人工选育技术对少数变异个体进行选择以建立生物新品系,增加群体的遗传多样性以丰富种质资源,显得尤为重要[19]。
日本囊对虾诱变子代在土池培育90 d,各实验组生长速度的研究结果发现,对照组的生长速度在各实验组中最快,且对照组与诱变组4(1 500 cGy)的生长速度具有显著性差异(P<0.05)。但是,对照组组内个体之间生长速度的差异就要明显小得多(P>0.05),没有出现这种个体体质量差异悬殊的现象。
从分子水平上对生物遗传物质的变异进行评估是一种研究60Co-γ射线辐射诱变效应的现代技术,为进一步研究生物的自我修复系统与遗传变异之间平衡的生物学机制提供了方法[20]。本研究由于遗传背景信息的缺乏,AFLP技术具有能够快速有效地分析群体遗传差异的特点,为本文提供了比较充分的分子生物学证据[21]。本研究证实将60Co-γ射线应用于日本囊对虾的诱变育种,还需要解决经过诱变后的个体在生长过程中不断进行修复、甚至死亡的问题,以保证能够得到大量的变异个体,通过人工选育,从而为产业提供具有优良性状的新品种或新品系。将来,可以进一步将特殊个体分子标记的条带从凝胶上切割下来,进行DNA序列测定,并将其发展成为STS(Sequence target site)标记,结合人工选育手段,形成分子标记辅助选育技术,以期快速地对种群进行遗传选育工作。
