辛烯基琥珀酸藜麦淀粉酯的制备及性能
2021-06-28姜晓丽罗志刚
姜晓丽,罗志刚,
1.沈阳师范大学粮食学院(沈阳 110034);2.华南理工大学食品科学与工程学院(广州 510641)
藜麦(Chenopodium quinoaWild)是原产于南美洲安迪斯山区的伪谷物[1]。藜麦是一种具有高蛋白、维生素、矿物质和营养成分的高营养假谷物。其蛋白含量达14%~16%,富含人体必需的氨基酸,其中赖氨酸和组氨酸含量最高。与其他谷物和假谷物一样,淀粉是藜麦种子的主要成分之一。藜麦淀粉的粒径比较小(约1.5 μm),藜麦中的淀粉含量达52.2%~69.2%[2],直链淀粉含量较低(约10%)。藜麦淀粉支链中短链含量较高,长链的含量较低,这一结构赋予藜麦淀粉独特的理化性质,如较低的糊化温度、缓慢的回生、高膨胀性和高酶敏感性。藜麦淀粉被认为是一种新颖的淀粉来源,在各种食品和非食品中都有极大的应用潜力,被广泛应用于生物膜生产和食品配料(如油)的微胶囊化等方面。
虽然天然淀粉在食品、化工、制药等领域有所应用,但天然淀粉的自身缺陷在一定程度上限制了其更广阔的工业应用。辛烯基琥珀酸淀粉酯,商品名称为纯胶。它是由辛烯基琥珀酸酐(OSA)和淀粉在碱性条件下发生反应形成的一种重要的化学变性淀粉。淀粉具有天然的亲水性质,用OSA对淀粉进行化学改性,将颗粒表面接枝疏水基团,从而增加疏水性,因此辛烯基琥珀酸淀粉酯(OSA淀粉)具有双亲性[3]。与天然淀粉相比,OSA淀粉同时含有亲水基团和疏水基团,所以OSA淀粉作为乳化剂被广泛用于稳定pickering乳液,该类乳液具有乳化效率高、稳定性好等优点。OSA改性可以显著改善淀粉的糊化、回生、黏度等理化性质。OSA淀粉在食品、医药、化妆品等领域被广泛应用[4]。
1 材料与方法
1.1 材料与试剂
藜麦(繁峙县玥晨贸易有限公司);辛烯基琥珀酸酐(阿拉丁试剂有限公司);盐酸、氢氧化钠、无水乙醇、异丙醇等(国产分析纯)。
1.2 仪器与设备
扫描电镜(ZEISS EVO18,德国卡尔蔡司);傅里叶红外光谱仪(Vector 33-MIR,德国Brukev Optik);多位自动进样X射线衍射仪(X’pert Powder,荷兰PANalytical);离心机(TDL-5-A,上海安亭科学仪器厂)。
1.3 试验方法
1.3.1 藜麦淀粉的提取
取一定量的藜麦种子烘干,用高速粉碎机将其粉碎后,过孔径0.200 mm筛,取藜麦粉与质量分数0.2%的氢氧化钠溶液按照固液比1∶10 g/mL进行混合,搅拌3 h后再静置18 h。将上述混合物在4 000 r/min条件下离心10 min,离心后去除上层黄色物质和下层灰色沉淀。收集中间层的白色沉淀物,在4 000 r/min条件下离心10 min,洗涤,过纱布,重复上述操作6~7次,调pH为中性,离心至上层没有黄色物质。将产物放到45 ℃烘箱,48 h烘干,粉碎,过孔径0.150 mm筛。
1.3.2 辛烯基琥珀酸藜麦淀粉酯的制备[5]
准确称取30 g藜麦淀粉(干基),与适量蒸馏水配制成质量分数30%的淀粉乳,进行磁力搅拌,控制反应温度35 ℃,边搅拌边缓慢添加OSA(添加量为藜麦淀粉干基的1.0%,3.0%,5.0%和7.0%),控制在1 h内加完。搅拌反应过程中,用3%的NaOH溶液调节pH 8.0~9.0。反应3 h后,用3%的HCl溶液调节pH至6.5左右,终止反应。将反应产物用蒸馏水洗3遍,乙醇洗3遍,放置于45 ℃烘箱中烘干,干燥后粉碎,过孔径0.150 mm筛,即得到辛烯基琥珀酸藜麦淀粉酯。
1.3.3 辛烯基琥珀酸藜麦淀粉酯取代度的测定[6]
准确称取5.0 g样品(干基)置于200 mL烧杯中,加入25 mL,2.5 mol/L的盐酸-异丙醇溶液,磁力搅拌30 min,加入50 mL体积分数90%的异丙醇,继续搅拌10 min。将样品移入布氏漏斗中,用体积分数90%的异丙醇洗涤至没有氯离子为止(用0.1 mol/L硝酸银溶液检验),将样品移入500 mL的烧杯中,加30 mL蒸馏水,沸水浴加热20 min,加3滴酚酞指示剂,趁热用0.1 mol/L的氢氧化钠标准溶液滴定至粉红色。取代度(DS)按式(1)计算。

式中:V为消耗0.1 mol/L氢氧化钠标准溶液体积,mL;C为氢氧化钠标准溶液浓度,0.1 mol/L;m为辛烯基琥珀酸淀粉酯样品干基质量,g。
1.4 辛烯基琥珀酸藜麦淀粉酯结构的测定
1.4.1 FT-IR
用压片法将原淀粉和OSA淀粉的结构进行鉴定,用FT-IR光谱仪进行光谱扫描,扫描范围4 000~500 cm-1,分辨率4 cm-1,扫描次数32次。记录样品的FT-IR图谱[7]。
1.4.2 SEM
将原淀粉与OSA淀粉均匀分散到导电胶上,把样品放到镀膜台上进行300 s的喷金处理,用扫描电子显微镜放大到合适的倍数,寻找并拍摄具备代表性的颗粒形貌[8]。
1.4.3 XRD
将原淀粉与OSA淀粉进行X射线衍射分析。衍射条件:铜靶电压40 kV,电流40 mA,CuKa辐射,扫面范围5°~35°,步长0.02°,扫描速度4°/min[9]。
1.4.4 DSC
采用差示扫描量热仪DSC-Q20进行热特性测定,用铝盒称取3.0 mg样品粉末(干基),按质量比1∶2的比例加入去离子水,压盖密封,以空白铝盒为对照样,扫描温度范围30~120 ℃,扫描速率10 ℃/min,从120 ℃冷却到30 ℃,保护气为氮气,流速20 mL/min[10]。
1.5 辛烯基琥珀酸藜麦淀粉酯性质的测定
1.5.1 取代度对淀粉糊透明度的影响[11]
称取一定质量的样品,用蒸馏水配制成1%(干基)的淀粉乳,放入100 ℃的水浴中糊化20 min,冷却至室温,以蒸馏水为空白对照,用分光光度计在650 nm处测定样品的透光率。
1.5.2 辛烯基琥珀酸淀粉酯冻融稳定性的研究
称取一定质量的样品,用蒸馏水配制成4%(干基)的淀粉乳,放入100 ℃水浴中糊化20 min,冷却至室温,将淀粉糊倒入已知质量为m1的离心管中,称其质量m2,放入冰箱中冷冻24 h,取出后自然解冻6 h,将离心管在转速3 000 r/min离心30 min,倒掉上清液,称其质量m3。按式(2)计算析水率。

式中:m1为离心管质量,g;m2为离心管加淀粉糊质量,g;m3为冷冻离心后离心管加淀粉糊质量,g。
1.5.3 辛烯基琥珀酸淀粉酯溶解度的测定[12]
称取一定量的样品,用蒸馏水配制成2%(干基)的淀粉乳,放入50 ℃的恒温水浴摇床溶解30 min,以3 000 r/min离心30 min,把上清液倒入已知质量为m1的培养皿中,在105 ℃烘箱中烘干至恒质量,称其质量m2。按式(3)计算溶解度(S)。

式中:m1为培养皿质量,g;m2为上清液蒸干至恒质量后培养皿质量,g;w为淀粉样品质量,g。
1.6 数据统计与分析
全部试验重复测定3次,取平均值,使用Origin 8.5软件制图。
2 结果与分析
2.1 酯化反应对OSA淀粉结构的影响
2.1.1 FT-IR
图1是原淀粉和OSA淀粉(取代度为0.016 2,0.027 0)的傅里叶红外光谱图。由图1可以看出,原淀粉在1 645,1 154,1 085和1 023 cm-1处出现的特征峰,分别由淀粉内的结合水和C—O的伸缩振动产生。3 385 cm-1处为淀粉的O—H的伸缩振动峰,2 930 cm-1处出现C—H的非对称伸缩振动吸收峰。与原淀粉相比,OSA淀粉在1 728 cm-1和1 571 cm-1处增加了2个新的特征峰,分别是C=O酯羰基的伸缩振动峰和RCOO—的羧酸盐的不对称拉伸振动峰[6,13],表明原淀粉与OSA发生酯化反应,成功引入OS基团。

图1 原淀粉和OSA淀粉的红外光谱图
2.1.2 微观结构
图2是藜麦原淀粉和OSA淀粉的扫描电镜图。藜麦原淀粉的颗粒尺寸较小,具有不规则的多边形结构,表面光滑,但颗粒完整。经过改性处理后,OSA淀粉颗粒表面没有明显变化,淀粉颗粒形态几乎没有变化,仍然呈现不规则的多边形结构,表明改性反应主要发生在淀粉颗粒表面,对淀粉颗粒内部结构不产生影响[14]。

图2 原淀粉与OSA淀粉的SEM
2.1.3 XRD
图3是原淀粉和OSA淀粉的X射线衍射图谱。原淀粉在射角15.0°,17.1°,18.0°和23.0°具有较强的衍射峰,为典型的A型结晶淀粉[7]。此外,取代度分别为0.016 2和0.027 0的OSA淀粉的衍射峰与原淀粉几乎一致,酯化反应未改变淀粉的晶体类型,酯化反应主要发生在淀粉的无定型区,这可能是由于淀粉的无定形区域相比于结晶区更易于发生酯化反应,从而不会对淀粉颗粒的晶型产生影响[13]。

图3 原淀粉和OSA淀粉的XRD图谱
2.1.4 DSC
表1是原淀粉和OSA淀粉的热力学特征参数。藜麦原淀粉的热力学特征参数值较高,而经过酯化改性处理后OSA淀粉的热力学特征参数值均有所降低,并且随着OSA取代度升高而逐渐下降。糊化焓(∆H)表示破坏淀粉颗粒结构所需能量,因此,OSA淀粉糊化温度和焓值的降低可能是由于酯化反应引入的带负电的疏水性烯基削弱淀粉分子之间的氢键作用,使水分更容易进入淀粉颗粒内部,有助于淀粉在较低温度下溶胀,从而逐渐降低OSA淀粉的糊化焓。同样,将OS基团引入生物聚合物的骨架中可增强结构柔性,进一步促进OSA淀粉糊化温度降低[15-18]。
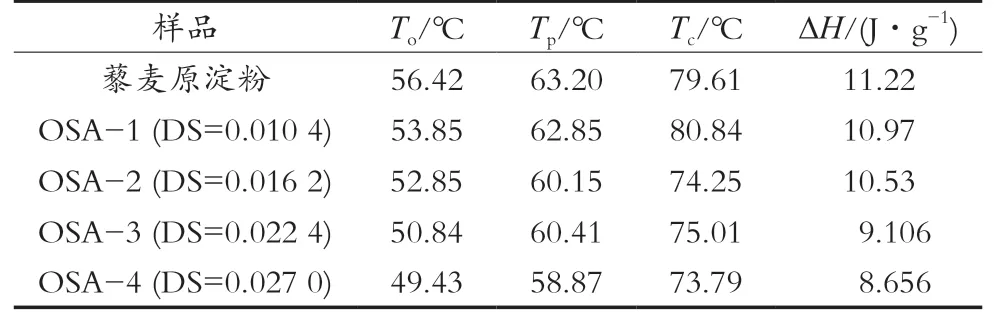
表1 藜麦原淀粉及OSA淀粉的热力学特征参数
2.2 辛烯基琥珀酸淀粉的理化性质分析
2.2.1 透明度
淀粉加热后会形成淀粉糊,当光线照射时,会因为分子结构的特征而发生一系列的光学现象,通过淀粉糊的光束越多,其透明度越高。从表2可以看出,OSA淀粉的透明度显著低于原淀粉,并且随着取代度增加,OSA淀粉的透明度逐渐降低。这可能是由于改性处理后,在原淀粉分子上引入OS基团,使淀粉糊的黏度增加,并起到阻碍部分光线通过的作用,从而导致透光率降低[11]。此外,原淀粉分子空间结构经酯化反应后发生改变,使通过的光束量减少,也引起透明度的下降[19]。

表2 不同取代度OSA淀粉的透明度
2.2.2 冻融稳定性
冻融稳定性一般是以析水率作为参考指标,淀粉的析水率越低,表明淀粉的冻融稳定性越好[7]。由表3可以看出,与原淀粉相比,OSA淀粉的冻融稳定性有明显的提高,随着取代度增加,OSA淀粉的析水率逐渐降低,表明OSA淀粉的冻融稳定性逐渐增强。这可能是由于酯化反应为淀粉分子引入羧基,使得其与水分子的作用加强,水分子不易析出,淀粉冻融稳定性增强[20-21]。冻融稳定性的增强也能够反映淀粉老化程度的降低,由于改性引入的OS基团增加淀粉分子之间的空间效应,从而阻止糊化的淀粉在低温储存时淀粉分子链的重排[22]。这一性质有利于辛烯基琥珀酸淀粉酯在冷冻食品中应用。

表3 不同取代度OSA淀粉的冻融稳定性
2.2.3 溶解度
淀粉颗粒的溶解度体现结晶区和无定形区分子链的结合程度,也反映直链淀粉分子间氢键的结合程度[23]。由表4可以看出,与原淀粉相比,OSA淀粉的溶解度明显增大,并且随着取代度的增加,OSA淀粉的溶解度也随之上升。这是由于经OSA酯化改性处理后,淀粉分子结构变得疏松,这有利于水分子进入淀粉颗粒内部,并在淀粉糊中扩散,从而增大水分子与淀粉分子的接触面积,因此OSA淀粉的溶解性得到显著提高[18]。

表4 不同取代度OSA淀粉的溶解度
3 结论
采用水相法制备辛烯基琥珀酸淀粉酯,FT-IR结果证明淀粉分子成功引入OS基团。SEM观察发现酯化反应对淀粉颗粒表面没有产生较大影响。XRD结果表明酯化反应主要发生在淀粉的无定型区域。理化研究结果表明淀粉的透明度、糊化温度和糊化焓随着取代度增加而降低,而溶解度和冻融稳定性随着取代度增加而增加。
