奇岗微繁技术建立及幼苗耐盐性评价
2021-06-28王晔陈慧萍李润枝彭真范希峰武菊英段留生
王晔,陈慧萍,李润枝,彭真,范希峰,武菊英*,段留生,2*
(1.北京农学院,植物科学技术学院,北京102206;2.中国农业大学农学院,植物生长调节剂教育部工程研究中心,北京100193;3.北京市农林科学院,北京草业与环境研究发展中心,北京100097)
奇岗(Miscanthus×giganteus)是禾本科芒属(Miscanthus)多年生草本植物,来源为二倍体芒(Miscanthus sinensis)和四倍体荻(Miscanthussacchariflorus)自然杂交形成的三倍体杂交种[1],原产于日本,在欧洲作为主要能源植物广泛种植,后来也作为园林观赏植物,逐渐散布于各地。奇岗因具有光合效率强、水分养分利用效率高[2];生物产量高、纤维品质好、灰分含量低[1-2];抗旱耐寒、入侵性低、边际土地生长能力强[3]等优点备受关注,除了可以观赏,也可以用于饲料、制造优质纸浆、建筑材料和发电等[2],是一种具有巨大潜在利用价值的节水型观赏植物和能源植物。
奇岗作为异源三倍体,结实率很低,难以利用种子繁殖,主要通过根状茎繁殖[4],但繁殖速度很慢,种植成本较高且不利于运输和保存,严重影响了其推广和研究[5]。利用组织培养技术不仅繁殖系数高、周期短、可产生大量植株,是一种方便、快捷、有效的繁殖手段,也是近期国内外研究芒属植物繁殖的热点方向[6]。目前国外已有奇岗微繁的相关报道,主要集中在外植体选择[7-8]、不同培养基的组合[9]、生长调节剂对愈伤组织诱导和植株再生的影响[10]及微生物接种促进幼苗生长能力[2]等方面,但尚未建立规模化应用的奇岗微繁技术体系,繁殖效率仍然较低,成本较高,尚难以满足大面积种植需要[11]。
我国目前对奇岗的微繁技术研究较少,同时我国大量边际性土地和园林绿化用地存在盐碱或盐渍化的问题,奇岗幼苗能否在高盐土壤上生长还缺乏研究。本研究在国外研究成果基础上,从腋芽生枝途径建立奇岗微繁技术,评价试管苗生长对盐胁迫的耐性,以期建立简单经济、繁殖系数高的奇岗无性繁殖体系,为利用稀缺材料高效培育高质量种苗,加快奇岗推广应用和在盐渍化土地利用提供理论和技术支撑。
1 材料与方法
1.1 试验材料
奇岗(M.×giganteus)于2004年种植于中国农业大学西校区校内试验地(40°01′N,116°36′E)和北京草业与环境研究发展中心试验基地(39°34′N,116°28′E)。
1.2 试验方法
试验以MS为基本培养基,在MS培养基中添加5.0 mg·L-16-苄氨基嘌呤(6-benzylaminopurine,6-BA)、0.25 mg·L-1萘乙酸(1-naphthalene acetic acid,NAA)、750.0 mg·L-1MgCl2·6H2O、20.0 g·L-1蔗糖和3.0 g·L-1Gelrite,pH为5.5~5.8。培养温度为(26±1)℃,光照/黑暗16 h/8 h,光照强度35μmol·m-2·s-1。
1.3 外植体消毒和选材
1.3.1 外植体消毒 选取处于旺盛生长阶段的奇岗茎秆,去除叶片,截取茎节上下1.5 cm茎段,在超净工作台上采用下列4种方法消毒,D1:用0.1%氯化汞(HgCl2)浸泡20 min;D2:1.5%HgCl2浸泡5 min;D3:1.0%次氯酸钠(NaClO)浸泡20 min;D4:用75%酒精喷洒表面后,再用1.0%NaClO浸泡20 min。选取所有的方法消毒完毕后,均用无菌水冲洗3次以上,用无菌滤纸吸去水分后接种。每个处理10瓶,每瓶接种5个茎段外植体,重复3次。培养10 d后统计污染率(污染率=污染个数/接种个数×100%)和出芽率(出芽率=未污染出芽个数/未污染接种个数×100%)。
1.3.2 外植体选材 选取完全展开叶片数为5~6片、8~9片和10片时的健壮生长的植株,去除叶片,保留叶鞘,取茎节上下1.5 cm茎段,根据1.3.1试验结果,选择消毒方法。每个处理10瓶,每瓶接种5个茎段外植体,重复3次。培养10 d后统计出芽率和增殖倍数(增殖倍数=增殖后的茎段数/接种的茎段数)。
1.4 诱导和继代培养基的筛选
选取完全展开叶片数为5~6片的植株,将无菌茎段分别接种到加入含不同浓度6-BA的培养基中:1)1.0 mg·L-16-BA;2)3.0 mg·L-16-BA;3)5.0 mg·L-16-BA;4)7.0 mg·L-16-BA。每个处理10瓶,每瓶接种5个茎段外植体,重复3次。每隔30 d继代一次,统计繁殖系数(繁殖系数=继代后获得的茎段数/原有茎段数×100%)。
1.5 生根培养
选择继代培养获得的生长健壮的丛生茎接种到加入5.0 g·L-1活性炭的1/2 MS培养基中,以不添加活性炭为对照,每个处理10瓶,每瓶接5丛,重复3次,培养30 d后统计根数、根长和发根植株的株高等。
1.6 耐盐适应性
采用水培试验,在中国农业大学光照培养室中进行,光照强度为600μmol·cm-2·s-1,光照/黑暗时间为16 h/8 h,昼/夜温度为(25±2)°C/(15±2)°C,相对湿度为60%~70%。选取生长健壮的试管苗移栽到1/2 Hongland培养液中,培养7 d后,在全营养液中再培养7 d后进行盐胁迫处理。加入NaCl浓度分别为0、0.2%、0.4%、0.6%和0.8%。每处理移栽10株,重复3次。每隔4 d更换一次培养液,保持24 h通气。
1.7 数据处理与分析
采用Excel 2010软件进行数据整理,用SAS 8.0统计软件的ANOVA法进行差异显著性分析,用Duncan’s法进行多重比较。
2 结果与分析
2.1 茎段外植体消毒方法筛选
不同消毒方法对茎段外植体腋芽发生诱导率和污染率影响较大(表1),其中,1.0%NaClO浸泡20 min处理的诱导率较高(72.5%),但其污染率(12.5%)显著高于其他处理(P<0.05);1.5%NaClO浸泡20 min处理消毒效果虽好,但对植株组织伤害较大,降低了诱导率(23.3%)。对植株组织先用70%酒精喷洒表面,再用1.0%NaClO溶液浸泡20 min消毒效果最佳,没有污染,且诱导率高达85.2%。

表1 茎段外植体消毒方法筛选Table 1 Screening of sterilization methods for explants of nodal segments(%)
2.2 茎段外植体生长时期的选择
由表2可以看出,在相同培养条件下,外植体的取材时期不同,出芽诱导率也受到影响。不同取材时期的可用外植体数差异不显著。随着叶龄的增加,出芽率降低,增殖倍数也呈降低趋势。当在5~6叶取材时,外植体出芽率最高为83.95%,增殖倍数为3.98。因此,综合比较,5~6叶时期取材(图1A),增殖效率最高,8~9叶期和10叶以上取材繁殖效率较低。

图1 奇岗微繁植株再生体系Fig.1 Plant regeneration system of M.×giganteus
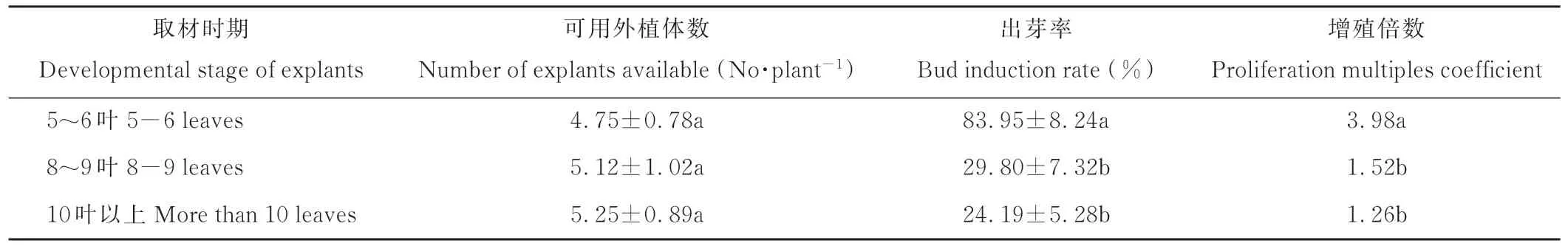
表2 不同取材时期对增殖倍数的影响Table 2 Effects of nodal segments developmental stage on bud induction rate and proliferation multiples
2.3 培养基优化
由表3可见,茎段接入添加6-BA的MS诱导培养基后,在30 d时统计腋芽发生(图1B),不同浓度6-BA对奇岗出芽诱导率没有显著影响(82.75%~84.09%)。随着继代培养基中添加6-BA浓度增加,繁殖系数呈先增高后降低趋势。当6-BA浓度较低,为1.0 mg·L-1时,繁殖系数最低,但出芽诱导率高;当6-BA浓度为5.0 mg·L-1时,繁殖系数较其他浓度6-BA处理显著增加;6-BA浓度为3.0和7.0 mg·L-1时繁殖系数差异不显著。相同浓度6-BA处理,对一代(30 d)、二代(60 d)和三代(90 d)间繁殖系数影响不显著。由此可见,6-BA浓度5.0 mg·L-1为适宜浓度,每继代一次,一个茎段平均可增加2~3个幼芽,繁殖系数平均可达341.67%。

表3 不同浓度6-BA处理对茎段外植体出芽率和繁殖系数的影响Table 3 Effects of different 6-BA levels on bud induction rate and multiplication coefficient of nodal segments explants
2.4 生根培养
将增殖培养后的奇岗丛生芽(图1C)转移至生根培养基中进行生根培养。培养基中加入活性炭,生根率、幼苗株高和根数与对照相比无显著差异(表4)。平均根长与对照相比,提高了1.5倍,且达显著水平,而且根的质量提高,变得柔软不易折断,移栽时成活率提高了1.1倍,减少了移栽失败造成的人力物力浪费从而提高了经济效益。
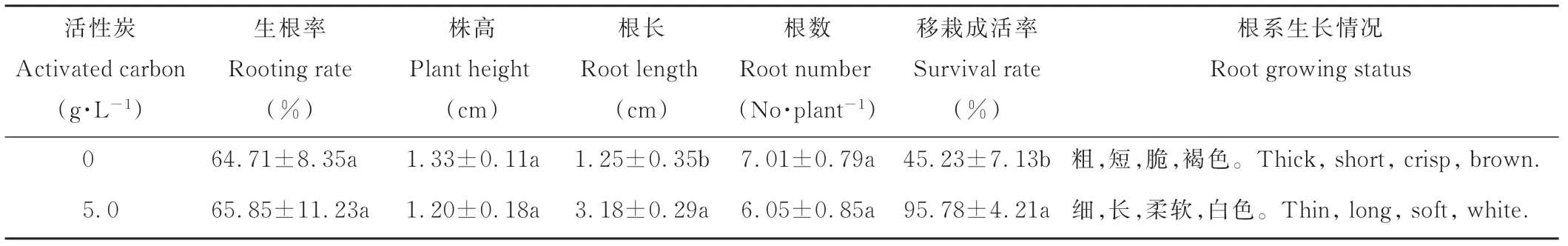
表4 活性炭对奇岗生根壮苗的影响Table 4 Effects of activated carbon on the rooting and transplantation of M.×giganteus
2.5 不同NaCl浓度对微繁苗生长速率和生物量的影响
试管苗经炼苗移栽至不同NaCl浓度的水培营养液中,随着培养液中NaCl的浓度增加,微繁苗生长速率呈降低趋势(表5)。胁迫处理7 d,NaCl浓度大于0.2%,植株生长速率显著减慢,但仍能存活。胁迫处理14 d后,0.8%浓度的NaCl处理植株逐渐枯萎死亡;0.4%和0.6%浓度的NaCl处理使植株生长速度缓慢,根开始变软,变褐,均表现出盐害现象,但是两者的生长速率差异不显著;当NaCl浓度为0.2%时,与对照相比,植株根系发生量多,根系较硬,较长,也有小的腋芽发生,且生长速率和生物量与对照相比差异不显著。

表5 不同NaCl浓度对奇岗微繁苗生长速率和生物量的影响Table 5 Effects of differ ent NaCl concentrations on the gr owth r ate and fr esh weight of M.×giganteus
3 讨论与结论
3.1 外植体及消毒方法对奇岗微繁效果的影响
外植体的生理状态、生长周期、可用数目、诱导率都是影响繁殖效率的重要因素。奇岗组织培养在腋芽发生途径的微繁中常以茎节[12]和茎尖[13]为外植体。由于茎尖器官幼嫩对取材和消毒处理要求较高,且一个植株只能获得一个茎尖,繁殖系数低。以茎段为外植体时,操作简便易行,但不同生长期的茎段对微繁效果和幼苗质量有一定影响。本研究用不同叶龄的茎段微繁发现,5~6叶龄奇岗植株的茎段做外植体出芽率和增殖系数均最高;5叶龄前的茎段物质积累较少,微繁成苗率低、幼苗长势弱;8叶龄后奇岗下部茎节木质化程度逐渐增加,再取茎段培养诱导率低,消毒处理比较困难。
不同消毒剂浓度和处理时间对奇岗微繁过程中污染率和诱导率影响较大。Nielsen等[12]采用1.5%NaClO浸泡20 min消毒茎段,诱导率较低;Lewandowski[13]先用70%酒精浸泡3 s,再用1.5%NaClO浸泡5 min对外植体消毒,茎段污染率高,且褐化严重。本研究对茎段外植体用75%酒精喷洒表面后再用1.0%NaClO浸泡20 min,获得了较好的灭菌效果,同时保证了较高的诱导率。
3.2 不同植物生长调节剂和活性炭对奇岗微繁效果的影响
植物生长调节剂是微繁培养基中的关键物质,其种类、用量和组合对培养物的诱导分化起重要作用[14-16]。本研究结果表明,6-BA浓度为5.0 mg·L-1时,茎段增殖率最高,为362.58%,当6-BA浓度达7.0 mg·L-1时,茎段开始出现玻璃化,可见,6-BA的诱导作用显著,不仅能促进细胞分裂膨大,也利于茎生长、侧芽发生及增殖,但高浓度则有抑制作用[17-18]。综合诱导率和繁殖系数,在腋芽生枝途径微繁体系培养基中6-BA适宜浓度范围为3.0~5.0 mg·L-1,但各浓度下均未产生根系。
活性炭具有极高的吸附能力被广泛应用于植物组织培养中,本试验添加5.0 g·L-1活性炭显著提高了根系质量,有利于培养壮苗。莫远琪等[19]研究发现活性炭浓度在1.0~2.0 g·L-1对澳洲鸽子石斛(Dendrobium kingianum)的株高和叶片数生长有促进作用,但根数和根长变化不大。马丽娜等[17]研究新塔花(Ziziphora bungeana)组织培养中发现添加0.1%~0.2%活性炭与生长素配比使用达到壮苗效果,生根植株长势较好,推测一定浓度的活性炭吸附了植株生根培养时产生的酚类物质,说明活性炭在植物生根培养过程中起着重要作用。同时还能将培养基变黑提供类似土壤的暗化条件,有利于离体生根和根生长[20]。
3.3 奇岗微繁移栽苗的耐盐性评价
盐胁迫会使植株正常生长发育受到严重限制,成活率降低且株体生长量锐减[21]。林聪[21]对芒属植物进行田间盐胁迫研究中发现南荻(Miscanthuslutarioriparia)在轻度(平均含盐量0.4%)和中度(平均含盐量0.5%)盐碱地上耐盐能力均较强,而对奇岗的耐盐能力没有涉及。本试验发现对奇岗微繁试管苗进行NaCl胁迫处理14 d,0.8%NaCl浓度下微繁苗逐渐枯萎死亡;低于0.8%的NaCl胁迫处理,植株生长速率虽受到抑制,但仍然存活,与段钧译等[22]对奇岗幼苗NaCl胁迫下的表现一致。说明在较高盐浓度条件下奇岗微繁苗能够正常生长,具有较强的耐盐性。
