颈动脉斑块超声造影增强特征与其病理特征及易损性的相关性
2021-06-28李海欣阚艳敏余海歌
李海欣,阚艳敏,宁 彬,余海歌,何 文*
(1.北京市海淀医院 北京大学第三医院海淀院区超声科,北京 100080;2.首都医科大学附属北京天坛医院超声科,北京 100070)
脑卒中发病率、致残率及死亡率均较高,易损性颈动脉粥样硬化斑块、尤其缺血性脑卒中[1]是导致脑卒中的重要原因之一。研究颈动脉粥样硬化斑块的易损性对预防及治疗脑卒中至关重要。斑块内新生血管是影响其易损性的重要因素之一,借助新生血管数量可评估斑块易损性。超声造影(contrast enhanced ultrasound, CEUS)为评估斑块易损性提供了可视化途径。本研究观察斑块CEUS增强特征与其内新生血管及弹性蛋白形态等病理特征的相关性以及CEUS评价斑块易损性的价值。
1 资料与方法
1.1 研究对象 回顾性分析2016年6月—2017年8月124例经首都医科大学附属北京天坛医院诊断为颈动脉粥样硬化斑块患者,男93例,女31例,年龄41~85岁,平均(61.4±9.0)岁。纳入标准:①年龄18~80岁;②颈总动脉或颈动脉分叉处单发斑块,厚度≥2.5 mm,表面无弧形钙化,伴声影。排除标准:①合并颅内动静脉畸形、颅内动脉狭窄、闭塞等脑血管病、脑出血、颈椎病、心房颤动、卵圆孔未闭及免疫系统疾病等;②严重心、肺或肾功能不全;③妊娠或哺乳期;④蛋白及造影剂过敏;⑤CEUS图像质量不佳;⑥手术过程及病理制片过程中因人为因素导致斑块不完整、病理图片显示不佳。根据6个月内有无短暂性脑缺血发作(transient ischemic attack, TIA)或非致死性脑卒中,将患者分为症状组(n=40)和非症状组(n=84)。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Toshiba Aplio 500彩色多普勒诊断仪,配备剪切波成像技术和CEUS功能及软件,11-L4线阵探头,频率4~11 MHz。嘱患者平卧,头略后仰并放松,充分暴露颈部,头偏向检查对侧45°;由2名具有10年以上工作经验的超声科医师分别采用灰阶超声、彩色多普勒及脉冲多普勒常规扫查颈动脉,并留存动态图像用于回放观察。之后以声诺维为造影剂(Bracco,每瓶含六氟化硫59 mg),以5 ml生理盐水混合摇匀呈悬液,经上肢静脉团注,首次注射约1.6 ml,跟注5 ml生理盐水。在灰阶超声基础上启用造影模式,采用双幅对照显示,观察斑块增强情况;待造影剂部分消退时,每次补充0.8~1.0 ml造影剂并跟注5 ml生理盐水,重复观察至造影剂完全廓清并存储动态图像。评价斑块短轴最厚处造影增强情况,将其分为3级[2]:无造影剂进入为0级;仅外膜和/或斑块肩部见点、线状造影剂为Ⅰ级;造影剂到达斑块核心和/或增强贯穿斑块,呈片状、网络状为Ⅱ级。以Ⅱ级增强为标准,判断斑块的易损性,意见不一致时经协商达成共识。
1.3 临床资料 记录患者血压、血糖及血脂等情况。
1.4 病理学检查 124例中,60例接受颈动脉内膜剥脱术(carotid endarterectomy, CEA),并获得病理学结果。采用日本尼康正置光学显微镜、成像系统显微镜及IPP软件观察分析图像,于斑块短轴最厚处切面观察斑块内弹性蛋白形态。五色法染色下,弹性蛋白呈黑色,形态分为波浪状、平直或断裂状。以CD31标记新生血管,于40倍光镜下观察标本,选择3个血管着色最丰富区域,转换200倍光镜观察视野中微血管数,记录微血管密度(microvessel density, MVD)[3]。见图1、2。

图1 患者男,60岁,症状组 A.CEUS及灰阶超声显示Ⅰ级增强颈动脉斑块(箭); B.免疫组织化学以CD31标记新生血管(×40)
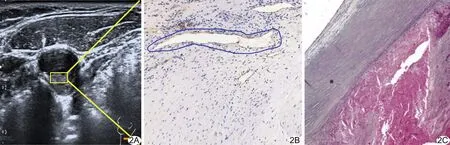
图2 患者男,58岁,症状组 A.灰阶超声图示颈动脉斑块; B.免疫组织化学以CD31标记新生血管(蓝圈),仅见一层内皮细胞围绕新生血管(×12.8); C.五色法染色图显示纤维帽下大量红细胞及坏死组织(×8)
1.5 统计学分析 采用SPSS 21.0统计分析软件,以±s表示计量资料,组间比较采用两独立样本t检验;以频数表示计数资料,组间比较采用χ2检验。采用Spearman相关性分析判断斑块CEUS增强等级与MVD的相关性。P<0.05为差异有统计学意义。
2 结果
症状组与非症状组患者性别、年龄、体质量指数(body mass index, BMI),高血压、高血糖及高血脂病史差异均无统计学意义(P均>0.05),见表1。

表1 颈动脉粥样硬化斑块患者一般临床资料比较
2.1 CEUS增强等级 症状组颈动脉斑块CEUS多为Ⅱ级增强,非症状组多为Ⅰ级增强(P<0.05),见图3~5及表2。
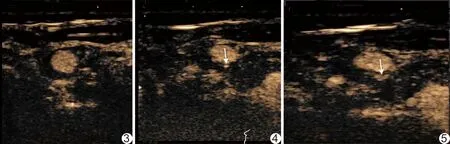
图3 患者女,55岁,非症状组 CEUS显示0级增强颈动脉斑块 图4 患者女,62岁,非症状组 CEUS显示Ⅰ级增强颈动脉斑块(箭) 图5 患者男,59岁,症状组 CEUS显示Ⅱ级增强颈动脉斑块(箭)

表2 颈动脉粥样硬化斑块CEUS增强等级(例)
2.2 相关性分析 60例接受CEA患者中,13例颈动脉斑块CEUS 0级增强,其中8例弹性蛋白形态呈波浪状、5例呈平直或断裂状,MVD为(6.39±2.14)条/mm2;10例Ⅰ级增强,其中4例弹性蛋白形态呈波浪状,6例呈平直或断裂状,MVD为(10.38±2.87)条/mm2;37例Ⅱ级增强,其中8例弹性蛋白形态呈波浪状,29例呈平直或断裂状,MVD为(12.84±3.77)条/mm2。不同增强等级斑块之间,弹性蛋白形态差异有统计学意义(χ2=7.14,P=0.03)。斑块CEUS增强等级与MVD呈正相关(r=0.62,P<0.01)。
2.3 CEUS判断斑块易损性的效能 60例接受CEA患者中,39例为易损斑块,其中0及Ⅰ级增强各5例,29例Ⅱ级增强;21例为稳定斑块,其中0及Ⅱ级增强各8例,5例Ⅰ级增强。以病理结果对照,根据Ⅱ级CEUS增强判断斑块易损性的敏感度为74.36%,特异度为61.91%,阳性预测值为78.00%,阴性预测值为57.00%。
3 讨论
颈动脉粥样硬化斑块可分为稳定性和易损性斑块。稳定性斑块脂核较小、纤维帽厚,不易破裂并引发急性脑血管事件;易损性斑块多易出血、破裂、形成血栓,斑块脱落甚至可引起颅内栓塞。判断组织学定义的易损斑块的主要标准如下:①活动期炎症,炎症细胞增多、聚集,如单核-巨噬细胞浸润;②薄纤维帽覆盖较大脂核,纤维帽厚度<100 μm,脂核占比>40%;③内皮侵蚀伴血小板黏附、聚集于表面;④表面不平整,存在裂隙、损伤及血栓形成;⑤斑块引起管腔严重狭窄。其次要标准则包括:①钙化结节邻近纤维帽;②斑块于血管内镜下呈现黄色光泽;③斑块内出血;④内皮功能障碍;⑤血管正性重构等[4-5]。易损斑块破裂是临床事件的核心,为斑块内部组织结构和体内微环境与物理、化学、免疫、氧化应激及慢性感染等多种因素共同作用的结果。
斑块内血管内皮细胞通过出芽和增殖等过程产生新生血管,呈螺旋状,是导致斑块破裂的重要因素[6]。多数新生血管由单层内皮细胞构成,细胞间无紧密连接结构,基底膜连续性不佳甚至中断,周围无具有支撑作用的结缔组织,故炎症细胞可进入细胞外基质[5]。炎症细胞渗出又可激活细胞因子,诱导巨噬细胞及平滑肌细胞凋亡;还可激活释放基质金属蛋白酶,分解胶原纤维而引起斑块破裂。另一方面,由于斑块内部分新生血管增殖受阻、血管壁不完整,易发生破裂,导致斑块内出血。
CEUS以背向散射原理[5]为基础,以与软组织回声不同、声阻抗不同的含气微泡为造影剂,采用二次谐波成像技术显示斑块内新生血管,增强了对脏器或病变的显示能力,可实时显示实质性脏器的血供情况。本研究症状组与非症状组斑块CEUS增强等级具有显著差异,症状性颈动脉斑块内造影剂微气泡灌注显著增多、血流信号显著增强,提示症状性颈动脉斑块内新生血管更为丰富。新生血管不同于正常血管[7],易发生破裂出血,增加斑块易损性,引发相关临床表现。CEUS能较好地显示斑块内新生血管,且其参数与斑块回声、表面溃疡及斑块内出血具有相关性[8]。SHAH等[9-11]指出,CEUS可量化评价斑块内新生血管,CEUS所见与CD31染色所示血管具有较高正相关性。CD31是跨膜糖蛋白,主要表达于血管内皮细胞,可标记颈动脉斑块内新生血管[12]。本研究结果显示,斑块CEUS增强等级与其内MVD呈正相关,CEUS增强程度越高,代表新生血管越多,提示斑块易损性越高,越易破裂出血而引发严重心、脑血管意外;且斑块内新生血管数量与CD34、CD3、CD68、组织蛋白酶L、基质金属蛋白酶(matrix metalloproteinase, MMP)-2及 MMP-9均呈正相关[9,11]。
综上所述,症状性颈动脉斑块新生血管较多,CEUS增强等级与斑块内新生血管数量及弹性蛋白形态有关;CEUS评价颈动脉粥样硬化斑块的效能较高。
