不同生产企业元胡止痛片质量评价与探索性研究
2021-06-28高宇明肖开春李华仙吴秀清
高宇明,肖开春,刘 森,李华仙,李 丹,吴秀清
(四川省资阳市食品药品检验检测中心,四川 资阳 641399)
元胡止痛片由醋延胡索、白芷组方,有理气、活血、止痛功效,临床主要用于气滞血瘀的胃痛、胁痛、头痛及痛经,为常用非处方药。目前其被收载于2015 年版《中国药典(一部)》(2020 年版无修订,简称《药典》)及《国家食品药品监督管理局药品补充检验方法和检验项目批准件2014004》(简称《局颁标准》),有糖衣片和薄膜衣片2 种剂型。为了客观评价其质量,本试验中从四川省内流通、使用单位中抽取样本,按法定标准对延胡索及白芷进行薄层鉴别,并测定延胡索乙素及欧前胡素的含量,以及进行染色剂金胺O 等项目检测,并围绕药品的安全性和有效性开展了标准外研究和评价,旨在查找潜在的药品质量安全隐患。现报道如下。
1 仪器与试药
1.1 仪器
1260 型高效液相色谱仪(配 DAD 检测器),1200 型高效液相色谱仪(配UV 检测器),均购自美国Agilent公司;UltiMate 3000 型高效液相色谱仪,配WVD 检测器(美国 Thermo Fisher 公司);ICP -mass Spectrometer NexIon 2000 型电子耦合等离子体质谱仪(美国PerkinElmer 公司);XSE205DU 型电子分析天平(十万分之一,瑞士Mettler Toledo 公司);SB25 - 12D 型超声波清洗器(宁波新芝生物科技股份有限公司);DZKW-4 型水浴锅(北京中兴伟业世纪仪器有限公司);DHG 型烘箱(上海精宏实验设备有限公司);WARS-XPRESS 型微波消解仪(美国 CEM 公司);STEHDB -107 -1 型二氧化硫残留量测定仪(济南盛泰电子科技有限公司);Camag Linomat 5 型薄层展开系统(瑞士Camag 公司)。
1.2 试药
延胡索对照药材(批号为120928-201609),白芷对照药材(批号为120945-201510),延胡索乙素对照品(批号为 110726-201819,含量为 99.8%),异欧前胡素对照品(批号为 110827-201812,含量为 99.6%),盐酸巴马汀对照品(批号为 110732-201611,含量为86.8%),欧前胡素对照品(批号为 110826 -201818,含量为99.6%),盐酸小檗碱对照品(批号为110713-201212,含 量 为 86.7% ),金 胺 O 对 照 品 (批 号 为111770-201603,含量为 100.0%),对乙酰氨基酚对照品(批号为 10008 -201610,含量为 99.9% ),阿司匹林对照品(批号为100173-201706,含量为 99.8%),萘普生对照品(批号为 100198-201706,含量为 99.9%),双氯芬酸钠对照品(批号为 100334-201803,含量为99.9%),吲哚美辛对照品(批号为 100258 -200904,含量为99.9%),均购自中国食品药品检定研究院;延胡索甲素对照品(批号为ST05600120MG,含量≥98.0%),去氢紫堇碱对照品(批号为ST07380120MG,含量≥97.0%),均购自上海诗丹德生物技术有限公司;镉对照品(批号为 GSB04-1721-2004),铅对照品(批号为GSB04-1742-2004),砷对照品 (批号为 GSB04-1714-2004),铜对照品(批号为 GSB04-1725-2004),汞对照品(批号为GSB04-1729-2004),均购自国家有色金属及电子材料分析测试中心;内标溶液(美国PerkinElmer 公司,含铋、锗、铟、锂、钪、铽,批号为N9303832,规格均为 10 μg /mL);硅胶 G 薄层板(青岛海博生物技术有限公司);甲醇和乙腈为色谱纯,其余试剂均为分析纯,水为纯化水。
国家药品监督管理局数据库中元胡止痛片批号最多的省份为四川(25 个),故本研究中选取在四川省内流通的元胡止痛片197 批次,覆盖全国7 个省、自治区、直辖市的共21 家生产企业(主要集中在四川、广西和河南),排除同厂家同批号样品后共得样品100 批,详见表1。剂型包括糖衣片180 批次(规格为片芯质量0.25 g)、薄膜衣片17 批次(规格为每片质量0.26 g),分别占总批次的 91.37% 和 8.63% 。

表1 各元胡止痛片抽样批次信息Tab.1 Information of sampling batches of Yuanhu Zhitong Tablets from different manufacturers
对上述21 家生产企业均发函调研,收回14 家生产企业的资料,调研结果显示,各企业所使用的原辅料不完全相同、部分工艺参数有差异。如处方中醋制延胡索,来源分为外购和自行炮制,且各生产企业执行炮制规范不一致,炮制方法及辅料用量均存在差异。压片时各企业加入的辅料种类不同,包括硬脂酸镁和氢氧化铝,滑石粉或硬脂酸镁,硬脂酸镁和羧甲基淀粉钠等。元胡止痛片为常用止痛类中成药,存在非法添加化学药物风险。
2 方法与结果
2.1 延胡索、白芷薄层鉴别
薄层色谱条件及溶液制备参照2015 年版《中国药典(一部)》[1]。16 家生产企业的 81 批次样品,需加大取样量和点样量才能全部检出与延胡索对照药材及白芨对照药材相应的主斑点,且不同生产企业样品斑点大小及颜色深浅有一定差异。
2.2 延胡索乙素和欧前胡素含量测定
采用高效液相色谱法测定,色谱条件及溶液制备参照 2015 年版《中国药典(一部)》[1]规定:“本品每片含醋延胡索以延胡索乙素(C21H25NO4)计,不得少于 75 μg;含白芷以欧前胡素(C16H14O4)计,不得少于 50 μg”。方法学考察结果中,精密度、稳定性、重复性试验的 RSD 均小于2.0%,延胡索乙素、欧前胡素平均加样回收率分别为 98.90%和 99.60%,RSD 分别为 0.88%和 1.44%。197 批次样品均符合规定,结果见表2。不同生产企业的样品间含量差异较大,A,R 生产企业的样品中延胡索乙素含量批间差异大,C,D,K,R 生产企业的样品中欧前胡素含量批间差异大(见图1),可能是醋延胡索和白芷药材质量差异大、醋延胡索炮制工艺不一致等原因所致。
2.3 染色剂金胺O 检测
采用高效液相色谱法检测,色谱条件及溶液制备参照《局颁布标准》。系统适用性试验结果表明,供试品溶液色谱中,在与对照品溶液色谱相应处有吸收峰,阴性对照无干扰,色谱图见图2。方法学考察结果中,精密度、稳定性、重复性试验的 RSD 均小于2.1%,平均加样回收率为 100.10% ,RSD 为 1.25% 。有 5 批次(3 个批号)元胡止痛片检出金胺O,均源于R 生产企业。

表2 样品含量测定结果(μg/片,n =2)Tab.2 Content determination of tetrahydropalmatine and imperatorin in the samples(μg /table,n = 2)

图1 样品含量箱式图A.Tetrahydropalmatine B. ImperatorinFig.1 Box diagram of tetrahydropalmatine and imperatorin content in the samples
2.4 标准外研究
2.4.1 重金属及有害元素检测
按 2015 年版《中国药典(四部)》通则 2321“铅、镉、砷、汞、铜测定法第二法—— 电感耦合等离子体质谱法”检验;供试品溶液用微波消解制备。参照2015 年版《中国药典(一部)》中药材的限量,197 批次样品合格率为100.0%。
2.4.2 二氧化硫残留量检测
经查阅文献,延胡索与白芷在加工过程中均存在硫熏现象[2-3],在产地调研中发现,上述 2 种药材(尤其是白芷)在产地加工时,加工户均有使用硫磺熏蒸晒干习惯。硫磺熏蒸会破坏中药材有效成分,降低疗效,在2015 年版《中国药典(一部)》中也对白芷的二氧化硫残留量进行了限制。元胡止痛片处方中,30%的白芷为原粉入药,极易将药材中的毒性物质引入制剂,而在制剂中未有相关规定,存在安全风险。
本研究中取样品粉末约5 g,精密称定,按2015 年版《中国药典(四部)》二氧化硫残留量测定法(通则2331)第一法—— 酸碱滴定法检测[4],197 批样品中二氧化硫含量介于0 ~88 mg/kg,其中85 批检出二氧化硫。参照2015 年版《中国药典(四部)》通则0212 中“药材及饮片(矿物类除外)的二氧化硫残留量不得过150 mg/kg”的规定,按原药材到制剂中80%转移率计算,拟订二氧化硫残留量限度为不得过40 mg/kg,100 批样品中有16 批(16%)不合格。
2.4.3 止痛成分[5]检测
色谱条件:色谱柱为 Waters XSelect HSS T3柱(250 mm × 4.6 mm,5 μm);流动相为 0.05 mol/L 乙酸铵-乙腈,梯度洗脱(0 ~25 min 时 10%→35%乙腈,25 ~ 45 min 时 35% →65% 乙腈,45 ~ 55 min 时 65% →90% 乙腈);流速为 1.0 mL /min;检测波长为 280 nm;柱温为30 ℃;进样量为10 μL。色谱图见图3。
溶液制备:称取对乙酰氨基酚对照品10.11 mg、阿司匹林对照品9.67 mg、萘普生对照品9.77 mg、双氯芬酸钠对照品9.82 mg、吲哚美辛对照品9.53 mg,精密称定,置同一100 mL 棕色容量瓶中,加甲醇溶解并定容,摇匀,即得贮备溶液;精密量取10 mL,置100 mL 棕色容量瓶中,加甲醇定容,即得混合对照品溶液。取样品6 片,除去包衣,研细,取约 1.0 g,精密称定,置50 mL 容量瓶中,加甲醇40 mL,超声(功率250 W,频率45 kHz)处理1 h,冷却至室温,用甲醇定容,摇匀,滤过,取续滤液,即得供试品溶液。按元胡止痛片处方及工艺制备阴性样品,按供试品溶液制备方法制备阴性对照品溶液。
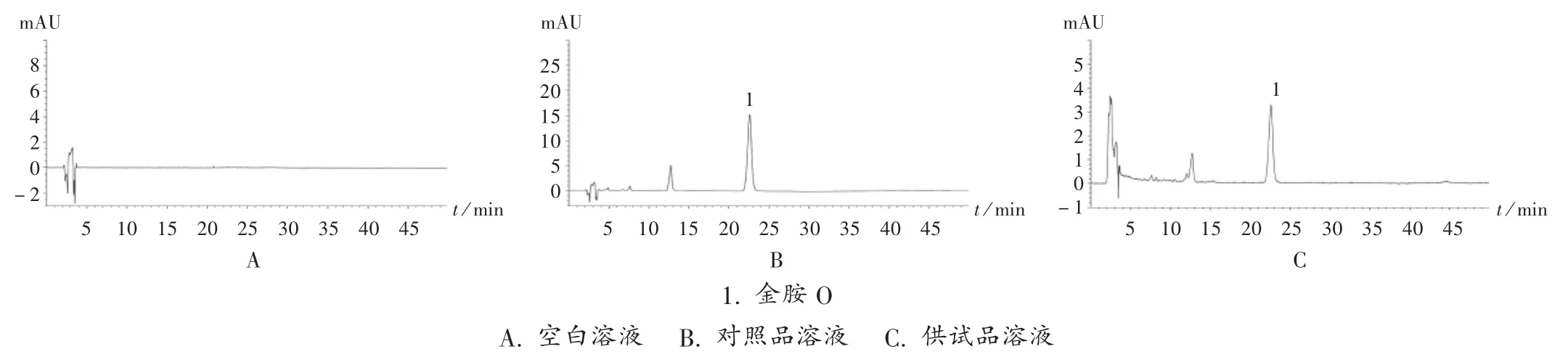
图2 元胡止痛片中金胺O 检验高效液相色谱图1. auramine OA.Blank solution B.Reference solution C. Test solutionFig.2 HPLC chromatograms for determination auramine O in Yuanhu Zhitong Tablets
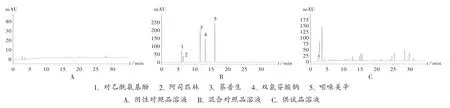
图3 止痛成分含量测定高效液相色谱图1.paracetamol 2.aspirin 3.naproxen 4.diclofenac sodium 5.indomethacinA.Negative reference solution B. Mixed reference solution C.Test solutionFig.3 HPLC chromatograms for content determination of analgesic components
方法学考察:制备系列质量浓度混合对照品溶液,按上述色谱条件测定,记录峰面积。以对照品进样量(X,μg)为横坐标、峰面积积分值( Y)为纵坐标进行线性回归,结果见表3。取混合对照品溶液,依法连续进样6 次,记录峰面积,结果对乙酰氨基酚、阿司匹林、萘普生、双氯芬酸钠、吲哚美辛的 RSD 分别为 1.25% ,1.74%,0.74%,0.79% ,0.72% (n =6),表明仪器精密度良好。取已知含量的样品6 份,精密称定,分别置具塞锥形瓶中,分别精密加入不同量的对照品溶液,依法进样测定,结果各成分的回收率和 RSD 分别为,对乙酰氨基酚 99.00%和 0.81%,阿司匹林 98.01%和 2.48%,萘普生98.79%和0.62%,双氯芬酸钠98.58%和0.77%,吲哚美辛 98.12%和 0.65%(n =6),表明方法回收率良好。

表3 各止痛成分回归方程与线性范围Tab.3 Regression equation and linear range of each analgesic component
样品测定:取21 家企业生产的100 批元胡止痛片样品,依法制备供试品溶液,并进样测定,结果均未检出对乙酰氨基酚、阿司匹林、萘普生、双氯芬酸钠、吲哚美辛。
3 讨论
本研究中,市场流通的元胡止痛片金胺O 检测合格率达97.46%,仅5 个批次(3 个批号)样品检出金胺O,说明通过药品补充检验方法的多年应用,延胡索染色现象得到了较好控制。但通过标准外研究,开展质量分析和评价,显示目前元胡止痛片质量方面仍存在一些问题,包括标准延胡索薄层鉴别展开系统分离度较差,需改进;部分生产企业的样品中延胡索薄层鉴别未检出全部主斑点;指标成分延胡索乙素、欧前胡素含量差异大。分析原因可能有以下几点:一是原料药材质量差异。文献报道显示,不同产地延胡索有效成分含量差异明显[6],炮制前后含量也会产生较大变化[7]。各生产企业执行炮制规范不一致,炮制方法及辅料用量也存在差异。二是部分企业可能存在少投或不投延胡索的违规生产行为。三是生产过程中原料混合不均匀,导致同一生产企业不同批号的含量测定结果差异大。
针对发现的质量问题,建议修订元胡止痛片中延胡索的薄层鉴别方法;生产企业应严格控制原料药材质量,并按处方和工艺投料生产;中药制剂含量均匀性问题由多种原因导致[8],其中之一就是缺乏相关国家标准,而目前已有成熟的中成药的含量均匀度检测方法[9-10],建议国家加快制订中药制剂含量均匀度标准;各地监管部门也要加强日常监管,尤其是生产过程的监管。此外,建议关注中成药中二氧化硫残留问题。目前对于硫磺熏蒸中药材质量的研究报道较多[11-12],但对于中成药中二氧化硫残留及其危害相关的研究较少,存在安全风险。
