熟地黄标准汤质量标准及高效液相色谱指纹图谱研究*
2021-06-28王雯梁馨月薛佩芸
王雯 ,杨 锦 ,梁馨月 ,薛佩芸 ,陈 萍 ,△
(1. 陕西中医药大学,陕西 咸阳 712046; 2. 兵器工业卫生研究所,陕西 西安 710065; 3. 陕西省中医药研究院,陕西 西安 710003)
熟地黄是由玄参科植物地黄 Rehmannia glutinosa Libosch. 的新鲜或干燥块根经酒炖法或蒸法制成,为生地黄炮制加工品,性微温,归肝、肾经,有补血滋阴、益精填髓之功效,常用于治疗精血不足和肝肾阴虚等证[1-2]。熟地黄含有环烯醚萜苷类、苯乙醇苷类、糖类、氨基酸类、金属离子等多种化学成分[3]。2020 年版《中国药典(一部)》中收载的含熟地黄的成方制剂有151 种。《中医方剂大辞典精选本》中含熟地黄的方剂有739 首,且熟地黄常与补益药、清热药、活血化瘀药、利水渗湿药、收涩药、温里药配伍[4-5],常入四物汤、六味地黄汤等中医经典汤剂。“汤者荡也,去大病用之。”说明中药饮片制成汤剂内服吸收快、药效发挥迅速,且可随证加减。本研究中依据《中药配方颗粒质量控制与标准制定技术要求》,确定标准汤作为中药配方颗粒的研究参照物,通过测定熟地黄中地黄苷D 含量,以出膏率、总多糖含量、转移率为质量评价指标,建立高效液相色谱指纹图谱,为熟地黄标准汤的质量控制提供参考。现报道如下。
1 仪器与试药
1.1 仪器
1260 型高效液相色谱仪(美国Agilent 公司);U-2910 型紫外 -可见分光光度计(日本 Hitachi 公司);BT25S 型电子天平(精度为十万分之一)、BS210S 型电子天平(精度为万分之一),均购自赛多利斯科学仪器(北京)有限公司;CP2102 型电子天平(奥豪斯仪器<常州>有限公司,精度为百分之一);RM2135 型轮转切片机(德国Leica 公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);202V1 型电热恒温干燥箱(上海实验仪器厂有限公司);YF111 型高速粉碎机(江阴市创新机械设备有限公司,容量为100 g)。
1.2 试药
地黄苷D 对照品(上海源叶生物科技有限公司,批号为L21O10Y100752,含量≥98 %);桃叶珊瑚苷对照品(批号为111761-200601,含量≥98%),D-无水葡萄糖对照品(批号为 110833-201908,含量≥99.8%),均购于中国食品药品检定研究院;甲醇、磷酸为色谱纯,其余试剂均为分析纯,水为超纯水。15 批熟地黄饮片,按2020 年版《中国药典(一部)》熟地黄项下要求,进行基原、形状、显微、薄层层析鉴别,经陕西省中医药研究院杨智峰教授鉴定为正品;进行水分、总灰分、酸不溶性灰分检查,并测定浸出物及毛蕊花糖苷、地黄苷D 含量,详见表1。
2 方法与结果
2.1 标准汤制备
取15 批样品饮片各100 g,加热、煎煮2 次,第1 次加入7 倍量水,浸泡30 min,加热回流提取60 min,趁热滤过,收集滤液,第2 次加入6 倍量水,回流提取40 min,趁热滤过,合并 2 次滤液,并浓缩至 500 mL,得标准汤[6]。
2.2 干膏率计算
分别精密量取15 批熟地黄标准汤各5 mL,分别置恒重蒸发皿中,水浴蒸干,残渣于105 ℃干燥3 h,取出,分别置干燥器中放置30 min,称定质量,计算干膏率。干膏率(% )= 干膏质量(g)× 总体积(mL)/ [取样量 × 总生药量(g)]× 100% 。结果干膏率平均值为 67.01% ,详见表2。
2.3 总多糖含量测定
溶液制备:称取105 ℃干燥至恒重的无水葡萄糖对照品43.43 mg,精密称定,置25 mL 容量瓶中,加水溶解并定容,摇匀,制成质量浓度为 1.737 2 mg/mL 的葡萄糖对照品溶液。分别精密量取15 批标准汤各0.5 mL,分别置10 mL 离心管中,加8 mL 无水乙醇,涡旋混匀,放置过夜,离心,倾出上清液,沉淀用80%乙醇洗涤2 次;沉淀加水溶解,摇匀,定容,即得供试品溶液。

表1 15 批熟地黄饮片信息(%)Tab.1 Information of 15 batches of Rehmanniae Radix Praeparata(%)

表2 样品中干膏率及总多糖、地黄苷D 含量测定结果(%)Tab.2 Determination of dry extract rate,total polysaccharide and rehmannioside D content in the samples(%)
线性关系考察:精密量取葡萄糖对照品溶液0,0.2,0.4,0.6,0.8,1.2,1.6,2.0,3.0 mL,分别置 50 mL容量瓶中,加水定容,摇匀,制成质量浓度分别为 0,2.084 64,4.169 28,6.253 92,8.338 56,12.507 84,16.677 12,20.846 40,31.269 60 μg /mL 的系列对照品溶液。分别精密量取3 mL,各置10 mL 容量瓶中,加5%苯酚溶液1.0 mL,混匀,迅速滴加浓硫酸6 mL,涡旋混匀,50 ℃水浴40 min,取出,置水中,冷却至室温,混匀,以 0 μg/mL 为空白溶液,于 490 nm 波长处测定吸光度,以吸光度( Y)为纵坐标、质量浓度( X)为横坐标进行线性回归,得总多糖回归方程 Y =0.047 77X-0.022 82,R2=0.997 17(n =9)。结果表明,总多糖进样量在2.084 64 ~31.269 60 mg 范围内与吸光度线性关系良好。
含量测定:分别精密量取2.1 项下15 批标准汤各0.5 mL,分别置 10 mL 容量瓶中,加水 2.5 mL,摇匀。按标准曲线制备项下方法,自“加5 %苯酚溶液1.0 mL”起依法测定吸光度,计算含量,即得总多糖含量。结果总多糖含量平均值为3.58%,详见表2。
2.4 地黄苷D 含量测定
2.4.1 色谱条件
色谱柱:Diamonsil C18柱(250 mm ×4.6 mm,5 μm);流动相:甲醇 -0.1 % 磷酸溶液(5 ∶95,V / V);流速:1.0 mL /min;检测波长:203 nm;柱温:23 ℃[1];进样量:10 μL[7-8]。
2.4.2 溶液制备
取地黄苷D 对照品适量,精密称定,以25 %甲醇溶解,制成地黄苷 D 质量浓度为 76.6 μg /mL 的对照品溶液。分别精密量取2.1 项下15 批标准汤各5 mL,水浴蒸至近干,残渣用25%甲醇溶解,移至10 mL 容量瓶中,加流动相定容,摇匀,滤过,取续滤液,即得供试品溶液。精密量取水10 mL,同供试品溶液制备方法制备阴性对照品溶液。
2.4.3 方法学考察
系统适用性试验:取地黄苷D 对照品溶液和供试品溶液各适量,按2.4.1 项下色谱条件进样测定。结果理论板数以地黄苷D 峰计大于5 000,与相邻色谱峰分离度均大于1.5。详见图1。
专属性试验:取地黄苷D 对照品溶液和阴性对照品溶液各适量,按2.4.1 项下色谱条件进样测定。结果阴性对照品溶液色谱图中,在与地黄苷D 对照品溶液色谱相同保留时间(30.3 min)处无干扰峰,表明专属性良好。详见图1。

图1 高效液相色谱图1.rehmannioside DA. Reference solution B.Test solution C.Negative reference solutionFig.1 HPLC chromatograms
线性关系考察:分别精密量取地黄苷D 对照品溶液 0.1,0.5,0.8,1.0,1.2,1.6,2.0 mL,置 10 mL 容量瓶中,加25%甲醇定容,摇匀,制成系列对照品溶液。按2.4.1 项下色谱条件进样 10 μL 测定,记录峰面积。以地黄苷 D 质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程 Y =5.614 15 X +4.563 44,R2=0.999 98(n =7)。结果表明,地黄苷 D 进样量在15.32 ~306.40 mg 范围内与峰面积线性关系良好。
精密度试验:取地黄苷D 对照品溶液和2.4.2 项下供试品溶液各10 μL,按2.4.1 项下色谱条件连续进样测定6 次,记录峰面积。结果的 RSD 分别为0.89%和 0.64%(n =6),表明仪器精密度良好。
稳定性试验:取2.4.2 项下供试品溶液,分别于室温下放置 0,2,4,8,12,16,24 h 时按 2.4.1 项下色谱条件进行测定,记录峰面积。结果的 RSD 为 0.87%(n =7),表明供试品溶液在室温放置24 h 内基本稳定。
重复性试验:取标准汤 5 mL,共 6 份,按 2.4.2 项下方法制备供试品溶液,按2.4.1 项下色谱条件进样测定,记录峰面积,并计算地黄苷D 含量。结果地黄苷D平均含量为 0.118 mg/mL,RSD 为 1.85 % (n =6),表明方法重复性良好。
加样回收试验:取已知含量的标准汤(批号为20200201)0.5 mL,共 9 份,分别精密加入地黄苷 D 对照品溶液(61.28 μg /mL)0.5,1.0 mL,地黄苷 D 对照品溶液(122.56 μg /mL)0.7 mL,按 2.4.2 项下方法制备供试品溶液,再按2.4.1 项下色谱条件进样测定,并计算回收率。结果见表3。
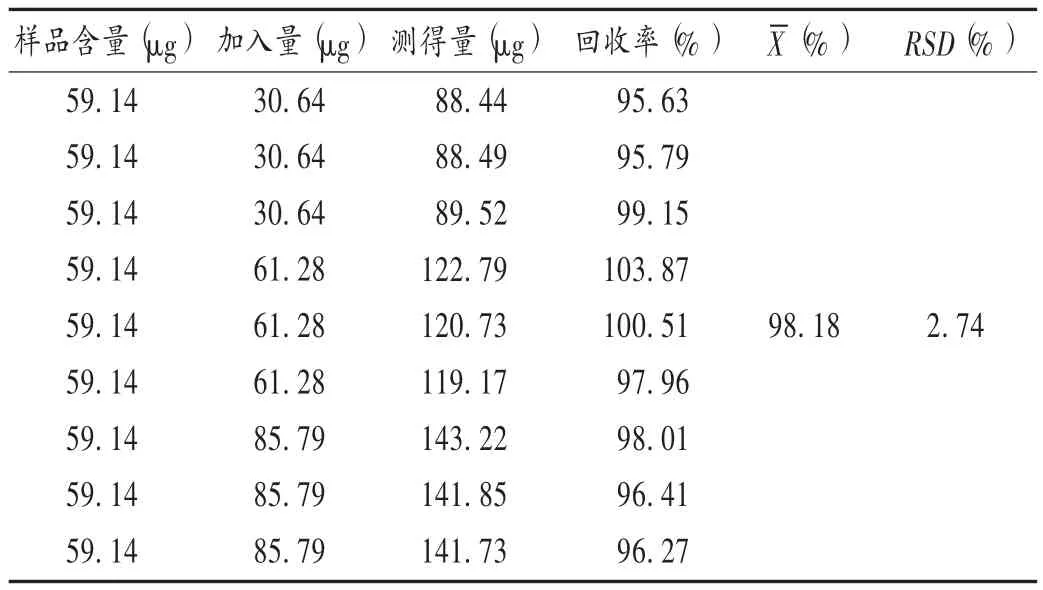
表3 加样回收试验结果(n =9)Tab.3 Results of the recovery test(n = 9)
2.4.4 样品含量测定
取15 批地黄标准汤各适量,分别按2.4.2 项下方法制备供试品溶液,再按2.4.1 项下色谱条件进样测定,记录峰面积,并计算标准汤、饮片中地黄苷D 含量及转移率[9-10]。转移率(% )= 本项指标成分中含量 /饮片(上一环节)中指标成分含量×100%。结果标准汤、饮片中地黄苷D 平均含量分别为0.064%和0.087%,转移率平均值为74.275%,详见表2。
2.5 高效液相色谱指纹图谱建立
溶液制备方法及方法学考察同2.4 项。取15 批熟地黄标准汤适量,按2.4.2 项下方法制备供试品溶液,按2.4.1 项下色谱条件进样测定,将15 批熟地黄标准汤的色谱图数据导入“中药色谱指纹图谱相似度评价系统(2004A 版)”,以参照图谱为 S1,时间宽度设为 0.10,采用多点校正,自动匹配,生成对照图谱(R),计算相似度,详见图2、图3 和表4。结果15 批熟地黄标准汤指纹图谱相似度与对照图谱相似度均大于0.95,表明一致性很好[11-15]。

图2 15 批熟地黄标准汤的高效液相色谱叠加指纹图谱Fig.2 HPLC superimposed fingerprint of 15 batches of Rehmanniae Radix Praeparata standard decoction

图3 熟地黄标准汤高效液相色谱对照指纹图谱1.aucubin 2.rehmannioside DFig.3 HPLC reference fingerprint of Rehmanniae Radix Praeparata standard decoction
3 讨论
3.1 色谱条件选择
本研究中参考了 2020 年版《中国药典(一部)》[1]熟地黄项下地黄苷D 的含量检测色谱条件,并综合比较峰形、分离度、出峰时间等参数,流动相体系选择与药典一致[甲醇 - 0.1% 磷酸溶液(5 ∶95,V / V)],在 203 nm波长处检测。
3.2 特征成分及参数范围确定
熟地黄标准汤中地黄苷D 提取率高、转移率稳定,能表征提取物的均一性,因此采用地黄苷D 为质量评价的定量指标成分[9,16]。按 15 批熟地黄标准汤以各参数均值的75% ~125%计,参数范围为,出膏率 50.26% ~83.76%,地黄苷 D 转移率 55.700% ~ 92.833% ,各项实测值均在标准汤参数范围内,表明熟地黄标准汤质量均一性好[16-17]。

表4 15 批熟地黄标准汤高效液相色谱指纹图谱相似度评价Tab.4 Similarity of HPLC fingerprints of 15 batches of Rehmanniae Radix Praeparata standard decoction
2015 年版《中国药典(一部)》熟地黄项下含量测定项为毛蕊花糖苷的检测,由于毛蕊花糖苷含量在地黄中仅为万分之二,且在炮制过程中极不稳定,易发生降解和转化。针对此问题,国家通过立项研究与评价抽验结合,将毛蕊花糖苷换成有滋阴、补血及降血糖活性且含量较高、性质更稳定的地黄苷D 作为熟地黄的含量测定指标[18]。
综上所述,所建立的质量标准及高效液相色谱指纹图谱可为熟地黄标准汤的质量评价提供参考。
