胎鼠真皮成纤维细胞皮内注射对UV诱导小鼠皮肤光老化的改善作用
2021-06-28雷铁池韩冰玉姚云竹廖志凯胡双海
邱 勰 雷铁池 韩冰玉 姚云竹 廖志凯 胡双海
武汉大学人民医院皮肤性病科,湖北武汉,430060
皮肤老化一般被分为自然老化和光老化,通常具有皱纹形成、皮肤松弛、色素沉着等改变。目前临床上已经采用了如光子嫩肤、玻尿酸注射等方式来预防或延缓皮肤老化,但具有时效短、不良反应多等局限性[1]。有研究发现,在人眶周皮肤注射自体培养FBs后,皮肤张力明显改善[2],这表明细胞注射治疗在改善皮肤老化方面已经表现出一定的价值。
最近,用单细胞RNA测序技术(single-cell RNA sequencing)发现人和鼠的真皮FBs存在异质性。位于真皮浅层的乳头层成纤维细胞(papillary FB)和位于深层的网状层成纤维细胞(reticular FB)在细胞表型和生物学功能上有较大差异[3,4]。网状层FBs比乳头层FBs分泌胶原蛋白的能力更强,而乳头层FBs的增殖能力比网状层FBs强[4]。随着皮肤老化,乳头层FBs逐渐消失。还发现体外培养的乳头层FBs分泌基质金属蛋白酶(MMPs)的能力在老年人中明显高于年轻人[4]。由于小鼠胚胎第18.5天(E18.5)[5]的真皮含乳头层FBs高达81.8%[4]。我们的假说是自胎鼠(E18.5)皮肤分离培养FBs,经CM-Dil荧光染料活细胞标记后皮下注射至光老化小鼠的皮肤,检查同种异体小鼠FBs注射是否具有抗老化作用,旨在探索下一步用自体真皮成纤维细胞治疗(autologous dermal fibroblast therapy)抵抗人皮肤衰老的可行性与机制。
1 材料与方法
1.1 材料收集 取BALB/c健康雄性小鼠20只(购自湖北省动物实验中心),随机分为:未处理组5只、仅做照光处理的模型组5只、照光处理后注射PBS的空白组5只、照光后进行细胞治疗的治疗组5只,所有小鼠均用冰王脱毛膏脱去背部5 cm×6 cm面积的毛发。每个组的5只小鼠并于同一笼,饲养于25℃室温中,予以相同的无菌食用水和饲料喂养,并维持12 h光照的昼夜节律。
1.2 紫外线照射构建老化模型 每日用0.6 J/cm2剂量的UVA和60 mJ/cm2剂量的UVB于模型组、空白组和治疗组小鼠裸露皮肤区正上方30 cm处,每日混合照射1次,持续8周,以鼠背部出现皮肤粗糙增厚,皱褶显著,色素明显加深体征表示造模成功。
1.3 鼠FBs体外培养及CM-Dil荧光染料活FBs标记
1.3.1 胎鼠FBs体外培养 取胎鼠(E18.5)10只,活力碘中浸泡10 min,无菌剥离全层皮肤,在PBS中冲洗2~3次后将其剪成2 cm×4 mm皮片,与4℃条件下在0.25%Dispase酶中消化12 h后,机械分离表皮和真皮。将真皮剪碎,加入含有EDTA的胰蛋白酶于37℃培养箱中消化15 min,用含10%FBS的培养基终止消化,1000 rpm离心5 min后弃上清。用含10% FBS的DMEM培养基重悬,在37℃、5% CO2条件接种于培养皿中,每隔两日进行细胞换液。
1.3.2 FBs标记 参考Reichenberger等[6]的方法给FBs进行染色标记,取原代培养的FBs,在含有EDTA的胰蛋白酶中于37℃环境下消化5 min后用含10%FBS的等量培养基终止消化,1000 rpm离心5 min,弃上清,1 mL PBS重悬制成细胞悬液,以2 μM/mL的终浓度加入CM-Dil染料(thermo fisher,C7000),于37℃ CO2培养箱中孵育5 min,再于4℃环境下孵育15 min。孵育后1000 rpm离心5 min,弃上清,PBS洗涤2~3次,离心,弃上清,用培养基重悬细胞,接种于培养皿中,培养24 h,待细胞贴壁后用荧光显微镜观察细胞染色情况。
1.4 FBs注射处理
1.4.1 取已被CM-Dil荧光染料标记的约为5×105/mL密度的胎鼠FBs细胞悬液1 mL,用胰岛素针抽取对小鼠进行皮内注射,均匀注射5个皮丘,每隔3日对小鼠进行环钻取皮,并将取得的皮肤进行冰冻切片处理,于荧光显微镜下观察FBs在小鼠体内的存活情况,确定FBs在小鼠体内最为活跃的日期。
1.4.2 治疗组小鼠每隔5日用胰岛素针抽取1 mL已被标记的密度为5×105/mL的胎鼠FBs,进行皮内注射,每只小鼠均匀注射5个点,每个点约1×105个细胞,空白组用同样方法注射等量PBS处理,一共注射4次。
1.5 组织病理
1.5.1 切片处理 4次注射结束后将小鼠处死解剖,提取背部裸露皮肤,部分予以冰冻切片后观察荧光显色情况;部分用甲醛固定后石蜡包埋,切厚度约为4 μm的切片,进行HE、Masson染色。
1.5.2 HE染色 二甲苯将切片脱蜡,将已脱蜡的组织切片经由高浓度酒精到低浓度,最后入蒸馏水后放入苏木精溶液中5 min,在酸碱中分色数秒后流水冲洗1 h,再于70%和90%浓度的酒精中脱水10 min,最后用伊红染色3 min。染色后经纯酒精脱水,再应用二甲苯使其透明,树胶封片,显微镜下观察各组小鼠表皮及真皮厚度。
1.5.3 Masson染色 二甲苯将切片脱蜡,将已脱蜡的组织切片经由高浓度酒精到低浓度,最后入蒸馏水后,用Weigert铁苏木素染色液染色5 min,酸性乙醇分化10 s后流水冲洗1 h,再于Masson蓝化液中返蓝5 min,水洗,在丽春红品红染色液中染色8 min后用磷钼酸溶液洗涤2 min,放入苯胺蓝染色液中染色1 min。染色后经纯酒精脱水,再应用二甲苯使其透明,树胶封片,显微镜下观察对比各组小鼠真皮胶原形态。
1.5.4 皮肤新生胶原测定 精确称取湿重约5 g的组织,研磨后3000 rpm离心10 min,取上清。参照试剂盒说明书(购自武汉洁洋盛公司)用双抗体夹心法酶联免疫吸附试验检测小鼠皮肤样本中I型前胶原羧基端肽(PICP)的表达水平。

2 结果
2.1 体外培养FBs的形态以及注射后不同时间体内示踪FBs存活 FBs接种于培养皿12 h后可观察到部分贴壁,接种6~7天后细胞增长至80%以上;倒置荧光显微镜显示:2 μM/mL的终浓度下,CM-Dil染色的FBs细胞膜表达阳性,呈现明亮的红色荧光(图1)。

图1 1a:倒置显微镜明场镜头下观察的贴壁生长6~7日的胎鼠FBs(×100);1b:同一视野下用2 μM/mL终浓度的CM-Dil标记的FBs的荧光染色图像(×100);1c:merge图像;比例尺:100 μm
在小鼠皮内注射FBs后每隔3日环钻取皮进行冰冻切片,荧光显微镜下观察,可以见到第3日荧光强度最高,之后逐渐下降,到第9日几乎见不到荧光(图2),因此选择第3日处死各个实验组小鼠进行下一步试验。
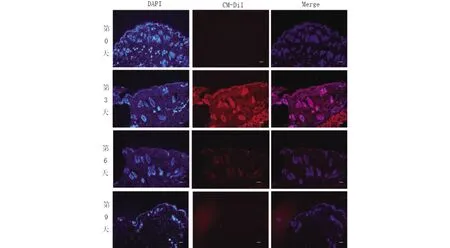
图2 荧光正置显微镜下观察CM-Dil标记的FBs在小鼠皮内存活情况,左列为DAPI标记荧光,中间列为CM-Dil标记荧光,右列为merge图像(×100);比例尺:100 μm
2.2 胎鼠FBs对光老化小鼠皮肤的改善作用
2.2.1 大体图对比 从大体图对照可见模型组、空白组和治疗组的小鼠背部裸露皮肤经紫外光照射后出现较明显皱纹、质地变厚、弹性减弱、干燥、色素沉着等改变,治疗组小鼠的背部裸露皮肤在连续4次胎鼠FBs注射后,相较空白组以及模型组小鼠皮肤皱纹深度相对较浅,空白组对比模型组小鼠皮肤老化情况无明显改善(图3)。
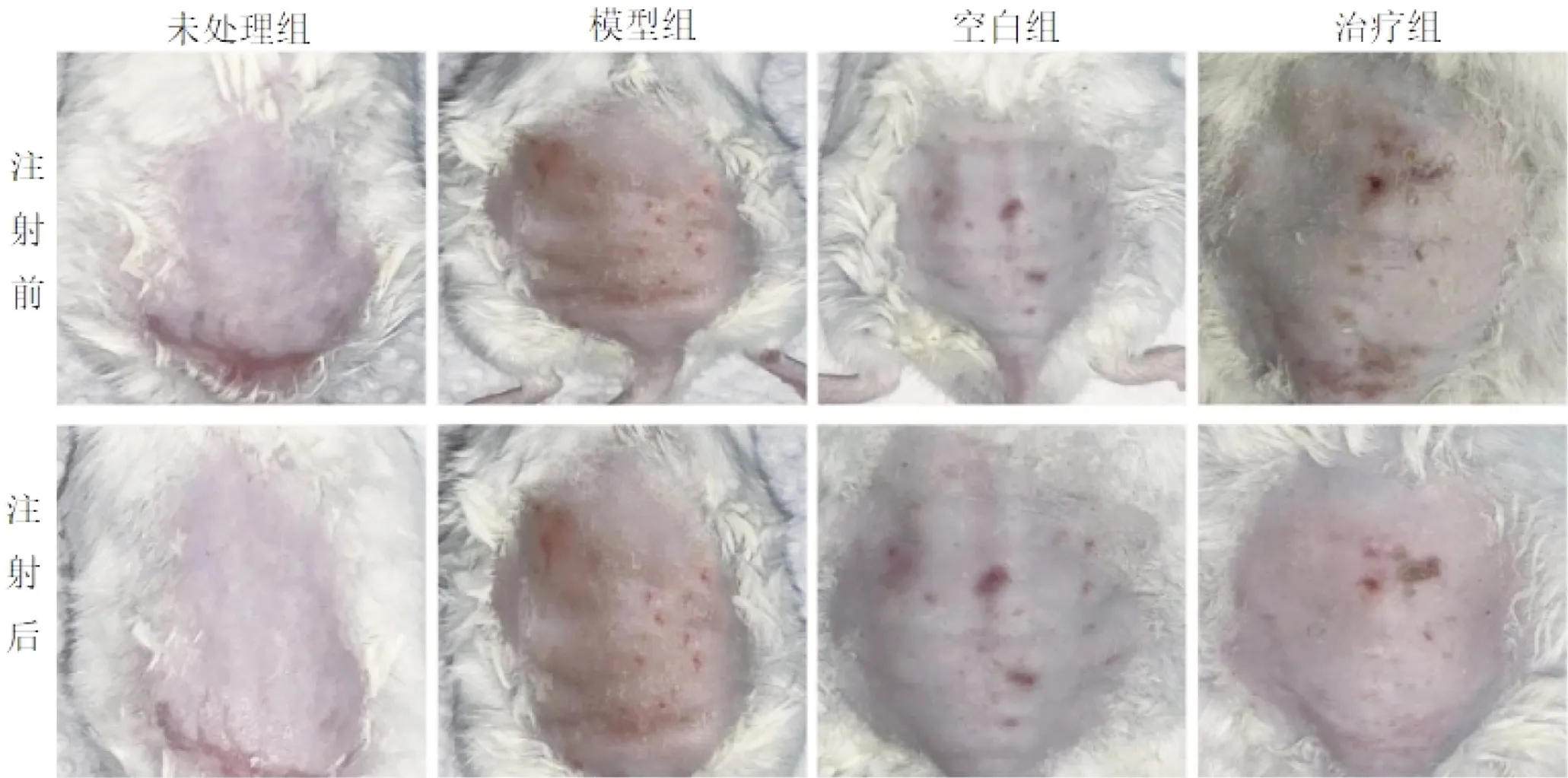
图3 注射治疗前后各组小鼠背部皮肤情况,每次注射1 mL注射物,予以分点在脱毛区域注射,共5个点,每个点200 μL(治疗组每个注射点约1×105个细胞)
2.2.2 荧光及免疫组化结果 用免疫荧光检测法对各组小鼠的背部皮肤冰冻切片观察结果可见,治疗组的小鼠在4次注射后第3日可见背部明亮的红色荧光,其他3组小鼠红色荧光强度非常弱(图4)。

图4 荧光显微镜下观察注射处理后各组小鼠背部皮肤冰冻切片,A:未处理组,B:模型组,C:空白组,D:治疗组,最左列为DAPI染色结果,中间列为CM-Dil染色结果,最右列为merge图像(×100);比例尺:100 μm
HE染色结果提示,小鼠照光后表皮厚度明显增加(P<0.05),空白组和模型组小鼠的真皮厚度相比未处理组小鼠明显变薄(P<0.05),差异具有统计学意义;经FBs治疗后,小鼠皮肤的真皮厚度明显增厚,P<0.05,具有统计学意义(图5),但表皮厚度变化相比空白组变化不明显(表1)。

图5 5a~5d:分别为未处理组、模型组、空白组和治疗组。小鼠经照光后表皮均明显增厚(HE,×100)
表1 胎鼠FBs皮内注射对光老化小鼠表皮及真皮厚度的影响
Masson染色见模型组和空白组小鼠对比正常组胶原纤维断裂,明显紊乱,第4次注射FBs3日后,治疗组小鼠光损伤区域真皮层内变性、断裂的胶原纤维明显减少,并可见少量新生胶原(图6)。

图6 6a~6d:分别为未处理组、模型组、空白组和治疗组,可见模型组和空白组小鼠相对未处理组小鼠真皮层的胶原纤维明显疏松紊乱,注射FBs后断裂紊乱的胶原纤维明显减少(Masson染色,×100)
2.3 ELISA结果 FBs注射4次后,治疗组小鼠皮肤新生胶原浓度相比空白组和模型组明显增多,对比未处理组含量较低,差异均有统计学意义(P<0.05)。空白组小鼠和模型组小鼠PICP浓度无明显差异(P>0.05),且两组PICP浓度相对未处理组小鼠均降低,(P<0.05)。见表2。
表2 胎鼠FBs皮内注射对光老化小鼠真皮PICP表达水平的影响
3 讨论
长时间以来,人们一直认为FBs只不过是一群均一的负责产生胶原和弹性纤维蛋白以及细胞外基质的间充质细胞。近年来的研究发现真皮至少存在有两个FBs亚群,即乳头层FBs和网状层FBs,乳头层FBs有更高的细胞增殖和分化能力,并能调节毛囊等附属器再生[8,9],随着年龄增长,乳头层FBs表达减少[10],老化皮肤的乳头层FBs增加了基质金属蛋白酶的表达[4],导致乳头层的胶原大量断裂并排列紊乱,皮肤色素沉着,深层皱纹增加[11]。相反,网状层FBs数目增加,并能合成大量纤维状胶原蛋白(与疤痕FBs的类似)增加了皮肤僵硬度(stiffness)。最近有人提出用真皮的不同区域成纤维细胞(zonal dermal fibroblast)进行皮内填充注射,可获得较好的抗皮肤衰老的效果[2]。由于人类临床试验的伦理限制,我们选择了E18.5的胎鼠皮肤分离培养FBs,此时真皮含乳头层FBs细胞高达81.8%[4],观察注射胎鼠真皮FBs对老化小鼠皮肤的改善作用。
我们用紫外线(UVA联合UVB)照射建立小鼠皮肤老化模型,观察到老化小鼠背部皮肤相对于对照组出现皮肤皱纹、色素沉着、皮肤松弛等现象。皮内注射后CM-Dil荧光染料标记活FBs示踪试验显示,注射后第3天细胞存活最高,之后逐渐下降,到第9日几乎见不到荧光标记细胞。我们在此基础上进行实验,发现胎鼠FBs注射4次后从大体照片上能够观察到相对于模型组以及空白组小鼠背部皮肤皱纹明显变浅、炎症反应也相对较轻;HE和Masson染色可见真皮厚度明显增厚(P<0.05),胶原纤维的排列也更为紧密有序;I型胶原是真皮中维持皮肤张力和承受拉力的重要成分,在老化小鼠皮肤中,I型胶原明显减少,且形态表现粗细不等,分布不均[12]。而酶联免疫吸附试验的结果也进一步证实了胎鼠FBs的皮内注射有助于I型胶原的产生,从而改善皮肤老化。
本研究我们初步证实了胎鼠FBs对紫外线诱导的小鼠皮肤老化有改善作用,而胎鼠FBs中有较高比例的乳头层FBs,皮内注射胎鼠FBs可促进I型胶原蛋白的从头合成,改善了皮肤老化。是否人自体真皮乳头层FBs注射能成为抗皮肤衰老的新治疗手段仍待临床进一步证实。
