硫酸亚铁铵滴定法快速测定不锈钢原料铬铁合金中铬含量
2021-06-28李孟宽
陈 瑶,李 轩,伍 换,李孟宽
(阳江海关综合技术服务中心,广东 阳江 529500)
铬铁合金按其含碳量可分为高碳铬铁、中碳铬铁、低碳铬铁、微碳铬铁和超微碳铬铁,而高碳铬铁是生产不锈钢的重要原料。在炼钢工艺中,铬能改善钢的抗氧化性、耐蚀性,200系不锈钢含铬量约在16%,300系不锈钢含铬量约在25%,400系不锈钢含铬量约在14%[1]。因此,铬含量是衡量不锈钢质量的一项重要指标,决定其实际用途。
本文采用过氧化钠碱熔融法分解高碳铬铁标样,用硫酸亚铁铵滴定法测定其铬的含量,也对影响铬铁合金中快速测定铬的各种因素进行了选择试验,该方法反应现象明显,操作条件易掌握。
1 实验部分
1.1 仪器和试剂
过氧化钠;磷酸;硫酸(1+1);高锰酸钾溶液(1g/L);氯化钠溶液(100g/L);N-苯基邻氨基苯甲酸指示剂(2g/L,溶于2g/L无水碳酸钠溶液);硫酸亚铁铵标准滴定溶液(0.1000mol/L)。
上述溶液所用试剂均为分析纯,试验用水为超纯水。
普兰德 AS级滴定管(50mL)。
硫酸亚铁铵标准滴定溶液(0.1000mol/L)按GB/T601-2016[2]方法标定。

图1 普兰德 AS级滴定管
1.2 试验方法
称取试样0.100g,精确至0.0001g,放入预先盛有4g过氧化钠的50mL瓷坩埚中充分搅拌均匀,再加2g过氧化钠平铺覆盖表面,盖上坩埚盖。置于马弗炉中升温至660℃,保持9min后取出,并不断摇动使熔融物均匀附着于坩埚壁。稍冷后将坩埚放入预先盛有100mL温水的500mL烧杯中,盖上表面皿,剧烈反应后置于电炉上微热煮沸浸出熔融物。取下烧杯稍冷后加入40mL(1+1)硫酸和20mL1g/L高锰酸钾溶液酸化,微热搅拌至沉淀溶解后取出坩埚和盖并用水洗净。加入10mL磷酸,补液至200mL,加热煮沸8-10min。加入10mL 100g/L氯化钠溶液,煮沸至红色消失后再煮沸5min,取下冷却至室温,补液至250mL。同时带空白实验。

图2 用于样品加热的马弗炉
1.3 滴定分析测定
用硫酸亚铁铵标准滴定溶液滴定至接近终点时(青绿色),加N-苯基邻氨基苯甲酸指示剂5滴,继续滴定至试液由紫红色转变为亮绿色为终点。按下式计算铬的质量分数W%(Cr):
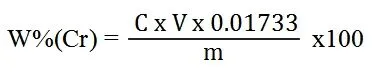
式中:
C—硫酸亚铁铵标准滴定溶液浓度,mol/L。
V—滴定时消耗的硫酸亚铁铵标淮滴定溶液体积,mL。
0.01733—1.00mL硫酸亚铁铵标准滴定溶液对铬的滴定度,g/mol。m—试液质量,g。

表1 铬含量的测定(%)
2 结果与讨论
2.1 制样与称样
样品按照GB/T4010-1994[3]的规定进行取制样,国标GB/T4699.2-2008[4]检测标准称取样量为0.500g,熔融后定容分液,大样称取可确保样品的均匀性,但过程较为繁琐。铬铁合金作为炼钢的重要合金添加剂,其原料呈粉末状,均匀性较好。如称取0.100g试样直接处理免去定容分液步骤,可提高效率。
2.2 试样分解的方法选择
国标和文献采用了各种分解试样,一般分为酸溶和碱熔两种方法,通常情况下酸溶比碱熔操作简便,对成分简单的铬铁矿分解效果较好,但对含一定量Mg、Al等高温元素的复杂铬铁,如高碳铬铁,用碱熔效果更好[5]。
2.3 熔融温度和时间的选择
过氧化钠能快速分解各类难熔的矿物、金属合金,过氧化钠加热至311-400℃时有少量活性氧释出,至500℃时开始熔化并有稍多的活性氧析出,636℃时完全释放出其活性氧,一般高于此温度就能达到较好的熔融效果,过氧化钠能将试样中的各种低价态元素氧化至高价态并形成络合物,同时其强碱性有利于络合物的形成与稳定,致使矿样的晶体结构彻底破坏而分解完全[6]。本实验以最易损耗的瓷坩埚为容器,研究在加热温度660℃-700℃和加热时间4-10min区间下样品的熔融情况,而过氧化钠具有腐蚀性,加热温度过高时间过长对容器有较大的损耗,对比下,660℃下加热9min效果最好。
2.4 倍离子氧化还原条件选择
熔融后浸出熔融物时,过剩的过氧化钠遇水会分解出过氧化氢,虽然稍加热后大部分会逸出但仍会有部分残留溶液中。当用酸酸化时,部分六价铬会被过氧化氢还原,为此必须加硝酸银和过硫酸铵补充氧化,这样不但延长了实验时间,而且也浪费药品。准确称取约0.2g试样,于镍坩埚中,加2g氢氧化钾,加盖(留缝隙),置小电炉上熔融30min,稍冷,用热水溶解熔块于300mL烧杯中(加热至全溶)。用快速滤纸除铁钛的氢氧化物沉淀,用热水洗涤4~5次,滤液与洗液收集于250mL磨口塞的锥形瓶中。加入8mL盐酸(浓),冷至室温,加入10nL硫酸(1+2),3mL磷酸(浓),2g碘化钾,加塞,摇动使其溶解。置暗处5min,开塞,用水洗涤瓶塞与瓶壁。用0.03mol/L硫代硫酸钠标准滴定溶液滴定至淡黄色,加入1mL淀粉溶液,继续用硫代硫酸钠标准滴定溶液滴定至由蓝色变为无色。实验中加入高锰酸钾溶液,当七价锰和六价铬同时存在,由氧化还原电位可知,过氧化氢首先会还原七价锰,只要七价锰有足够的量就可以保护六价铬不被还原。加入高锰酸钾后酸化并加热微沸一段时间完全出去过氧化氢,溶液颜色呈红褐色,说明高锰酸根存在,六价铬不会被还原。加入氯化钠溶液后,高锰酸根被还原,溶液颜色由红褐色逐渐转变为六价铬离子的橙黄色。由于反应会有Cl2生成,应煮沸至红色消失后再煮沸5min,否则滴定时会产生返终点现象[7]。煮沸冷却至室温后应尽快滴定,防止铬离子被还原导致结果偏低。
2.5 干扰及消除
硫酸亚铁铵滴定铬的主要干扰物质有V、Ce等高价元素,滴定过程中会消耗滴定标准溶液致结果偏高。铬铁合金经过熔炼,其V和Ce含量极低,对高含量Cr的测定影响甚微,可用N-苯基邻氨基苯甲酸作指示剂直接用硫酸亚铁铵滴定。若V、Ce含量大于0.5%时,如天然铬铁矿,可加入过量硫酸亚铁铵标准滴定溶液,以0.1%二苯胺磺酸钠作指示剂用KMnO4反滴定来消除其影响,滴定至溶液呈紫色为终点[8]。将滴铁后的溶液冷至20℃以下,加入5mL0.015mol/LEDTA 标准滴定溶液,3滴30%H2O2溶液,搅拌并放置1min。加1滴半二甲酚橙,用0.015mol/L硝酸铋标准滴定溶液滴至由黄色变为橙红色。需要注意的时,如果用KMnO4反滴定,熔融时不可用镍坩埚作为容器,因为熔融出来的镍离子会屏蔽二苯胺磺酸钠显色变化,终点不明显。
2.6 试样分析实验
取2种不同高碳铬铁标样,按实验方法各自独立地测定7次,方法精密度验证结果见表1。
表1 的结果可知,应用此方法对不同标样进行分析,反复验证后精密度和准确度都很好,在试样均匀的前提下没有出现复验情况,方法的测定结果表现稳定,能满足高碳铬铁的铬含量分析的精密度要求。
3 结论
采用该方法对高碳铬铁标准样品的铬含量进行分析的测定值和推荐值相符,能够满足铬铁合金样品的铬含量有关精密度和准确度的测定,且该法简单易操作。
