活性氧参与调控植物生长发育和胁迫应激响应机理的研究进展
2021-06-28祁伟亮孙万仓
祁伟亮,孙万仓,马 骊
(1.甘肃农业大学农学院,甘肃 兰州 730070; 2.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;3.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;4.甘肃省油菜工程技术研究中心,甘肃 兰州 730070;5. 成都师范学院化学与生命科学学院,特色园艺生物资源开发与利用四川省高校重点实验室,四川 成都 611130)
在全球气候变暖的背景下,我国局部地区极易发生大面积、持久性或短时间内的极端天气和气候事件(霜冻、冷害和干旱等),对作物(油菜、小麦、玉米等)的生长发育、产量和品质造成了严重影响[1]。但植物在漫长的进化过程中形成了一系列复杂且巧妙的机制来感知外部环境变化,从而激活相应的防御机制来适应环境选择,这即是达尔文的“物竞天择,适者生存”法则。当植物受到胁迫时,植物通过细胞膜上特定的分子感知外部环境变化,并发出“警报”信号。随后这些“警报”信号传递到细胞内部,最终到达细胞核,调节植物抗逆基因表达。但迄今为止,这种“警报”信息是什么,又是如何在细胞内传递尚不完全清楚。为此,当前的研究也迫切需要了解植物适应不利环境的分子响应机制,并通过分子育种提高作物的抗逆性和产量,有效缓解我国的粮食供给问题[2]。Gill和Tuteja[3]报道,胁迫诱导作物体内产生的活性氧(reactive oxygen species,ROS),过量的ROS打破细胞内氧化平衡关系,对细胞有很强的毒害作用。但随着对ROS的深入研究,人们发现适量的ROS对植物生长代谢也是有利的,还能作为关键信号分子激活第二信使、转录因子和改变酶活性来调控植物的生长发育[4],以及调控自身的胁迫响应和防御系统。值得注意的是,ROS是否会作为细胞损伤或信号传导因子,取决于ROS的产生与清除之间的平衡关系,而植物对ROS的清除能力也决定了植物细胞的抗逆防御能力。不难发现ROS似乎是一种“警报”信号,在植物信号传递及响应表达过程中扮演着重要的角色。那么细胞内、外的ROS来自于哪里?ROS信号又是怎么贯穿植物细胞进行信号传导呢?ROS怎样调控植物生长和形态建成,以及如何参与调控胁迫响应表达?ROS的信号传导机制已成为生命科学领域研究的热点课题,越来越多研究者选择油菜[5]、小麦[6]、玉米[7]、马铃薯[8]、拟南芥[9]等进行系统研究,试图回答上述问题并阐明ROS在植物体内的信号转导机理。
近年来,关于ROS信号在植物体细胞的产生、信号传导及响应表达和ROS引起的细胞程序性死亡的研究已取得了较大的进展,人们对ROS调控植物生长的作用及ROS信号在调控植物抗逆性的作用机理有了清晰的认识,但依然有很多问题没有解决。因此,本文梳理了国内外关于ROS信号产生、传导及响应表达机理的最新研究成果,为进一步了解植物保护策略和开发新的抗逆品种提供新观点、新思路。
1 ROS来源机制
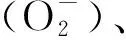
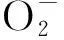
2 ROS的动态信号传递机制

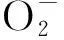
3 ROS对植物生长发育的作用
3.1 ROS植物生长发育所必要的关键分子
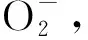
3.2 ROS调控细胞的增殖与分化
细胞的增殖和分化是植物体内最基本的生命过程,而植物细胞体积或数目变化不仅依赖细胞壁的重建,也依赖于细胞壁聚合物网络变软[54]。Fry[55]研究发现,ROS能降解细胞壁多糖(如果胶和葡聚糖),从而导致细胞壁比较疏松,有利于细胞的分裂,该观点也在玉米胚芽鞘的伸展研究中得到证明[56]。Potikha等[39]在棉花纤维发育过程中检测到H2O2的产生,并且发现H2O2产生的时间与细胞壁开始沉积时间一致,若抑制或清除H2O2的产生则阻止细胞次生壁的形成,而外源H2O2则能促进细胞次生壁的形成[57]。丁晓艳[58]研究发现蔗糖浓度的提高加强了ROS的生成,进而促进了棉花纤维起始和早期伸长,最终导致次生壁增厚信号提前和棉花纤维变短等现象 。以上研究为人们加强认识植物细胞增殖与分化过程中ROS在参与细胞壁重建和疏松过程中的作用提供了直接的证据。
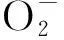
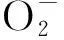
4 ROS介导的抗逆防御反应
4.1 ROS参与MAPK级联反应
大量证据证明,冷和干旱等胁迫可诱导植物细胞中产生ROS。一方面ROS通过其强大的氧化特性引起不可逆的细胞损伤,促进植物形态结构的改变,增强抗性;另一方面,ROS作为信号分子在介导防御反应、环境适应、细胞程序性死亡以及生长发育过程中扮演着重要角色。如细胞外ROS可通过水通道蛋白、未知受体或类蛋白激酶(Like protein kinases,RLK)感知并传导信号[74]。在细胞内ROS信号被一个或多个未知的整合节点(X,Y)和细胞内细胞器(线粒体,过氧化物酶体,叶绿体)整合。整合因子Y作用于转录因子,并调控相关基因的表达,这仅仅局限于一种假设(图5)。但是随着ROS信号传导机制的深入研究,一些未解之谜也越来越清楚。研究发现,ROS与Ca2+、MAPK、转录因子(ZAR、RAV、bZIP、WRKY、GRAS和Myb家族等)等关键分子存在明显的相互作用[75],其中MAPK级联激活是多种信号通路的中心,是信号接收、转换与传入细胞核内的一类重要分子[76]。
在未受刺激的细胞内,MAPK处于静止状态,而细胞受到其他因素刺激后MAPK接收MKK和MKKK的活化信号而被激活,表现为逐级磷酸化。 MAPK活性增加的一个重要原因是ROS 的二次产生或氧化还原反应。如ROS传导的下游信号涉及Ca2+和Ca2+结合蛋白,G蛋白、磷脂酶信号(PLC/PLD)的激活并导致磷脂酸(PA)的积累[77]。PA和Ca2+在激活丝氨酸/苏氨酸蛋白激酶(Oxidative signal inducible 1, OXI1)中扮演着重要的作用。OXI1又可激活蛋白激酶(MAPK)级联反应(MAPK3/6)[76],进而影响了植株的抗逆性[78]。研究报道,在拟南芥中与氧化应激信号最相关的MAPK是MPK3/6[79],在长时间胁迫下可持续激活MPK3/6,会进一步诱导细胞死亡,但MKP2可作为抑制因素能显著延长MPK3/6激活,能积极调节细胞的氧化应激反应。朱健康研究组通过定量磷酸化蛋白组学分析发现:低温处理下,MPK3/6蛋白磷酸化水平明显升高[80];同时,杨淑华研究团队利用酵母双杂交系统证实,MPK3/6蛋白能与ICE1互作[81],这些结果暗示ROS、MPK3/6可能通过信号互作作用于ICE1在植物低温应答过程中发挥重要作用。同时在植物体内外源H2O2也可激活MPK1和MPK2[82]、MPK4[83]和MPK7[79],从而启动植物的抗逆反应。陆俊杏等[84]研究证明,H2O2可诱导甘蓝型冬油菜BnMAPK1基因显著上调,而BnMAPK1基因的过表达可有效地提高甘蓝型油菜菌核病抗性和抗旱性[85]。低温驯化均可以增强植物应对冷害能力,原因在于驯化诱导提高了植物中质外体ROS的积累,增加了氧化酶和抗氧化酶活性,随后H2O2激活MPK1/2来诱导胁迫响应[86]。
越来越多的证据表明,转录因子在植物逆境响应中扮演着十分重要的角色,ROS 主要通过提高转录因子表达量、增强转录因子结合DNA 能力等方面,进一步调节逆境响应相关基因表达, 改善植物抗逆性[87]。如拟南芥中WRKY家族转录因子WRKY33是MAPK3/6的直接磷酸化靶标[88],在逆境胁迫中会导致WRKY33基因的上调表达,以提高植物的抗逆性[89]。在油菜抗寒性研究中也发现,抗寒性强的品种转录因子RRTF1(氧化还原反应转录因子1)是氧化还原信号网络的核心组成部分,植物中升高的RRTF1水平导致ROS积累,这表明RRTF1在胁迫下可以放大ROS信号的形成,以诱导下游级联反应[90]。水稻中转录因子OsNAC2能够结合到ROS 清除基因OsCOX11 (Cytochrome c oxidase 11)的启动子上并促进其转录, 大量表达的OsCOX11能够清除逆境下积累的ROS, 提高水稻的盐胁迫耐受能力[91]。综上所述,证明ROS与转录因子等关键分子彼此间互作调控其基因表达,以此来帮助植物参与各种胁迫的防御反应(图5)[92]。
4.2 ROS与MAPK信号途径及植物激素途径(ABA、BR等)存在广泛的互作关系
ROS还能与其它信号分子互作形成一个复杂的反应网络,从而使植物积极、高效地应对各种内在或外源的刺激信号,以调控植物的生长发育。如植物在受到冷害、高温等胁迫时,植物体内会发生ROS爆发、同时积累较多的脱落酸(ABA)和油菜素类固醇(BRs)等激素[92]。随着遗传学、分子生物学、生物化学及细胞学等应用学科的发展,研究也证明ROS可与ABA、BR等相互作用,共同调控植物气孔关闭以适应各种胁迫反应[93]。
研究发现,ABA在转录水平上会激活MAPK信号级联途径[94],如豌豆中的PsMAPK[95]、拟南芥中的MPK3/6和MPK9/12[96]参与调控气孔关闭和ROS的产生,而积累较多的ROS又作为信号分子进一步提高CAT等抗氧化酶活性,有助于增强甘薯[97]、玉米[98]的抗旱性以及水稻[99]、冬油菜幼苗[100]的抗冷性。研究人员对ROS参与ABA调控气孔关闭机理进行了深入解析,发现保卫细胞中的PYR/ PYL/ PCAR是ABA信号受体,然后PYLs 构象发生改变并与PP2C(负调控因子)相互作用达到抑制PP2C酶活性的作用,进而激活SnRK2(正调控因子)激酶OST1蛋白的活性[101],OST1又作为重要因子可激活NADPH酶产生较多的ROS,以激活离子通道促使阴离子外流和K+、Ca2+内流,最终促使气孔关闭(图6)。最新研究发现,ABA可激活L-半胱氨酸脱巯基酶(L-cysteine desulfhydrase,DES1),当DES1被硫化氢激活后在Cys44以及Cys205氨基酸位置上发生自我硫巯基化,进而在保卫细胞产生大量的硫化氢,较多的硫化氢对RBOHD的Cys 825和Cys890进行硫巯基化修饰(图6),从而增强其产生ROS的能力以及ABA介导气孔关闭的相关生理反应[102],该研究也进一步加强了ROS参与ABA调控气孔关闭机理认识。
在番茄气孔的研宄中表明,BR与ROS也参与调控气孔运动,低浓度BR诱导保卫细胞产生瞬时H2O2,使得细胞的氧化还原状态发生改变,从而导致气孔开放[70]。而较高浓度的BR和H2O2则可以调控气孔的关闭[103]。为了进一步证明ROS与激素(ABA、BR等)协同调控气孔关闭过程的观点。研究者在外施ABA或BR之前,先用还原性试剂DPI(DPI可以抑制NADPH氧化酶的活性)处理材料30min[104],结果显示细胞内及气孔保卫细胞中的H2O2荧光信号明显下降,且气孔关闭过程也明显被抑制,这也证明了ROS参与ABA或BR等激素信号途径并诱导气孔关闭的观点。后期的研究发现,ABA和BR诱导的气孔关闭程度存在差异性[105],如BR引起的气孔关闭度小于ABA,而外施ABA后进而形成ABA正向放大环,促进气孔关闭[70]。综上研究进一步暗示ROS与MAPK信号途径及植物激素途径(ABA、BR等)存在广泛的互作关系,它们通过复杂且巧妙的网络调控体系,在一定程度上可以协调植物生长发育过程中所遇到的各种问题,但对于其复杂的调控体系依然需要后续的深入解析。
5 过量的ROS不利于植物生长发育
5.1 ROS的清除机制
适量的ROS对植物的正常生长和发育具有重要意义,这种作用取决于ROS的产生强度、时间与ROS清除之间的平衡关系。植物细胞中 ROS 清除的主要酶促清除系统有SOD、CAT、POD、抗坏血酸过氧化物酶(APX)、胱甘肽还原酶(GR)等;非酶促系统如,谷胱甘肽(GSH)、抗坏血酸(AsA)及酚类化合物[106](图7a)。植物体在受到轻度胁迫时,这些抗氧化酶的活性会发生相应的变化,共同参与调控 ROS 自由基代谢,保护植物免受环境胁迫的危害,在油菜[107]、水稻[108]等作物研究中已得到充分证明,抗性强的材料抗氧化酶的活性显著高于抗性弱的材料。孙万仓课题组通过建立强抗寒冬油菜和弱抗寒冬油菜的杂交后代进行越冬率和保护酶活性变化规律分析,并建立回归方程Y=1.208+2.698X1+1.154X2+0.163X3[109],可得出越冬率与CAT 酶、POD 酶、SOD 酶活性的关系呈极显著正相关,说明保护性酶活性越强,越冬率越高,抗寒性也就越好。通过PCR分析,进一步证明强抗寒性品种的Cu/Zn-SOD基因表达量显著高于抗寒性弱的品种,而Cu/Zn-SOD基因被激活表达,诱导SOD 酶活性增加,有效清除体内的氧自由基,保护了细胞膜结构[110]。若植物处于深度胁迫时,机体内 ROS 清除机制功能异常,多种来源的ROS过度积累导致防御系统崩溃、ROS爆发[111](图7a)。一方面ROS会与磷脂、膜受体蛋白发生脂质过氧化反应,严重破坏膜系统的完整性和流动性[112],OH·可直接作用于脂类形成氢过氧化物,进而分解为 MDA等强毒力的脂质过氧化终产物,这些产物能交联核酸、脂类、蛋白质及糖类,因此 MDA 的含量常被用来表征植物遭受逆境胁迫的危害程度[22]。另一方面过量的 ROS损伤周围其他细胞,破坏细胞结构,包括染色质凝聚、叶绿体破坏、线粒体肿胀、DNA分裂(梯子)、tunel阳性细胞核和凋亡体形成[113],最终导致细胞程序性死亡。
5.2 植物细胞程序性死亡与线粒体的关系
程序性细胞死亡(Programmed cell death, PCD)是一个高度有序和基因调控细胞自我死亡的过程。在生理生化上PCD常伴随着呼吸速率和ATP合成的降低、ROS在线粒体内急剧增加、线粒体膜电位的改变和线粒体通透性转换孔蛋白的完全开放等[114]。研究报道,线粒体孔蛋白(VDAC)是线粒体介导PCD的关键分子[115],从真菌到动物和植物的所有生物体中都存在(图8)。基因组序列分析显示,在酿酒酵母中有两个VDAC基因;拟南芥中存在5种VDAC亚型[116]。至少有3种亚型存在于水稻和烟草中[117]。在荷花和苜蓿中发现了5种不同的VDACs[116,118]。迄今为止,VDAC亚型已在玉米、小麦和油菜中也得到鉴定[119]。VDAC位于线粒体外膜,作为线粒体代谢物进出的看门者,VDACs被认为在线粒体和细胞质之间的代谢物运输的调节中起作用[120]。VDAC也被认为是ROS从细胞内向胞质释放的中介物之一[121](图8)。ROS的过量产生伴有VDAC上调,VDAC通道切换至闭合状态[122],过量的ROS引发膜脂过氧化加剧,使线粒体膜通透性发生改变,促使Cyto c等凋亡因子的释放,触发PCD。非生物胁迫,包括冷胁迫、干旱胁迫、盐碱胁迫等会导致ROS的产生,同时VDAC基因在胁迫下的差异表达已有报道[123]。通过RT-PCR方法检测,过表达VDAC1降低了拟南芥对寒冷胁迫的耐受性,而VDAC1突变株在冷胁迫下的表现优于野生植株,这表明VDAC1在冷胁迫反应中起负调控作用[124]。综上分析,进一步说明线粒体介导植物细胞的程序性死亡。
6 结 语
大量研究证明,适量的ROS可以调控植物根、茎、叶及生殖细胞的增殖和分化,促进植物生长发育和器官形成。在植物面临外部环境变化时,植物细胞被膜上的传感器首先感知外部环境变化,并发出“警报”信号ROS,随后这些“ROS”信号传递到细胞内部,最终到达细胞核,调节植物生长发育、形态结构、水分运输、生理生化、氧化还原稳态、营养物质合成、植物内源激素变化以及基因表达调控等变化,最后实现植物的耐逆性(图7b)。迄今为止,大量研究证实ROS产生于细胞内和细胞外,其中线粒体、叶绿体、NADPH氧化膜、过氧化物酶体等都是ROS的主要来源途径。产生的ROS与Ca2+和电信号相互偶联组成一种快速信号传递模式“ROS波”(波信号类似于“多米诺骨牌”效应[125],最终激活“友邻细胞”或远端细胞的应激响应表达,虽然植物体内ROS成像技术对了解ROS的产生、信号传导机制做出了重要的贡献,但还有诸如以下很多问题依然需要进一步深入探索。
(1)各种产生ROS的细胞器或者酶之间是否存在信号交流机制,依然需要结合分子学和细胞学等理论方法进行更深一步的解析。令人欣喜的是,中国科学院遗传与发育生物学研究所李家洋研究组证实了苹果酸穿梭机制在叶绿体和线粒体间信号传递过程中起重要作用,产生的ROS最终诱导细胞的程序性死亡。该成果加强了我们对细胞器之间信号交流和植物PCD发生机制的认识[19]。同时,中国科学院分子植物科学卓越创新中心上海植物逆境生物学研究中心Rosa Lozano Duran课题团队,研究发现了一条连接细胞膜和叶绿体的重要信号传递途径,病原体可以劫持这种在植物细胞内部传递信息的途径,抑制植物防御反应的激活[126]。这种新途径的发现为设计植物的保护策略和开发新品种提供了新思路。孙万仓课题组对甘蓝型油菜油菜细胞超微结构观察发现,大量的叶绿体主要围绕在细胞膜附近区域(图9),同时叶绿体附件常伴有线粒体的出现[5],这个证据也暗示甘蓝型油菜油菜中也存在细胞膜、叶绿体和线粒体之间存在类似的信号传递途径,最终将危险信号通过该途径传递到细胞核,导致相关防御基因表达[127]。综上分析,可以肯定的是各亚细胞单位或细胞器之间会发生物质(信息)的交流,从而使ROS 与其它信号分子协同形成一个或多个复杂的响应表达通路,从而使植物能够积极、高效地应对各种生物和非生物胁迫[128],但更多的信号交流机制仍需详尽的解析。
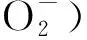
(3)适量的ROS可与其它信号分子互作形成一个复杂的反应网络,同时ROS可以修饰某些蛋白质或激活相关基因的表达,进而触发信号转导通路,使植物积极、高效地应对各种内在或外源的刺激信号以调控植物的生长发育。但ROS的异常积累会导致氧化miRNAs和蛋白之间的错配,可能参与细胞程序性死亡的启动,最终导致细胞死亡[129]。找到ROS作为信号分子参与植物响应胁迫(冷害、干旱等)应答的阈值水平范围以及探索ROS与其它信号分子的互作、ROS与表观遗传修饰之间的相互作用,将对深入理解ROS信号网络、表观遗传学和植物适应性和耐受性相互调节的机制具有重要意义[65]。
