CXC趋化因子受体4及基质细胞衍生因子-1在成釉细胞瘤中的表达及意义
2021-06-27刘佳意田小川钟鸣
刘佳意,田小川,钟鸣,2
(1.中国医科大学口腔医学院·附属口腔医院口腔病理科,辽宁省口腔疾病重点实验室,沈阳 110002;2.厦门大学附属翔安医院口腔科,福建厦门 361102)
成釉细胞瘤(ameloblastoma,AB)是口颌面部常见的牙源性肿瘤,具有侵袭性生长及术后易复发的特点[1],现阶段以切除为主的治疗方案会造成颌面部缺损,因此亟待损伤更小的治疗手段。
CXC 趋化因子受体4(CXC chemokine receptor 4,CXCR4)为人趋化因子受体之一[2],由1个胞外N-末端结构域、1个胞内C-末端结构域、7个跨膜螺旋、3个胞外环和3个胞内环构成[3],有研究[4]证明CXCR4与其配体基质细胞衍生因子-1(stromal cellderived factor-1,SDF-1)相互作用可触发多种信号通路。早期的研究[5]显示,CXCR4有助于人免疫缺陷病毒-1(human immunodeficiency virus type-1,HIV-1)进入宿主细胞,进一步研究发现,CXCR4/ SDF-1也同样可以影响肿瘤。在包括非小细胞肺癌[6]、乳腺癌[7]等多种肿瘤中CXCR4呈高表达,阻断CXCR4/SDF-1信号传导可以明显抑制肿瘤细胞扩散和生长。现阶段CXCR4/SDF-1通路及药理研究主要集中在恶性肿瘤方面,它在AB中的表达及意义尚不清楚,本研究通过检测两者mRNA及蛋白表达并结合临床资料探讨其在AB中的表达及意义。
1 材料与方法
1.1 材料
1.1.1 样本采集:免疫组化所使用样本来自中国医科大学附属口腔医院2007年至2012年口腔病理科留存的80例AB及10例口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)存档蜡块;搜集该院10例经口外门诊智齿拔除术带出的正常黏膜(normal oral mucosa,NOM)作为对照。AB病例按照2017 WHO分类标准进行病理分型,其中,男40例,女40例;年龄18~79岁,平均年龄为49岁;发生于下颌骨65例,上颌骨12例,其他部位3例;原发76例,复发4例;经典型AB 64例,单囊型AB 13例,骨外/外周型AB 3例。实时定量PCR及Western blotting所用组织来自该院病理科2007年至2012年收治的AB患者-81 ℃冻存标本;其中男16例,女14例;年龄16~72岁,平均年龄为44岁;24例发生于下颌骨,3例发生于上颌骨,3例发生于其他部位;原发16例,复发12例,恶变2例;经典型AB 26例,单囊型AB 1例,骨外/外周型AB 3例。本研究经患者知情同意,获得医院伦理委员会批准。
1.1.2 主要试剂:兔抗人CXCR4多克隆抗体及SDF-1多克隆抗体均购自英国Abcam公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;TRIzol购自美国Invitrogen公司;荧光定量PCR试剂盒购自日本TaKaRa公司。
1.2 实验方法
1.2.1 实时定量PCR:将组织取出后立刻剪碎,并置于TRIzol充分裂解提纯RNA,定量后选取纯度较高RNA反转为cDNA,按照试剂说明配制混合液并加样;整个加样实验全程避光,实验器材及试剂保持冰浴;选取GAPDH作为内参,采取2-ΔΔCt法计算AB与NOM的目的基因相对表达量;PCR引物序列见表1。

表1 相关引物序列Tab.1 Primer sequences
1.2.2 Western blotting:取适量组织剪碎匀浆并加入适量组织裂解液至匀浆完全;4 ℃、12 000g离心1 h,取上清测浓度,加入loading buffer后置于100 ℃水浴5 min,获取蛋白样品备用。蛋白上样量为15 μg,按操作说明电泳,待marker显示目的蛋白与内参分开时停止电泳并转膜,转膜结束后将膜置于封闭液内室温摇床封闭1 h,封闭结束后分别孵育目的蛋白与内参,4 ℃、16 h。次日经一抗回收,洗膜,孵育二抗及洗膜后发光,通过Image-J软件分析条带灰度值。
1.2.3 免疫组化:采用SP三步法。石蜡标本常规4 μm切片,脱蜡,洗片,抗原修复,使用二抗来源动物非免疫血清孵育切片以防止抗体非特异性吸附,一抗孵育,工作浓度1∶100,二抗37 ℃ 30 min,DAB显色,苏木素核复染;阴性对照为0.01 mol/L PBS。判读标准:计数并评分每个视野下的染色强度及阳性瘤细胞百分比。细胞质无着色、浅黄色、棕黄色、棕褐色分别计0、1、2和3分;阳性瘤细胞占比0%、>0%~25%、>25%~50%、>50%分别计0、1、2和3分,两者乘积为该片得分,0分,阴性(-),1~3分,弱阳性(+),4~6分,中等阳性(++),>6分,强阳性(+++)。
1.3 统计学分析
采用SPSS 19.0软件进行统计分析,实时PCR和Western blotting结果采用配对t检验,免疫组化结果采用方差分析,计算组内及组间差异,P< 0.05为差异有统计学意义。
2 结果
2.1 实时定量PCR
AB中CXCR4mRNA表达水平为NOM的4.82倍,差异有统计学意义(P< 0.05);AB中SDF-1mRNA表达水平较NOM高4.06倍,差异有统计学意义(P<0.05)。
2.2 Western blotting
AB中CXCR4蛋白表达水平显著高于NOM(P<0.05),见图1。CXCR4蛋白在AB及OSCC组织中的表达无统计学差异(P> 0.05),见表2;AB中SDF-1蛋白表达水平明显高于NOM(P< 0.05),见图2,AB中SDF-1表达与OSCC中SDF-1蛋白表达差异无统计学意义(P> 0.05)。见表2。

图1 CXCR4的Western blotting结果Fig.1 Western blotting results of CXCR4

表2 CXCR4/SDF-1蛋白在不同组织中的表达Tab.2 Expression of CXCR4/SDF-1 protein in different tissues

图2 SDF-1的Western blotting结果Fig.2 Western blotting results of SDF-1
2.3 免疫组化
CXCR4在NOM中表达呈阴性(图3A),在OSCC中表达呈阳性(图3B);AB中CXCR4表达呈阳性(图3C),阳性率为87.5%,主要见于细胞质,细胞核及周边破骨细胞也可见表达;SDF-1在NOM 中表达呈阴性(图3D),在OSCC中表达呈阳性(图3E);在AB中的阳性表达率为85%,主要见于细胞质,也可见于细胞核及破骨细胞(图3F,表3)。
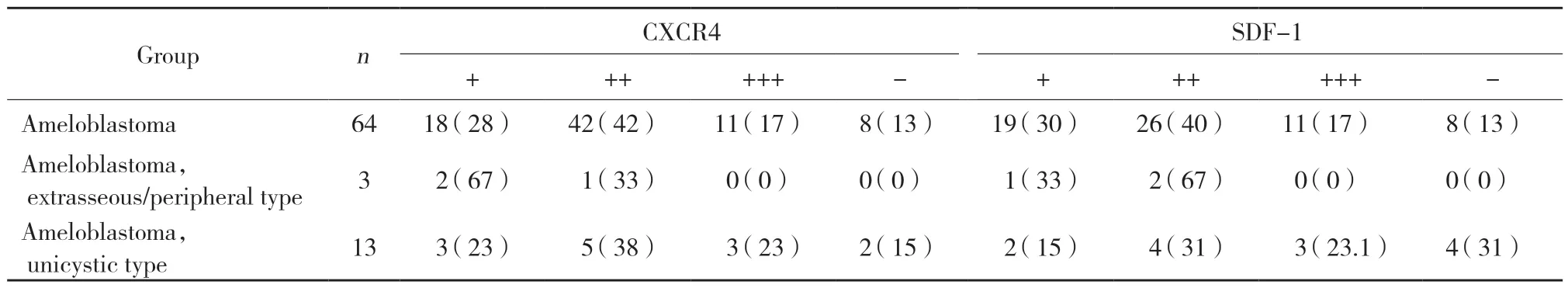
表3 各分型AB中CXCR4及SDF-1评分情况 [n (%)]Tab.3 Scores of CXCR4 and SDF-1 in AB of each type [n (%)]

图3 CXCR4及SDF-1免疫组化结果Fig.3 Immunohistochemical results of CXCR4 and SDF-1
3 讨论
对于大部分恶性肿瘤及有侵袭和复发倾向的良性肿瘤,目前主要倾向于进行手术治疗或放化疗,以期达到根治目的,虽然疗效显著,但不良反应重,后期可能还面临植骨等问题。CXCR4/SDF-1作为近些年研究的热点,其相应的抑制剂无论是单独用药还是联合用药都显现出良好的应用前景,因此,深入了解CXCR4/SDF-1致病机理十分关键。
CXCR4/SDF-1可直接影响器官和组织的再生,关于肺[8]、心脏[9]、肝脏[10]等的研究均证实了此观点。由于CXCR4/SDF-1介导的组织再生与增殖相关通路激活联系紧密,使得肿瘤也可通过改变CXCR4/SDF-1来促进肿瘤细胞增殖。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)对于机体生长极为关键,其能够促进合成代谢并抑制分解代谢,进而调控细胞生长,自噬等关键过程[11],上述功能主要经由mTOR复合物1(mammalian target of rapamycin complex 1,mTORC1)和mTOR复合物2(mammalian target of rapamycin complex 2,mTORC2)经由各自底物传递信号实现[12]。研究[13]显示,阻断CXCR4/SDF-1可明显抑制mTOR相关通路并抑制肿瘤生长,针对于AB的研究也得出了相似的结果,LI等[14]发现,相较于正常口腔黏膜组织,AB原发灶及复发灶的mTOR表达明显升高,本研究结果显示,AB中CXCR4及其配体表达明显高于NOM组织,这与上述研究结果趋势相吻合,提示CXCR4/SDF-1激活可通过改变mTOR通路进而介导AB易复发这一异常生物学行为。
除此之外,本研究发现AB中CXCR4及SDF-1免疫组化检测均可见破骨细胞阳性表达,提示CXCR4/SDF-1与AB的侵袭存在一定联系。上皮间质转化(epithelial-mesenchymal transition,EMT)可以使上皮细胞失去连接及黏附能力并获得迁移及浸润游走能力。病理状态下,肿瘤可通过EMT获得更强的侵袭能力[15]。这种能力的获得与肿瘤细胞的某些通路异常改变联系密切。上皮钙黏着蛋白(E-cadherin,ECAD)表达降低及波形蛋白(vimentin,VIM)的表达升高是EMT过程中最显著的表型之一[16]。LIN等[17]研究显示,CXCR4/SDF-1过表达可激活核因子κB(nuclear factor kappa-B,NF-κB)相关通路从而引起ECAD水平降低及VIM表达增加,另外,CXCR4/SDF-1也可通过激活mTOR相关信号增强肿瘤EMT潜能[18]。本课题组前期研究[19]显示,相较于NOM组织,AB组织中ECAD表达下降而VIM表达上升,提示AB中EMT明显激活,结合本研究中CXCR4/SDF-1在AB破骨细胞中表达呈阳性这一结果提示CXCR4/SDF-1在AB侵袭性生长这一异常生物学行为中扮演重要角色,可能通过多种通路激活EMT,从而促进AB侵袭性生长。
综上所述,AB中CXCR4及其配体表达水平明显高于NOM,且可见破骨细胞阳性表达,提示其可能通过激活多种通路介导AB发生发展。CXCR4/SDF-1介导AB侵袭及复发的具体机制仍需进一步研究。
