甜菜碱在提高血清乳酸脱氢酶活性稳定性中的作用
2021-06-26虞啸炫欧元祝唐立萍刘文彬林斐然葛丹红龚敬凯朱宇清
虞啸炫,欧元祝,唐立萍,刘文彬,林斐然,葛丹红,龚敬凯,朱宇清
(上海市临床检验中心,上海 200126)
乳酸脱氢酶(lactate dehydrogenase,LDH)是临床常用的生化酶学指标,在心、脑、肝、肾等器官损伤疾病中起重要的辅助诊断作用。酶蛋白属于大分子化合物,很难被直接测定,因此临床一般通过测定反应速度,间接推算出酶浓度。尽管目前我国大多数临床实验室采用速率法检测LDH,但不同厂商生产的试剂的缓冲液成分、样本和试剂用量比例、检测程序等都不太一致,因此检测结果会出现一定的差异。为了使LDH测定结果在不同临床实验室之间有可比性,开展LDH测定的标准化工作势在必行。但不论是标准物质,还是正确度控制品的研制都存在LDH的稳定性问题。由于LDH有5种同工酶(LDH1~LDH5),分布在不同组织中,且5种同工酶在不同温度下表现出的稳定性不一致,导致LDH具有“冷变性”的特征。因此,血清LDH活性的稳定性是亟待解决的问题。甜菜碱(又称三甲基甘氨酸)是一种在自然界中广泛存在的渗透剂。有研究结果显示,甜菜碱对蛋白质结构有一定的稳定作用[1-2]。原因可能是甜菜碱可使溶液表面张力增大,并使蛋白质优先发生水合作用,在两者的共同作用下使蛋白质在热力学上的变性过程难以进行[3]。本研究拟通过研究甜菜碱对LDH稳定性的影响,找出甜菜碱稳定LDH的最适条件,为LDH标准物质和正确度控制品的研制提供实验基础。
1 材料和方法
1.1 血清样本来源
血清样本均为海军军医大学第二附属医院临床检测后的剩余样本。
1.2 仪器和试剂
LDH同工酶采用SPIFE 3000蛋白电泳分析仪(美国Helena Laboratories公司)及配套试剂检测。LDH总活性检测采用L-乳酸向丙酮酸盐转化过程中NAD被还原为NADH的方法,试剂盒购自瑞士罗氏公司,检测仪器为7180全自动生化分析仪(日本日立公司)。甜菜碱化学原料购自美国西格玛公司(CAS:107-43-7)。
1.3 方法
1.3.1 血清样本中甜菜碱的添加量 (1)5 mol/L甜菜碱溶液的配制。称取117.15 g甜菜碱化学原料,溶解于200 mL超纯水中,搅拌至全部溶解,混匀后2~8 ℃保存。(2)血清样本中甜菜碱的添加量及保存条件。收集18份不同LDH浓度(LDH为100~500 U/L)的新鲜血清样本,分成5组,第1组为6份不添加甜菜碱溶液的血清样本,分成2批,第1批2~8 ℃保存,每份样本分装4支,每支200 μL;第2批-20 ℃保存,每份样本分装4支,每支200 μL;第2组3份血清样本按样本∶甜菜碱溶液(V∶V)9∶1配制(甜菜碱为0.5 mol/L),与第1组一样分成2批保存;第3组3份血清样本按样本∶甜菜碱溶液(V∶V)8∶2配制(甜菜碱为1 mol/L),与第1组一样分成2批保存;第4组3份血清样本按样本∶甜菜碱溶液(V∶V)7.5∶2.5配制(甜菜碱为1.25 mol/L),与第1组一样分成2批保存;第5组3份血清样本按样本∶甜菜碱溶液(V∶V)6∶4配制(甜菜碱为2 mol/L),与第1组一样分成2批保存。
1.3.2 LDH同工酶电泳分析及LDH总活性检测 第1组6份不添加甜菜碱溶液的样本在保存前先进行LDH同工酶电泳分析和LDH总活性检测,将该检测结果作为后续保存的对照结果(基线值),随后将分装样本分别保存于2~8 ℃和-20 ℃,4周后取出,进行LDH同工酶电泳分析和LDH总活性检测。第2~5组添加不同比例甜菜碱溶液的血清样本在保存前先进行LDH同工酶电泳分析和LDH总活性检测,将该检测结果作为后续保存的对照结果(基线值),随后将分装样本分别于2~8 ℃和-20 ℃保存,4周后取出,进行LDH同工酶电泳分析和LDH总活性检测。计算所有添加甜菜碱溶液的样本的LDH活性回收率结果。根据基线结果,分析2种保存温度下LDH同工酶电泳分析与LDH总活性的变化。
2 结果
2.1 添加不同比例甜菜碱溶液的血清样本的LDH活性回收率结果
第2组、第3组、第4组血清样本的LDH总活性回收率为98.36%~101.41%。第5组血清样本的LDH总活性回收率为95.16%~103.48%,有1份样本的偏移高于我国卫生行业标准(WS/T 403-2012)规定的偏差(4.0%),因此后续研究中排除第5组血清样本。见表1。
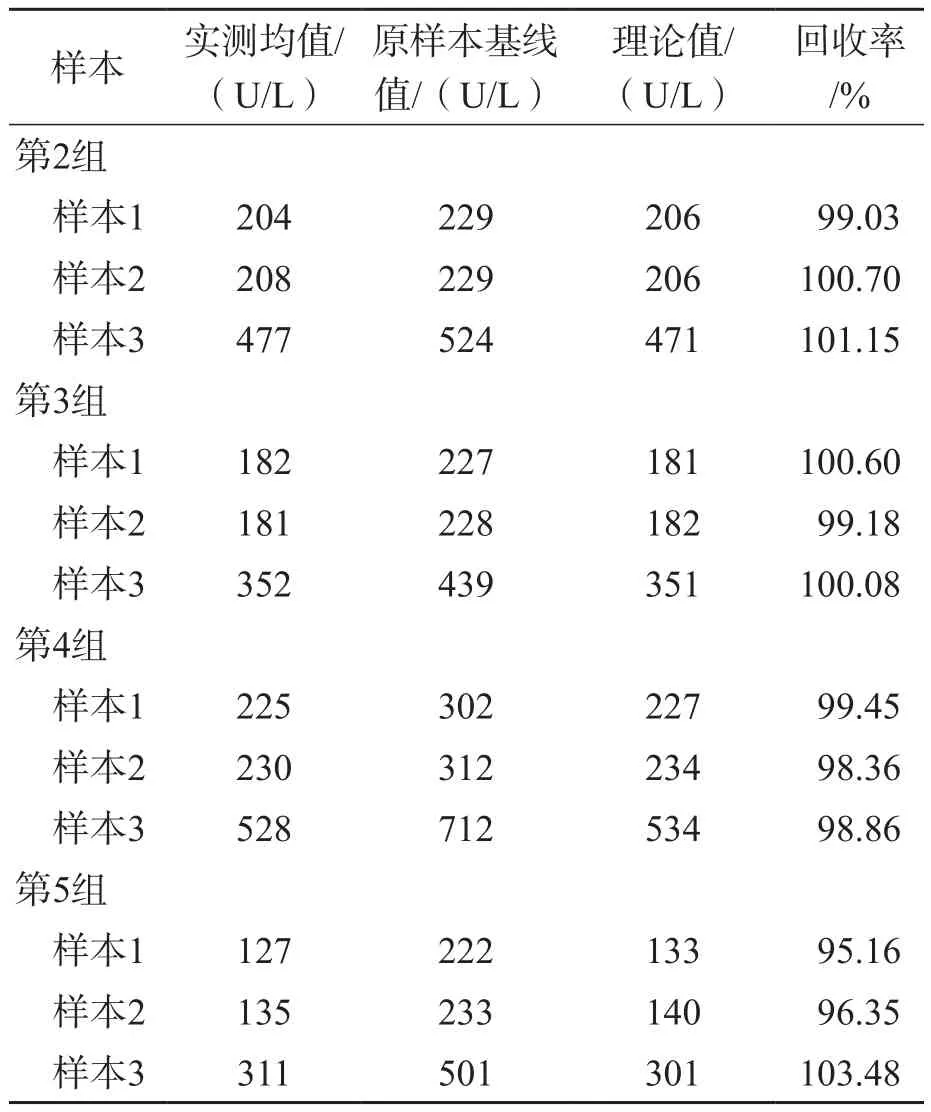
表1 添加不同浓度甜菜碱的血清样本的LDH总活性回收率
2.2 不同保存温度下LDH同工酶电泳分析结果和LDH总活性的变化
2.2.1 各组血清样本2~8 ℃保存后LDH总活性的变化 第1~4组血清样本分别于2~8 ℃保存7、21和30 d后,检测LDH总活性。第1组血清样本未添加甜菜碱溶液,保存7 d后的LDH总活性为基线值的74.87%~81.23%;随着保存时间的延长,LDH总活性逐渐降低,保存30 d后仅为基线值的52.31%~59.95%。第2~4组添加不同浓度甜菜碱溶液的血清样本,LDH总活性均较稳定,是基线值的98.54%~101.64%,检测结果的变化率≤1.60%。见表2。
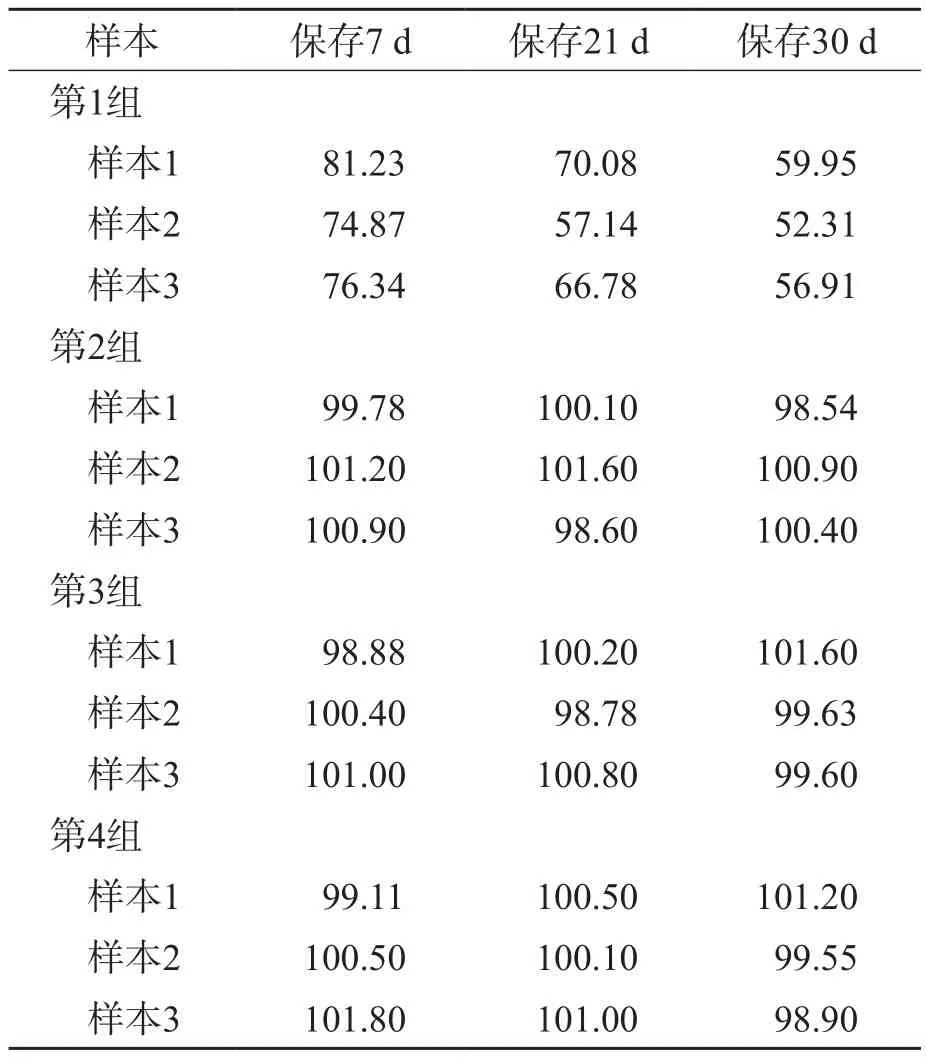
表2 各组血清样本2~8 ℃保存不同时间LDH总活性相对于基线值的变化 %
2.2.2 各组血清样本-20 ℃保存后LDH总活性的变化 检测第1~4组血清样本分别于-20 ℃保存21、30和45 d后LDH总活性。未添加甜菜碱溶液的第1组血清样本保存21 d后的LDH总活性是基线值的88.78%~91.57%,且随保存时间的延长,LDH总活性逐渐降低,保存45 d后的LDH总活性是基线值的83.69%~87.42%。添加不同浓度甜菜碱溶液的第2~4组血清样本保存21 d后LDH总活性急剧下降,仅为基线值的56.14%~65.34%。见表3。

表3 各组血清样本-20 ℃保存不同时间LDH总活性相对于基线值的变化 %
2.2.3 各组血清样本-20 ℃保存30 d后LDH同工酶的变化 LDH同工酶电泳分析结果显示,与保存前的基线值比较,-20 ℃保存30 d,LDH同工酶中LDH1、LDH2比例升高,LDH3比例接近基线值,LDH4、LDH5比例为0。由于第2~4组血清样本保存后的LDH同工酶变化基本一致,因此仅列出第2组血清样本的LDH同工酶变化,见表4。
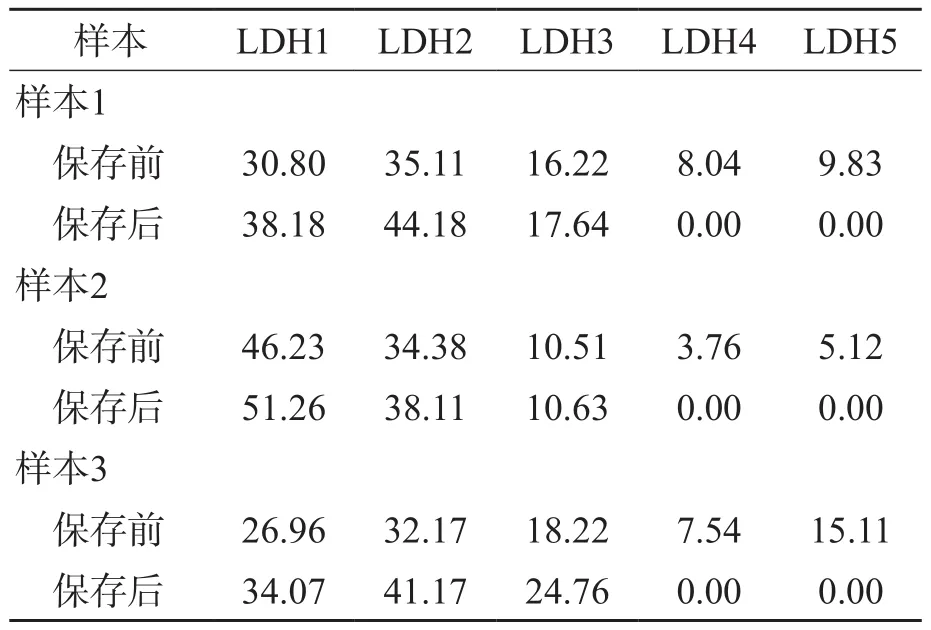
表4 第2组血清样本-20 ℃保存30 d后LDH同工酶的变化%
3 讨论
由于LDH具有“冷变性”的特性,所以会严重影响样本的保存和运输。欧元祝等[4]的研究结果显示,甜菜碱在不同保存温度下对血清丙氨酸氨基转移酶均有较好的稳定效果。因此,本研究对甜菜碱在血清LDH稳定性中的作用进行了探讨。
本研究结果显示,未添加甜菜碱溶液的血清样本2~8 ℃保存30 d后,LDH总活性仅为基线值的52.31%~59.95%,而添加不同浓度(0.5~1.25 mol/L)甜菜碱溶液的血清样本LDH总活性是基线值的98.54%~101.64%。提示甜菜碱对LDH具有良好的稳定作用,为后续LDH正确度控制品的研制奠定了基础。未添加甜菜碱溶液的血清样本在-20 ℃保存21 d后,LDH的总活性是基线值的88.78%~91.57%,但添加0.5~1.25 mol/L甜菜碱的血清样本LDH总活性仅为基线值的56.14%~65.34%。由此可见,血清样本添加甜菜碱后保存于-20 ℃,LDH反而不稳定。JACBOS等[5]对血清LDH同工酶在25、4和-20 ℃条件下保存45 d后的稳定性进行了研究,结果显示,LDH1在3种温度下均稳定,而其他4种LDH同工酶在4 ℃时稳定性均较差,由此得出LDH具有“冷变性(4 ℃)”的特征。本研究对添加甜菜碱的血清样本在-20 ℃保存后LDH同工酶的变化进行了分析,结果显示,-20 ℃保存30 d后,LDH同工酶中LDH1、LDH2比例升高,LDH3比例接近基线值,LDH4、LDH5比例为0。由于LDH总活性下降至基线值的44.78%~60.11%,LDH3就算接近基线值,也难以避免总活性下降幅度大于LDH1和LDH2。根据LDH活性检测试剂盒说明书和同工酶电泳试剂说明书的声明,LDH活性检测和电泳分析后显色均属于同一反应原理,说明电泳后无法显色的LDH同工酶在酶活性检测中也无法被检测到,而在活性检测中能被检测到的LDH在电泳分析中也必定会显色。由此可见,-20 ℃保存30 d后LDH总活性降低,有可能是5个LDH同工酶的活性均降低,但相对而言,LDH1和LDH2在-20 ℃下的稳定性优于LDH3、LDH4、LDH5。
综上所述,用于LDH检测的血清样本添加甜菜碱溶液后,在2~8 ℃至少可稳定30 d。该时间段足够完成1次LDH正确度验证计划。如选择-20 ℃作为样本保存和运输温度,为了使样本对LDH活性检测的影响程度降至最低,一方面应尽可能选择LDH1及LDH2较高的样本(LDH1和LDH2主要存在于人体心肌、肾、红细胞中),另一方面还需将样本在-20 ℃保存21 d以上,让LDH3、LDH4和LDH5失去活性,从而使LDH总活性稳定在一定水平。另外,由于目前商品化LDH检测试剂的原理基本已按国际临床化学和检验医学联合会公布的LDH参考方法(乳酸氧化为丙酮酸)进行了调整,因此本研究仅证明了从乳酸向丙酮酸方向反应的实验中甜菜碱对LDH稳定性的作用。由于没有LDH逆反应方法(丙酮酸转化为乳酸)的试剂,因此未进行相关实验,后续将进一步研究。
