高等植物光系统复合物结构生物学研究进展
2021-06-25苏小东李梅
苏小东,李梅
中国科学院生物物理研究所 生物大分子国家重点实验室,北京 100101
光合作用通常指绿色植物、藻类及光合细菌等吸收光能,利用二氧化碳合成有机物的过程,其中放氧光合生物同时还释放氧气。光合作用是地球上规模最大的能量和物质转换过程,为几乎一切生命的生存和发展提供基础,被誉为地球上最重要的化学反应。光合作用的过程分为光反应和卡尔文循环(也称暗反应)两个阶段。高等植物的光反应主要是由位于叶绿体中类囊体膜上的光系统II (photosystem II, PSII)、细胞色素b6f、光系统I (photosystem I, PSI)和ATP合酶等多个膜蛋白复合物协同作用完成的,其中PSI和PSII都是包含多个亚基、结合大量色素的膜蛋白-色素复合物,并分别由各自的核心复合物(core complex)和外周捕光天线(light harvesting complex, LHC)组成。PSI主要位于单层的基质类囊体膜上,其核心结合捕光天线I(LHCI),形成PSI-LHCI复合物。PSII则主要位于垛叠的基粒类囊体膜上,结合捕光天线复合物II(LHCII),形成PSII-LHCII复合物[1]。植物中PSI-LHCI相对稳定,形式均一,而PSII-LHCII则由于其主要捕光天线LHCII与核心复合物结合强度差异,形成包括C2S2型、C2S2M2型和C2S2M2L2型等(C指代核心复合物(Core),S、M、L分别表示与核心紧密结合(strongly-bound)、中等强度结合(moderatelybound)和松散结合(loosely-bound)的LHCII)多种形式的复合物[2]。
在自然环境中,光照强度是时常变化的。在弱光条件下,植物需要最大限度地捕获光能;而在强光条件下,吸收过多的光能会对植物造成光损伤。光损伤的主要部位在PSII[3],因而植物通过改变PSII-LHCII捕光天线的大小来调控其对光能的吸收。适应强光照的植物,类囊体膜上PSII-LHCII复合物主要为C2S2型,这种类型的PSII-LHCII结合较少的捕光天线,减少了对光能的吸收,从而有效避免过多的光能造成的光损伤;而适应弱光照的植物,类囊体膜上主要存在的则是C2S2M2型的PSII-LHCII,PSII-LHCII以增大捕光天线的方式来增加对光能的吸收,从而更大限度地提高光能捕获效率[4]。
自然界中除了光照强度变化之外,还存在光照波长的变化,不同波长的光优先激发不同的光系统。为了避免两个光系统的不平衡激发,植物和真核绿藻进化出一种调节机制,称为状态转换(state transitions)[5]。状态转换过程中,PSIILHCII复合物中的主要捕光天线LHCII发生可逆磷酸化,并在两个光系统之间迁移。在某些光照条件下,PSII-LHCII相对于PSI-LHCI被过度激发(状态2),此时部分LHCII 被磷酸化,从PSIILHCII上解离下来并结合到PSI-LHCI上,形成PSI-LHCI-LHCII 型复合物,并将其捕获的光能向PSI核心传递;反之,LHCII被去磷酸化,离开PSI-LHCI,重新结合到PSII上(状态1)。状态转换是植物适应光环境变化、平衡激发能在两个光系统间重新分配的一种快速调节机制。
光合作用中光能的吸收、传递和转换等过程都是在这两个光系统中进行的。PSII可以在常温常压下裂解水,释放氧气及质子,并向下游传递电子。PSI是自然界中效率最高的光电转换器,它利用太阳光进行电子传递的量子效率接近100%[6]。此外,PSI还参与光合作用的多种调控过程,包括状态转换[5]以及环式电子传递[7]等。这些功能的执行都取决于光系统复合物的正确组装、不同蛋白质亚基的相互作用和众多辅因子的精确空间排布,因此,若想在分子水平上理解这些机制就需要了解这些复合物的高分辨率三维结构。本文将就高等植物C2S2和C2S2M2型PSIILHCII、PSI-LHCI及状态转换相关蛋白复合物PSI-LHCI-LHCII的结构生物学研究进展进行系统介绍。
1 C2S2型PSII-LHCII复合物
高等植物PSII由核心复合物和外周捕光天线组成,其中核心复合物包括约20个蛋白亚基,外周捕光天线由Lhcb1~Lhcb6基因编码。Lhcb1~Lhcb3编码主要捕光蛋白,形成同源或异源三聚体LHCII;Lhcb4~Lhcb6依次编码CP29、CP26和CP24三个次要捕光蛋白,它们均以单体形式存在[8]。高等植物PSII超大复合物的结构生物学研究已经有二十多年的历史。早在1995年,菠菜C2S2型PSII-LHCII复合物低分辨率(25Å)的电镜二维投影模型就被报道。科学家推测PSII-LHCII以二体形式存在,其核心复合物二体通过次要捕光天线与两个主要捕光天线LHCII相连[9]。2000年,英国科学家又报道了该复合物分辨率为24 Å的三维模型[10],并于2006年将该复合物模型分辨率进一步优化到17 Å[11]。虽然该模型分辨率有所提高,但仍不足以提供任何结构细节。在此期间,来源于原核蓝细菌的PSII分辨率为3.8 Å的晶体结构被报道[12],并于2011年获得了1.9 Å的高分辨率结构[13],提供了大量PSII核心亚基组装及能量传递的信息,但是来源于植物的PSII-LHCII高分辨率结构一直未被解析。由于蓝细菌PSII不结合跨膜的捕光蛋白LHCII,因而LHCII和PSII核心间的装配细节和机制仍不清楚。正是由于植物PSII核心结合多个LHCII,并且数量不均一,导致植物PSII更为复杂多样,对其进行结构研究难度极高。
直到2016年,高等植物PSII-LHCII复合物第一个高分辨率结构才被报道[14],这是菠菜来源的C2S2型PSII-LHCII复合物3.2 Å分辨率的单颗粒冷冻电镜结构。该结构为同源二聚体,每个单体中构建了25个蛋白亚基、105个叶绿素、28个类胡萝卜素(Car)以及一些其他辅因子。核心复合物包含内在大亚基D1、D2和内周捕光天线CP43、CP47,在它们周围结合有12个跨膜的小亚基(PsbE、PsbF、PsbH~PsbM、PsbTc、PsbW、PsbX和PsbZ) (图1(a))。另外,还有结合在类囊体腔侧的4个放氧中心外在蛋白(PsbO、PsbP、PsbQ和PsbTn) (图1(b))。核心复合物中只有D1、D2、CP43、CP47结合多个色素分子,其他蛋白亚基基本不结合色素分子。此外,每个PSIILHCII单体结合3个外周天线蛋白,其中S-LHCII和CP26结合在PSII核心靠近CP43的一侧,CP29结合在靠近CP47的一侧。

图1 菠菜C2S2型PSII-LHCII复合物的结构(PDB: 3jcu):(a)从基质侧观察,一个单体用表面图显示,另一个单体的12个小亚基用卡通模式(用单字母标注),其余亚基用灰色飘带模式显示(黑色虚线表示两个PSII单体的分界线,图中黑色椭圆圈出的部分是CP29的N端与核心亚基相互作用区域);(b)从类囊体腔侧方向观察,外周蛋白PsbO、PsbP和PsbQ形成一个近似的三角形,一个单体用表面图显示,另一个单体除PsbO、PsbP和PsbQ用卡通模式外,其余亚基用灰色飘带模式显示;(c)复合物中的LHCII单体与CP26结构比较(图中只展示了LHCII的色素,其中LHCII比CP26多的2个色素用粗棍状模式显示且进行了标注,其余色素用细线状模式显示);(d)复合物中CP29与单独CP29的结构(PDB: 3pl9)比较(其N端结合的两个色素用粗棍状模式显示并进行了标注,其余色素用细线状模式显示)。图中色素的颜色设置为:叶绿素a,绿色;叶绿素b,蓝色;类胡萝卜素,品红色
高等植物PSII核心相对于蓝细菌比较保守,绝大部分亚基的位置、功能均相同,如PsbTc、PsbL和PsbM介导PSII二聚体化,PsbE和PsbF共同结合一个血红素组成细胞色素b559(Cyt b559),保护反应中心,避免光损伤[15]。但是PsbW是植物、真核藻类所特有的一个亚基。之前有研究发现,在PsbW表达缺失的情况下检测不到PSIILHCII复合物的存在[16],在结构中PsbW位于S-LHCII和核心复合物之间,介导了它们之间的相互作用,从而解释了之前的实验现象。PSII腔侧亚基可以稳定锰簇(Mn4CaO5)结合蛋白,对优化放氧有重要作用,在不同光合生物中有一定差别。植物中PsbO、PsbP和PsbQ形成一个三角形(图1(b)),围绕在D1和CP43结合锰簇的腔侧结构域外部,其中PsbO与蓝细菌的PsbO在复合物中的位置基本一致,但PsbP和PsbQ结合位置与蓝细菌PSII腔侧亚基PsbU和PsbV的结合位置明显不同[13]。
该结构中LHCII、CP29和CP26三种捕光天线结合的位置、精确朝向及与核心的装配细节均得到了阐明,其中主要捕光天线S-LHCII与之前报道的LHCII晶体结构[17]基本一样,每个单体结合14个叶绿素(8个叶绿素a和6个叶绿素b)和4个类胡萝卜素分子(图1(c))。菠菜C2S2型PSII-LHCII复合物结构首次展示了次要捕光蛋白CP26的完整结构。CP26是所有次要捕光复合物中与LHCII单体序列同源度最高的,其蛋白结构也与LHCII的单体相似(图1(c))。早期基于生化和光谱数据预测CP26共结合9个叶绿素(6个叶绿素a和3个叶绿素b)和2~3个类胡萝卜素分子[18],而结构解析后发现CP26共结合13个叶绿素(9个叶绿素a和4个叶绿素b)和3个类胡萝卜素分子。相比于LHCII,CP26只缺少605位的叶绿素和V1位置的类胡萝卜素(图1(c)),其余色素结合位点完全一致[17]。之前有研究发现Lhcb1/Lhcb2基因表达缺失后,CP26被大量表达,并与Lhcb3蛋白形成异源三聚体,取代LHCII三体发挥作用[19],而其他次要捕光天线蛋白均没有这个功能。这个现象与结构信息一致,表明CP26与LHCII高度相似。CP29是植物PSII中最大的外周捕光天线蛋白,其晶体结构早在2011年就被报道[20],但晶体结构中CP29的N端87个氨基酸残基未被构建,完整的带有N端结构域的CP29结构是在菠菜PSII-LHCII复合物结构中获得的(图1(d))。CP29的N端结构域是一个以loop为主的灵活区域,在复合物中与PSII核心复合物紧密结合在一起(图1(a)),从而被稳定。从结构分析,单独CP29蛋白的N端是不稳定的,这解释了其N端在CP29晶体结构中缺失的现象,CP29全长蛋白结构可能只有在复合物中才能被解析。结构显示CP29的N端结构域还结合两个叶绿素分子(图1(d)),这在以前报道的晶体结构中也是没有的。综合CP29的结构信息,可知CP29结合14个叶绿素(10个叶绿素a和4个叶绿素b)和3个类胡萝卜素分子。在植物PSII-LHCII复合物中,CP26和CP29分别与核心亚基CP43和CP47直接结合。此外,2个跨膜小亚基PsbH和PsbZ进一步稳定了二者与核心的相互作用。
2 C2S2M2型PSII-LHCII复合物
C2S2M2型PSII-LHCII低分辨率模型早在2001年就被报道[21]。2009年,法国和荷兰研究团队从拟南芥中分离纯化到一系列不同类型的PSIILHCII复合物[22],通过生化和单颗粒电子显微镜的方法首次鉴定了复合物的蛋白组成,并得到了C2S2M2型PSII-LHCII分辨率为12 Å的二维投影模型,通过这个模型可以大致确定捕光天线的位置和朝向。2017年,来自欧洲的研究团队和来自中国科学院生物物理研究所的团队分别报道了植物C2S2M2型PSII-LHCII的冷冻电镜结构:欧洲团队解析了拟南芥PSII-LHCII的结构,但分辨率较低,仅为5.3 Å[23];中国科学院生物物理研究所研究团队报道了分别在酸性和中性pH条件下纯化得到的豌豆C2S2M2型PSII-LHCII的两个结构,分辨率分别为2.7 Å和3.2 Å[24],其中2.7 Å是当时所有通过单颗粒冷冻电镜解析的膜蛋白复合物结构中分辨率最高的。
在高分辨率豌豆PSII-LHCII结构中,几乎所有PSII-LHCII蛋白亚基和辅因子的位置、取向、相互作用均被准确揭示(图2(a)和(b))。两种C2S2M2型PSII-LHCII的结构非常相似,并且其C2S2部分与菠菜C2S2型PSII-LHCII结构高度一致。酸性及中性条件提取的复合物中每个单体分别构建了28和27个蛋白亚基、157个叶绿素分子、44个类胡萝卜素分子及其他一些辅因子。相比于C2S2型PSII-LHCII,每个C2S2M2型PSIILHCII单体在CP29一侧额外结合1个M-LHCII和1个CP24。基于高质量电镜密度和序列分析,发现在M-LHCII中与CP24相互作用的亚基为Lhcb3(图2(a)),这是首次通过结构生物学方法区分组成LHCII三体中的不同亚基。CP24是PSII中最小的捕光天线,其结构也是在该复合物中首次被解析(图2(c)),其脱辅基蛋白与其他LHC蛋白相似,包含3段跨膜螺旋(从N 端到C端依次命名为B、C、A),但C末端更短。此外,CP24的AC loop(A和C两个跨膜螺旋之间的连接区域)比其他所有PSII捕光天线蛋白的AC loop都要长。CP24共结合11个叶绿素分子,其中8个靠近基质侧,形成椭圆环形,另外3个呈簇状靠近类囊体腔侧。CP24还结合3个类胡萝卜素分子。之前的研究一直认为CP24只结合2个类胡萝卜素分子[25],结构解析后发现CP24中N1位点的类胡萝卜素位于CP24和CP29界面处,与CP29的两个叶绿素分子相互作用并被稳定,因而单独提纯CP24时这个类胡萝卜素很可能丢失而未被鉴定出来。
在C2S2M2型P S I I-L H C I I复合物中,S-LHCII、CP26及CP29彼此之间以及与核心之间均有大量相互作用,但M-LHCII和CP24与其他亚基的相互作用较少,且不与核心直接接触。M-LHCII仅通过Lhcb3与CP24直接相连,除了Lhcb3外,CP24也仅与CP29紧密相互作用(图2(d))。这些相互作用均有CP24的AC loop参与,说明CP24中较长的AC loop对于复合物的组装非常重要。M-LHCII和CP24与核心相对较弱的相互作用可能与其对环境的适应相关,确保了这两种捕光天线在不同光照条件下与C2S2的快速结合和解离。另外,结构还显示在CP24与核心复合物之间有一个55 Å×30 Å的缝隙(图2(a)),推测该区域有可能是光保护蛋白PsbS的结合位点,在强光下PsbS的结合可能诱导该区域的局部构象变化,使M-LHCII和CP24从PSII上解离,从而减少捕光。
两种C2S2M2型PSII-LHCII复合物结构的主要区别在类囊体腔侧的放氧中心外在蛋白。酸性条件下PSII稳定结合PsbO、PsbP和PsbQ三个亚基,而中性条件的PSII只稳定结合PsbO和PsbTn两个亚基,且PsbO的结构在酸性条件下提取的PSII复合物中更为完整,从而更好地稳定锰簇,因此酸性条件下的PSII中锰簇结构清晰可见,而且其放氧活性明显高于中性条件获得的PSII,这也与生理条件下植物类囊体腔侧的pH值偏酸性是一致的。
豌豆C2S2M2型PSII-LHCII高分辨率结构展示了不同外周捕光蛋白彼此之间以及它们与核心复合物之间相互识别和装配的位点和机制,基于复合物内部高度复杂的色素网络提供了外周天线捕获光能并向核心传递能量的可能途径(图2(e))。此外,该结构还揭示了复合物中外周捕光天线M-LHCII和CP24与C2S2的结合相对灵活,从而使得PSII复合物可对环境条件的变化做出响应,通过整体结构的变化实现对捕光过程调节。
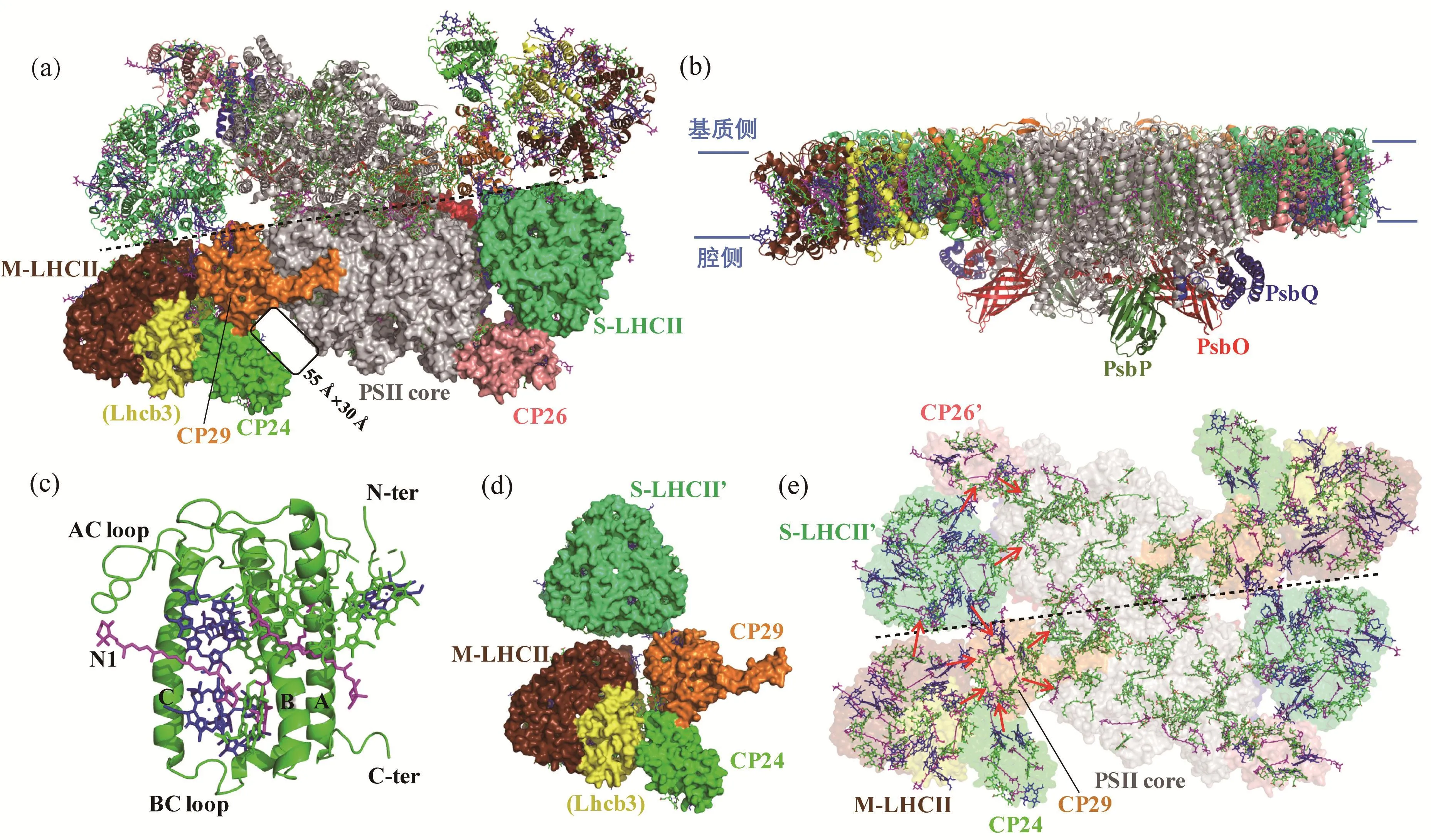
图2 豌豆C2S2M2型PSII-LHCII复合物的结构(PDB: 5xnl):(a)从基质侧观察,一个单体用卡通模式,另一个单体用表面图展示(黑色虚线表示两个PSII单体的分界线);(b)从与类囊体膜平行的方向观察;(c)次要捕光蛋白CP24结构;(d)表面图展示S-LHCII’、M-LHCII、CP29与CP24几个蛋白彼此之间的相互作用;(e)复合物的叶绿素分布及潜在的能量传递途径。图中标注’表示另一个单体中的亚基。色素颜色设置为:叶绿素a,绿色;叶绿素b,蓝色;类胡萝卜素,品红色
3 PSI-LHCI复合物
高等植物的PSI-LHCI相比于PSII-LHCII更加稳定。早在2003年,以色列科学家就解析了豌豆PSI-LHCI分辨率为4.4 Å的晶体结构[26],后来又将该结构的分辨率推进到3.4 Å[27]。PSI-LHCI整体结构像一个扇形,4个捕光天线Lhca1~Lhca4以两个异源二聚体的形式(Lhca1-a4和Lhca2-a3)结合在PSI核心一侧,形成LHCI带(LHCI belt),但是限于分辨率,该结构还不能准确区分色素分子。2015年,来自中国科学院植物研究所和日本冈山大学的科研团队与上述的以色列团队分别报道了豌豆PSI-LHCI 2.8 Å分辨率的晶体结构[28-29]。两个团队解析的结构非常相似,均包含12个核心亚基(只缺少PsaN和PsaO)和4个外周天线(图3(a)和(b)),构建的辅因子也基本一致,但有一定的差别,前者定位了155个叶绿素(143个叶绿素a和12个叶绿素b)和35个类胡萝卜素,而后者构建的辅因子为156个叶绿素(147个叶绿素a和9个叶绿素b)和32个类胡萝卜素。后来,两个研究团队又分别将该复合物的分辨率提高到了2.4 Å和2.6 Å[30-31],但辅因子仍略有差异。
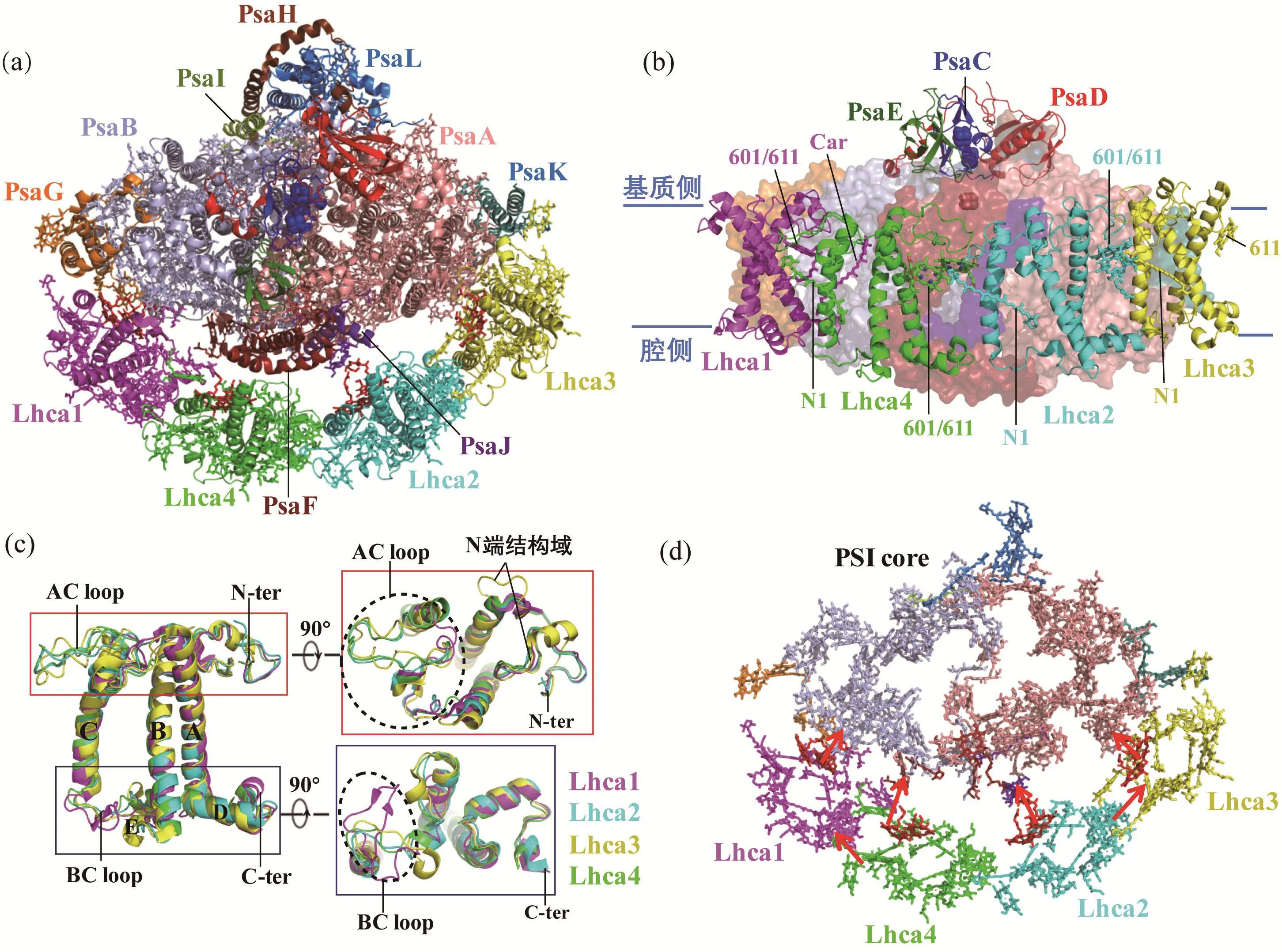
图3 豌豆PSI-LHCI复合物的结构(PDB: 4xk8):(a)从基质侧观察;(b)从与类囊体膜平行方向观察(LHCI和基质侧三个亚基PsaC~PsaE用卡通模式展示,其余用表面图展示,色素仅展示参与LHCI相互作用601、611、N1位点的色素及Lhca1-a4与核心之间的Car);(c)4个Lhca脱辅基蛋白结构比较;(d) PSI-LHCI中色素分布及可能的能量传递途径。图中所有色素的颜色除LHCI中红叶绿素设置为红色外,其余均与其所在亚基的颜色一致
结构中构建的12个核心亚基包括9个膜蛋白(PsaA、PsaB和PsaF~PsaL)和3个位于类囊体基质侧的水溶蛋白(PsaC~PsaE)。与PSII不同,PSI中所有跨膜蛋白亚基,包括跨膜小亚基,均结合色素分子。此外,PsaA和PsaC还分别结合1个和2个铁硫簇,参与电子传递。复合物中4个LHCI(Lhca1-a4-a2-a3)结合在核心PsaG-PsaFPsaJ-PsaK一侧,并分别与这些亚基相互作用。
PSI捕光天线Lhca1~Lhca4脱辅基蛋白与其他捕光天线LHC结构相似,且4个Lhca蛋白的3段主要跨膜螺旋能够很好地叠合,其结构差异主要在AC loop、BC loop(B和C两个跨膜螺旋之间的连接区域)以及两个末端(图3(b)和(c)),这些区域在序列上也是最不保守的部分。4个Lhca蛋白结合的色素数量和位置也基本相似,并有各自独特的特征,每个Lhca蛋白结合14~15个叶绿素和3个类胡萝卜素。此外,在Lhca1-a4二体与核心之间还额外结合1个类胡萝卜素,这些蛋白亚基和色素分子的差异与不同天线蛋白的相互作用以及能量传递密切相关。
在LHCI带内部,一个Lhca的AC loop与相邻的另一个Lhca相互作用,此外,N1位点的类胡萝卜素与相邻亚基的叶绿素对(601-611)相互作用(图3(b)),这些相互作用稳定了LHCI带。Lhca1的AC loop比其他三个Lhca的AC loop短得多(图3(c)),这可能决定了Lhca1位于LHCI带末端的位置,不需要AC loop与其他天线蛋白相互作用;而Lhca3没有叶绿素601(图3(b)),这与其位于LHCI带另一个末端一致,没有相邻亚基的N1位点的类胡萝卜素与之相互作用。另外,Lhca3的N末端较长,而Lhca1的BC loop较长(图3(c)),分别参与它们与核心亚基PsaA、PsaG的结合。与此相应,在LHCI带中,位于两侧的Lhca1、Lhca3与核心结合紧密,位于中间的Lhca2、Lhca4与核心结合相对松散。之前的研究发现PSI的4个天线蛋白不能彼此替代[32],结构显示,正是由于这些LHCI蛋白结构上的差异导致了不同天线蛋白彼此之间,以及与核心复合物之间相互作用的独特性。此外,在Lhca1-a4二体与核心之间结合的类胡萝卜素分子参与稳定Lhca1-a4二体,这可以解释之前实验结果发现的Lhca1-a4二体比Lhca2-a3二体更稳定[33]。
与Lhca1、Lhca3与核心紧密结合相应,位于LHCI带两侧的Lhca1、Lhca3向核心传递能量也更为高效,而位于中部的Lhca2、Lhca4与核心的叶绿素距离较远,向PSI核心传递能量效率较低,而且很可能需要通过Lhca1、Lhca3的介导将能量向核心传递。根据结构中色素分布信息,科研人员提出了LHCI向PSI核心能量传递的潜在途径(图3(d))。
与LHCII不同的是,每个LHCI均结合有一对红叶绿素,推测是a603-a609叶绿素对,结构显示这两个叶绿素的卟啉环彼此靠近,近乎平行,确实具有红叶绿素对的特征。4对a603-a609均位于LHCI与核心复合物的界面处(图3(d))。由于红叶绿素能级更低,因而其向核心的能量传递被称为“爬坡”(up-hill)[34]。“爬坡”的机制还有待阐明,但红叶绿素的存在被认为有以下意义:首先,红叶绿素能够吸收更长波长的光,从而扩展了LHCI的捕光范围[35];其次,虽然PSI相对于PSII更加稳定,但是在电子受体不足的情况下仍然会发生损伤[36],而红叶绿素的存在在一定范围内减慢了光能从天线蛋白向核心的传递速率,因而与PSI的光保护相关。
4 状态转换复合物PSI-LHCI-LHCII
状态转换的现象早在1969年就被Murata等人发现[37],该过程是受叶绿体激酶STN7和磷酸酶PPH1/TAP38调控的[38-39]。在状态1时,LHCII主要结合在PSII上;状态2时,LHCII会被磷酸化,并有部分磷酸化的LHCII迁移到PSI上,与之形成PSI-LHCI-LHCII复合物。2005年,Kouril等人通过对类囊体膜增溶、负染的方法得到了该复合物分辨率为16 Å的二维投影模型[40]。2012年,Galka等人通过蔗糖密度梯度离心分离纯化到了PSI-LHCI-LHCII复合物[41],并通过生化实验等揭示在状态1时与PSII松散结合的LHCII(LLHCII)是主要参与状态转换的LHCII类型,在状态2时可以与PSI紧密结合在一起。
2018年,同样是来自中国科学院生物物理研究所的团队通过单颗粒冷冻电镜的方法解析了玉米来源的PSI-LHCI-LHCII分辨率为3.3 Å的结构[42](图4(a))。该复合物是一个分子量约700 kDa的膜蛋白-色素复合物,结构中精确指认了21个蛋白亚基,定位了202个叶绿素分子、47个类胡萝卜素分子以及众多的其他辅因子。结构显示1个LHCII结合在PSI的LHCI带对面PsaA亚基一侧,与PsaL、PsaH、PsaO和PsaK相互靠近。有意思的是,从类囊体膜侧面观察,该复合物并不在一个平面内,LHCII与PSI之间形成一个大约10°的夹角(图4(b)),而且电子断层成像结果也显示植物类囊体膜是弯曲的,在某些位置形成一定的角度[43],这表明天然膜和嵌在其中的膜蛋白可能影响彼此的结构。

图4 玉米PSI-LHCI-LHCII复合物的结构(PDB: 5zji):(a)从基质侧观察;(b)从与类囊体膜平行方向观察(该图为了清晰省略了色素);(c)PsaN的结构;(d)PsaO的结构;(e)Lhcb2 磷酸化的N末端与PSI核心形成的口袋的相互作用,口袋部分用表面电势图显示(红色表示负电势,蓝色表示正电势)。图中色素的颜色设置为:叶绿素a,绿色;叶绿素b,蓝色;红叶绿素,红色;类胡萝卜素,品红色
在已经解析的植物高分辨率PSI-LHCI晶体结构中[28-31],没有PsaN和PsaO两个核心亚基,而在PSI-LHCI-LHCII结构中则构建了包括PsaN和PsaO在内的PSI的全部亚基。PsaN是真核绿藻和植物PSI特有的,是PSI唯一位于类囊体腔侧的膜外在亚基,有三段α螺旋并结合两个叶绿素分子(图4(c))。PsaN位于PsaA和Lhca2中间(图4(a)),其结合的叶绿素介导了Lhca2向PsaA快速的激发能传递,很好地印证了之前报道的荧光光谱实验结果[44],表明激发能可以直接从Lhca2传递到PSI核心。PsaO有两段跨膜螺旋,并结合有两个叶绿素(图4(d)),位于LHCII与PsaA之间,介导了LHCII与PSI的结合及激发能的传递。此外,除了介导LHCII与PsaA结合,PsaO同时也被LHCII与PsaA的结合所稳定。由于PsaO位于PSI外侧,单独纯化PSI时PsaO容易脱落,而LHCII与PSI其他亚基的相互作用也进一步稳定了PsaO。
与PSI结合的LHCII三体中有一个单体与PSI核心直接相互作用,根据电镜密度和氨基酸序列可以判断该亚基是Lhcb2,其N端第三个氨基酸是被磷酸化的苏氨酸(pThr),前两个氨基酸都是碱性的精氨酸(Arg)。该结构中Lhcb2的N端形成绳索样结构,绳索末端搭在PSI表面的一个浅的口袋中。这个口袋主要由酸性氨基酸组成,口袋内部带有很强的负电,从而与2个Arg相互吸引,口袋另一侧带有正电,与苏氨酸的磷酸基团相互作用(图4(e))。Lhcb2只通过这3个氨基酸与PSI 核心形成直接氢键作用。结构显示pThr对于PSI与LHCII之间的识别以及复合物的形成非常关键,这解释了磷酸化的LHCII能够与PSI结合,而去磷酸化的LHCII会离开PSI的现象。该结构不仅完善了LHCI向PSI核心传递激发能的途径,也全新构建了磷酸化LHCII向PSI核心传递激发能的途径,为理解状态转换的分子机制提供了结构基础。
5 展望
虽然高等植物PSI和PSII的结构目前已经取得一系列重要进展,为深入理解其组装、光能吸收及能量传递等分子机制提供了最基本的信息,仍存在很多未解决的问题。例如,PSI-LHCILHCII虽然已经有高分辨率结构报道,但还有文献报道植物中可能有更大更复杂的PSI-LHCILHCII复合物[45-47],解析这些复合物的结构可以使人们更加全面地理解状态转换的分子机制。高等植物C2S2M2L2型PSII-LHCII[2]、两个或多个PSII结合在一起的超级复合物形式目前都还只有低分辨率的二维模型报道[48-49],这些复合物都有待高分辨率结构进一步提供其装配细节,揭示其能量传递途径。此外,植物光保护的分子机制是光合作用研究领域最受关注的科学问题之一,参与光保护的蛋白PsbS虽然已有晶体结构[50],但其在PSII中的具体结合位置还只是推测,没有实验证据,对于PsbS如何作用于PSII发挥其光保护的机制也有待进一步揭示。另外,PSII中锰簇催化水裂解并释放氧气的具体过程及机制也有待阐明。
对于光合作用的结构生物学研究不仅有助于深入理解其作用机理和调节机制,而且可以为相关的应用研究提供基础和信息。目前在基于天然PSII锰簇结构进行人工仿生模拟方面已经取得一定的进展[51],未来有望发展出催化水裂解放H2的催化剂。最近在对光保护研究的基础上发现改变植物中非光化学淬灭(NPQ)的弛豫(relax)时间[52],构建光呼吸支路[53-54],能够提高作物生物量。相信随着更多光系统复合物高分辨率结构的解析,我们能够更加深入理解光合作用及光保护的分子机制,并为解决作物增产、绿色能源开发等提供更多的思路和线索。
