欧洲四国关于CAR-T细胞治疗的卫生技术评估经验及其对产品市场准入路径的影响
2021-06-25王春露MattiasKyhlstedt于保荣
王春露,吴 妍,许 效,Mattias Kyhlstedt,于保荣
(1 SynergusRWEAB,Stockholm 11331,Sweden;2 南京愈方生物科技有限公司,南京 210043;3 对外经济贸易大学保险学院,北京 100029)
1 背景与目的
卫生技术评估(HTA)是指对卫生技术的性质、效果及其影响进行的系统评估。在欧洲,HTA机构就药品进行评估并提供建议,支付方、定价和报销及相关机构依靠HTA结果[1]:对比新产品与现有治疗手段的差异、确定报销状态、支持价格谈判过程。在英国,国家卫生与临床优化研究所(NICE)负责组织对申请进入报销目录的药品进行HTA,并作出医保准入结论[1-2]。德国联邦联合委员会(G-BA)基于HTA评估结果等证据做出的决策,是保险机构和制药企业之间进行产品准入谈判的证据基础;卫生服务质量与疗效研究院(IQWiG)等独立第三方评估机构受G-BA委托,开展HTA项目[1,3]。法国国家卫生管理局(HAS)的2个下属部门参与HTA[1],其中透明度委员会(TC)评估药品的临床疗效,并将其与现有疗法进行比较,得到2组评估结果,包括治疗价值(SMR)和增量治疗价值(ASMR);经济与公众健康评估委员会(CEESP)进行卫生经济学评估。瑞典新治疗委员会(NT Council)在产品上市的1~2年前即开始进行筛选,以确定候选药品,并委托瑞典牙科及医药福利局(TLV)进行HTA。该结果决定产品是否被纳入瑞典国家药品福利计划(医保药品目录),以供各地方政府采购[1]。
嵌合抗原受体T细胞(CAR-T)是指经过基因工程改造以产生用于免疫治疗的T细胞。CAR-T免疫细胞疗法是指从患者体内采集T细胞,经过修饰后增强识别癌细胞的能力,以使其更具靶向性;然后,将产生的CAR-T细胞注入患者体内,以进行肿瘤治疗[4-5]。
欧洲药品管理局(EMA)分别批准了诺华制药(Norvatis Pharma)的Kymriah®(tisagenlecleucel)和吉利德科学(Gilead Sciences,Kite Pharma的母公司)的Yescarta®(axicabtageneciloleucel)2款CAR-T产品的上市许可[6]。其中,Kymriah于2018年8月22日被批准用于治疗在25岁以下人群复发或难治性B细胞急性淋巴细胞白血病(ALL)和成人复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的三线或以上治疗[7];Yescarta于2018年8月23日被批准用于成人复发或难治性DLBCL和原发纵隔大B细胞淋巴瘤(PMBCL)的三线或以上治疗[8]。
与欧洲监管体系类似,我国国家药品监督管理局明确了CAR-T免疫细胞治疗产品的药品属性以及法规监管路径,截至2021年5月1日,已有20多家CAR-T细胞治疗公司的产品按照生物制品的路径,向国家药品监督管理局药品审评中心提出新药临床试验(investigation new drug,IND)申请,并获准进行药品临床试验[9]。截至目前,复星凯特生物科技有限公司的益基利仑赛注射液(拟定)和上海药明巨诺科技有限公司的瑞基仑赛注射液(暂定)2个产品已向国家药品监督管理局递交了新药上市申请(NDA)并获受理[10]。CAR-T免疫细胞治疗产品在我国逐渐进入成熟阶段,即将面临产品的商业化。
CAR-T产品如何定价、以何种形式进入医保药品目录以及HTA起到怎样的作用等,都是目前各相关方关注的话题。本文希望通过分析英国、德国、法国和瑞典4个欧洲国家对2种CAR-T免疫细胞治疗产品的HTA经验,及其对产品准入路径的影响,对我国相关企业及医保部门的决策提供借鉴。
2 方法
本研究采用目标文献检索方法,以“Kymriah”和“Yescarta”作为关键词,对EMA、NICE、G-BA、HAS、TLV和NT Council等官方数据库进行检索,文章纳入范围包括Kymriah和Yescarta 2个CAR-T产品由EMA发布的评估报告以及欧洲4个国家发布的HTA报告。
在报告中,检索和收集相关数据:① 评估过程中纳入和排除的试验组和对照组数据及其原因。② 卫生经济学模型及其数据来源。③ 产品的价格。④ 评估过程中提出的不确定性考虑(包括临床疗效、成本和成本效果等)。⑤ 影响评估结果的其他因素。⑥ HTA机构的结论及其时间,结论附带的条件以及对于实施CAR-T细胞治疗的医疗机构的要求。数据保存在Microsoft Excel文件中。
3 结果
3.1 试验组的选择
2个产品申请上市许可及其在4个国家递交HTA时所采用的关键证据均为正在进行的临床试验,各机构评估的先后不同,导致了企业递交材料中的截止日期差异。
对关键性研究进行评估的同时,各国还纳入了一些辅助研究。被排除的研究主要是由于研究的样本量小或者随访期短,以及不能反映目标国家的医疗实践。2个CAR-T产品的关键性研究主要终点指标为总体反应率(ORR)和HTA机构希望看到反映真实临床疗效的指标[如总体生存期(OS)、无进展生存期(PFS)和患者生活质量等]。
Eliana(B2202)研究:针对Kymriah开展的一项对于25岁以下人群复发或难治性B细胞ALL患者的Ⅱ期、单臂、国际多中心研究,主要研究终点是3个月内的总缓解率。该研究仍在进行中。
Ensign(B2205J)研究:针对Kymriah开展的一项对于儿童B细胞ALL患者的Ⅱ期、单臂、多中心(仅在美国)研究,主要研究终点是6个月的总缓解率。该研究仍在进行中。
B2101J研究:针对Kymriah开展的一项对于儿童CD9阳性的B细胞ALL患者的Ⅰ/ⅡA期,单臂、单中心(仅在美国)研究,主要研究目的是考察该产品的不良反应和最佳剂量。该研究仍在进行中。
Juliet研究:针对Kymriah开展的一项治疗成人复发、难治性DLBCL患者的Ⅱ期、单臂、国际多中心研究,主要研究终点是总缓解率。该研究仍在进行中。
ZUMA-1研究:针对Yescarta开展的一项治疗难治性侵袭性非霍奇金淋巴瘤患者的Ⅰ/Ⅱ期、国际多中心研究。研究分3个阶段,其中Ⅱ期阶段作为关键性研究,其结果用于法规申报和HTA评估,该阶段的主要研究终点是12个月的总缓解率。该研究仍在进行中。见表1。
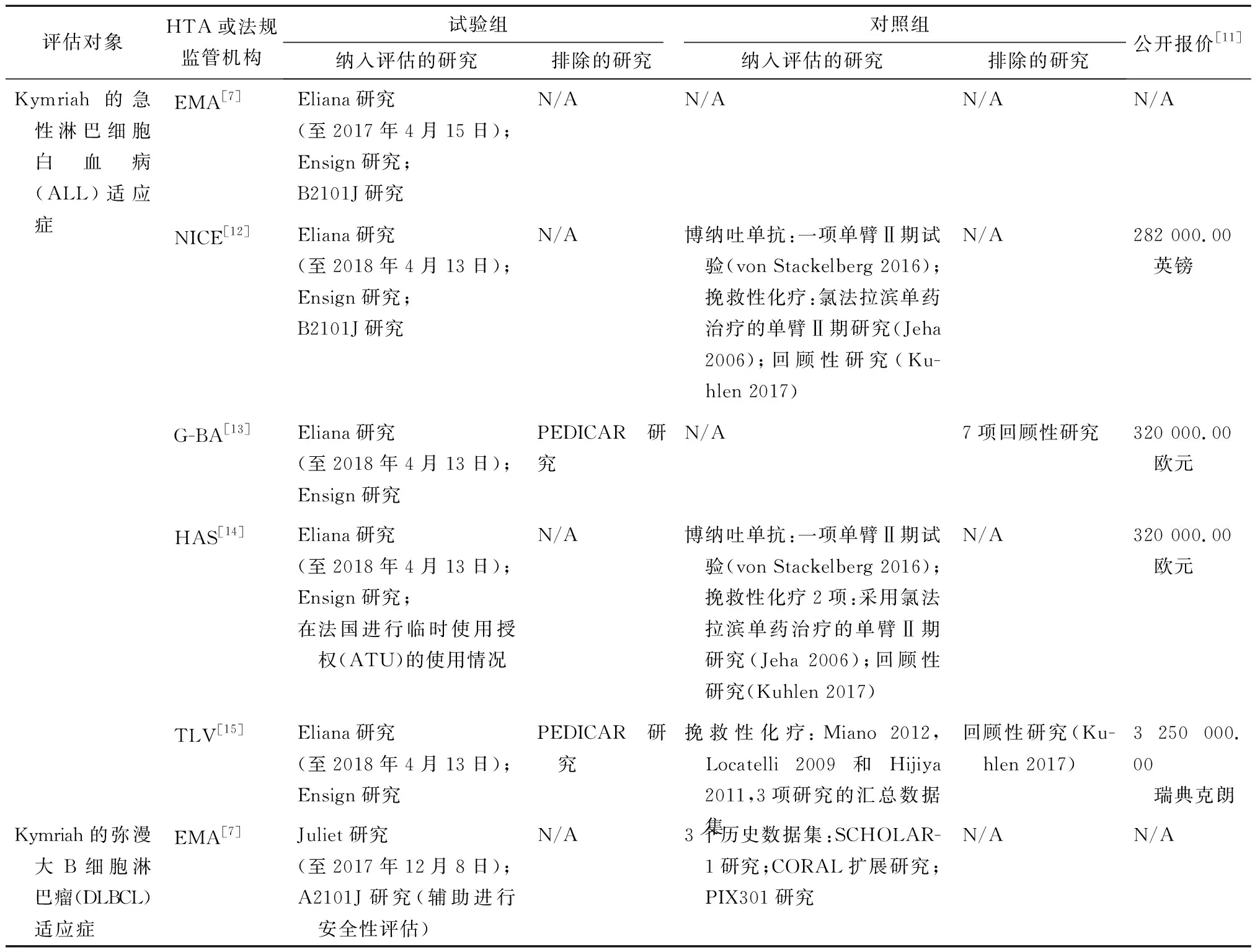
表1 4个HTA机构进行评估所采纳的试验组、对照组证据以及产品的公开报价
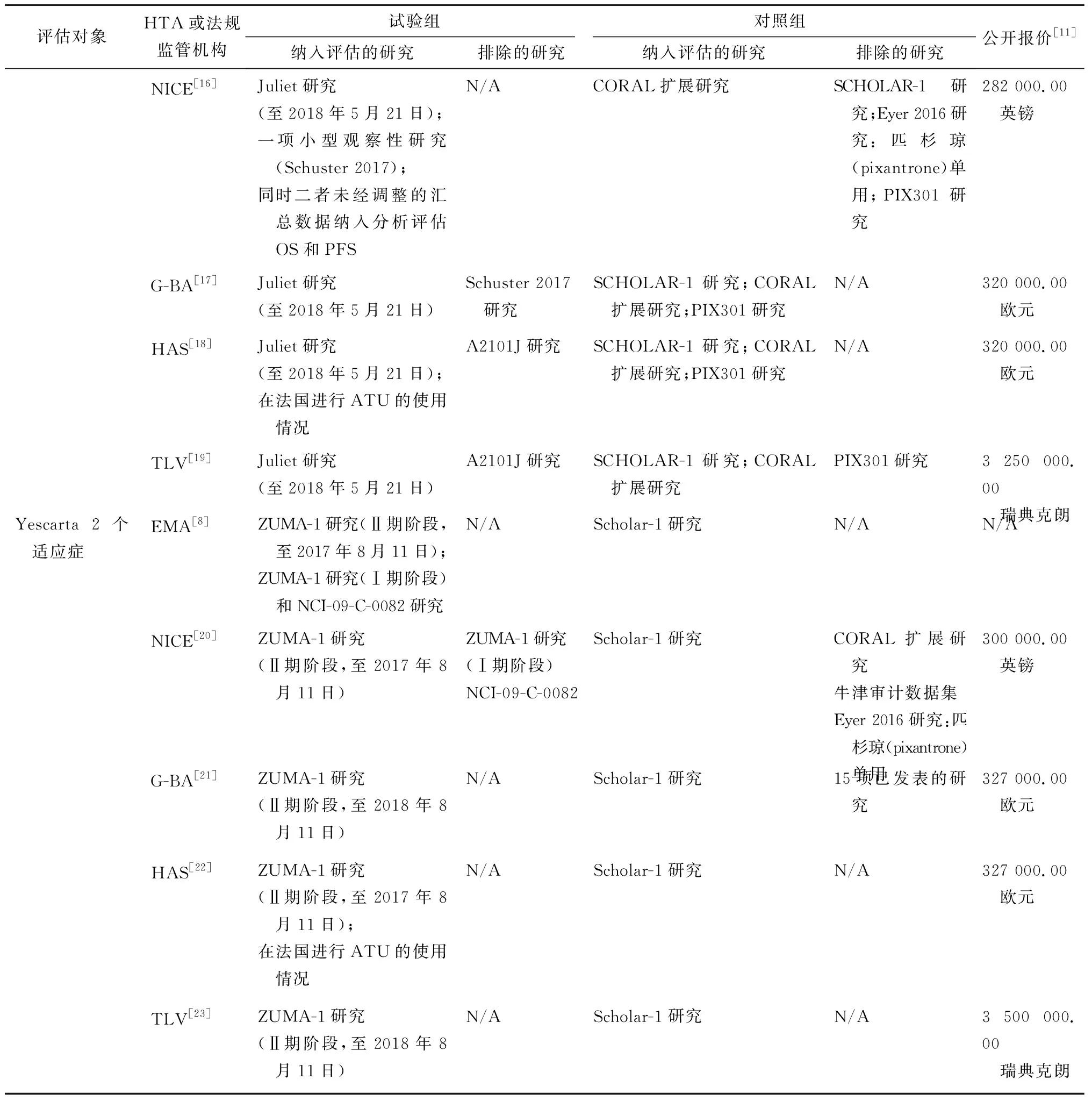
(续表)
3.2 对照组的选择
综合4个HTA机构对于对照组的选择标准以及相关的不确定性结论,合适的间接对照组应该满足以下要求:① 能够反映本国医疗实践。② 与试验组的患者基础水平一致。③ 有足够的随访时间跟踪OS等疗效指标。
3.3 证据的不确定性
没有设置直接对照组并且试验的随访期较短,不足以充分支持产品有效性或长期有效性的结论。HTA机构认为接受细胞治疗产生不良反应的可能性,以及二次CAR-T细胞治疗和后续治疗的患者比例和费用尚不明确。同时,对目标患者数量的估计存在较大的不确定性。成本效果分析的不确定结论主要包括:过高的增量成本效果比值(ICER)、患者的OS和生活质量等数据,主要依靠模型外推得到所造成的不确定性等。4个HTA机构针对Kymriah和Yescarta所提交证据的评估结果见表2。

表2 4个HTA机构针对Kymriah和Yescarta所提交证据的评估结果

(续表)

(续表)
3.4 辅助决策因素
TLV和HAS评估相关适应症的严重程度、发病率或者是否属于未被满足的医疗需求,以决定是否提高可接受的ICER阈值。NICE评估产品是否符合肿瘤药品基金(Cancer Drug Fund,CDF)的入选标准以及是否达到患者生命终结阶段的延长寿命治疗方案,来决定是否推荐该产品纳入CDF。TLV还参考了若干其他国家的评估结果。
4 HTA结论
4个HTA机构针对Kymriah和Yescarta的评估结论及其对产品市场准入的影响见表3。2个产品在4个国家的市场公开报价处于同一水平,且医保实际报销价格属于商业机密并未公开。除Kymriah的DLBCL适应症被TLV以较大的疗效不确定性为由拒绝推荐之外,2个产品的所有适应症均得到了欧洲4个国家HTA机构的正面推荐。在产品获得上市许可之前,企业与英国NICE即开展了早期沟通,使其成为欧洲国家中第一个对CAR-T疗法提出有利报销建议的HTA机构。法国的医保专项资金支持有潜在治疗价值产品的早期市场准入,即产品在获得上市许可之前,已经取得了医保报销的支持。德国和瑞典的支付方依据HTA结论进行医保谈判,拉长了产品进入医保时间。4个HTA机构的评估流程见图1。

表3 4个HTA机构针对Kymriah和Yescarta的评估结论及其对产品市场准入的影响

(续表)

(续表)
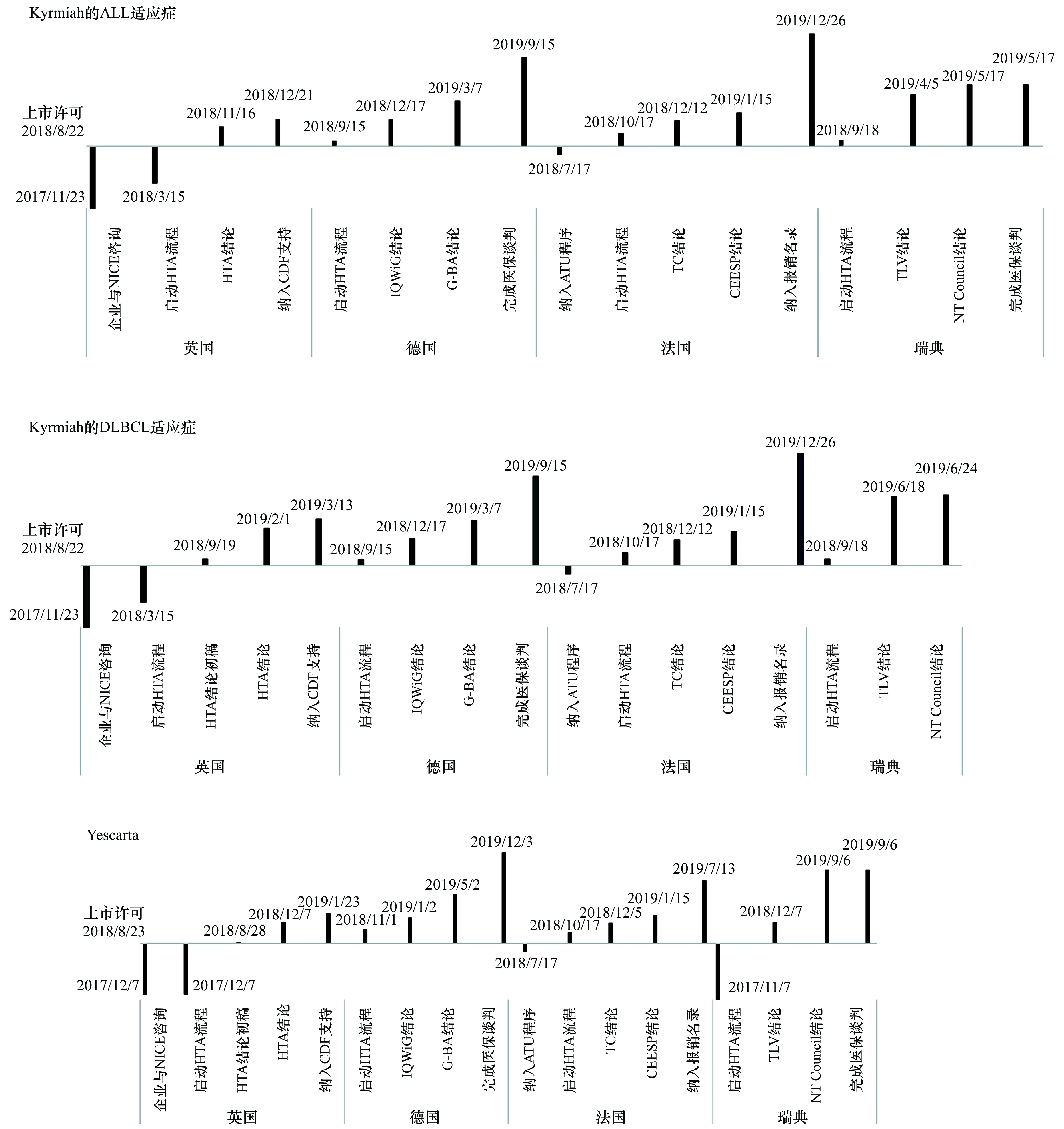
纵坐标原点:该产品获得EMA的上市许可日期;日期包括:企业与HTA咨询日期、启动HTA评估日期、得到HTA结论日期、纳入医保日期等图1 4个国家针对2个CAR-T产品的HTA评估流程及获得医保报销的进度
各HTA机构和支付方均采用管理准入协议(又称风险分担协议,MEAs)等解决决策不确定性[11,24],其中,英国和法国采用了证据发展报销(CED)协议;德国和瑞典采用了绩效关联报销(PLR)协议。NICE未推荐这2种产品在英国的常规使用,而是纳入CDF以机密的价格折扣为条件,需要制药企业和医疗机构收集产品在临床使用中的真实世界证据,以进行二次评估[25]。在法国,产品获得上市许可之前通过法国药品管理局(ANSM)临时使用授权(ATU)供患者使用。ATU途径是指在被ANSM评估为有特殊治疗前景产品,在获得EMA上市许可之前获得有限的使用许可并取得资金支持;得到HAS的正面评估结论之后,产品正式获得医保报销。德国的保险公司与制药企业签订了基于PLR类型的报销合同。根据合同,若患者在接受治疗后一定时期内死亡,则制药企业对于保险公司进行退款(无效返款),产品的实际医保支付价格是基于实际临床疗效。关于患者生存期以及未能达到生存预期导致的退款比例是商业机密;据文献估计这2个值分别为12个月和50%[11]。在瑞典,各地方政府作为医保支付方基于TLV评估结论,在NT Council的协助下与制药企业签订了报销协议,其中Yescarta的报销协议基于产品临床疗效,Kymriah的ALL适应症合同未公布细节,Kymriah的DLBCL适应症未被纳入医保目录。
5 讨论
新药的商业化能否成功取决于2个相互衔接的关键性阶段,即从法规监管机构取得上市许可和获得支付方的报销支持。对药品进行评估的过程中,法规与HTA机构的出发点不同,前者基于临床试验结果,重点关注药品的收益风险比;后者侧重于在一般临床实践中评估产品的实际疗效[26]。随着监管法规的变化,一些具有潜在治疗优势的药品会得到加速审批政策支持;但与此同时,证据的不成熟以及产品在临床疗效和费用方面的不确定性,给HTA机构和支付方带来了决策风险[27]。
以Yescarta为例,对111例先前治疗无反应或已复发的DLBCL和PMBCL患者的研究(ZUMA-1)中,47%参加研究的患者完全缓解(CR),而66%的患者至少部分缓解(PR)。EMA基于这一结果(有条件)批准了该产品2个适应症的上市许可。在HTA评估中,NICE建议制药企业对Scholar-1研究中的患者数据得分进行调整;其结果被NICE接受为最合适的对照组数据来源。制药企业所递交的成本效果分析模型中,主要疗效指标选择的PFS和OS均依靠模型推导,被认为是主要的不确定性来源。TLV和HAS探讨了对于试验组数据的处理方法,即ITT和mITT之间的选择。2个HTA机构认为治疗始于白细胞分离术并涉及多个步骤,如果排除经历了白细胞分离术但因其他原因死亡或离开研究的患者(采用mITT方法),可能会导致CAR-T的成本效果被高估,原因是被排除的患者可能预后较差,意味着其病情更重或疾病进展更快,或者这些患者可能在等待Yescarta的同时接受了其他治疗。
4个国家所采用的2种不同类型的管理准入协议有共同的优点,包括为产品提供早期的市场准入机会,保证制药企业尽早收回研发投入并且提高患者的可及性。被英国和法国采用的CED模式可以收集产品的真实世界证据,为二次决策提供依据。这一类型的协议在实施过程中产生了巨大的管理成本;而且由于研究的入排标准,会削弱部分患者的可及性,降低产品覆盖面[24]。PLR模式采用以疗效为基础的支付方式,若临床应用中未达到约定的治疗效果,则制药企业提供折扣、退款等方式对支付方进行偿还,而不必降低产品的公开报价。德国和瑞典在实施PLR协议的过程中依靠其高质量的患者登记队列,降低支付方的管理成本[28];但是达成PLR协议的谈判过程,会延缓产品进入医保的速度。这一定价模式对采用国际参考价格(IRP)来进行本国产品定价的国家影响巨大[29]。本研究中所涉及的4个欧洲国家,其医保价格经常被选择作为价格参考,在产品商业化的早期以较高的市场公开报价在这些国家进入医保目录,对于制药企业的国际化布局具有深远影响。
HTA同样在我国的医保药品谈判中起到了巨大的作用。了解欧洲国家对于CAR-T产品的HTA经验,可以为我国的医保支付方进行相关产品的决策提供借鉴,帮助相关制药企业优化市场准入策略。本文期待通过对4个欧洲国家有关CAR-T产品HTA经验的分析提供了以下3方面的启示。
① 建立企业与HTA机构的沟通机制。欧洲国家的HTA机构与药企之间有成熟的沟通的渠道,缩短产品从上市到通过HTA以及进入医保的时间。在我国,国家药品监督管理局药品审评中心已经建立起申请人与审评单位的沟通机制;期待在不久的将来医保支付方及相关机构有机会参与到此沟通机制中,为药品的加速开发带来可能。
② 平衡法规监管部门与HTA机构的证据要求。加速审评制度的引入使得一些具有潜在收益风险比的药品能够加速获得(有条件的)上市许可。在这一制度下,产品在获得上市许可时的证据尚不成熟,在临床疗效、成本和成本-效果等方面具有巨大的不确定性。随着药品审批和医保相关政策的不断完善,一部分责任和风险正在由药品监管部门向HTA机构和医保支付方加速转移。
③ 利用管理准入协议协助管理决策的不确定性。管理准入协议的引入,通过支付方式的改变而进行有条件的医保准入,改变了药品只能以降低价格换取进入医保报销目录资格的决策模式。选择管理准入协议的类型,需要依据协议的优缺点、产品的不确定性以及医疗实践来确定。
6 结论
在HTA的过程和医保准入协议制定的过程中,HTA机构和支付方的出发点均在于本国的医疗实践,及其所覆盖的患者真实情况和医疗资源供给情况。本文研究了4个欧洲国家的HTA机构对于CAR-T细胞治疗产品的评估过程、得到的评估结论以及HTA机构和支付方为解决不确定性所采取的措施,为后续产品提供经验参考;有针对性地整理和递交合适的证据,以取得积极的HTA结论以支持产品的市场准入过程,最终实现患者对此类产品可负担的可及性。
