囊性胰腺神经内分泌肿瘤的临床病理特征及预后分析
2021-06-25李国瑞邱法波周斌杨丹丹曲腾飞查立超何向阳郭锦辉
李国瑞 邱法波 周斌 杨丹丹 曲腾飞 查立超 何向阳 郭锦辉
1青岛大学附属医院肝胆胰外科,青岛 266003;2青岛大学附属医院病理科,青岛 266003;3淄博市中心医院肝胆外科,淄博 255036
【提要】 回顾性分析72例行手术治疗的胰腺神经内分泌肿瘤(pNETs)患者的临床资料,其中囊性pNETs 11例,实性pNETs 61例,比较分析两组患者术前、术后的相关临床资料和病理学特征。与实性pNETs组比较,囊性pNETs多为无功能性pNETs,肿瘤多位于胰尾,体积更大,Ki-67值更低,且较少出现胰周侵犯,神经细胞黏附分子(CD56)阳性率低,差异均有统计学意义(P值均<0.05)。囊性pNETs预后优于实性pNETs。
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,pNETs)来源于胰腺导管和腺泡细胞的多能干细胞[1],在胰腺肿瘤中占1%~2%,是所有胰腺肿瘤中第二常见的类型[2],根据是否伴随相应的内分泌症状可分为功能性和无功能性两类。pNETs多表现为实性病变,囊性pNETs较为少见[3]。囊性pNETs在1940年由Thigpen等首次报道[4],临床罕见,通常为无功能性[5],无特异性的临床表现,术前诊断困难。囊性pNETs的形成机制尚不清楚,目前认为可能与肿瘤坏死或出血有关[6-9]。国内罕见对囊性pNETs患者临床资料和病理学特征做相关研究,故本研究分析总结单中心的囊性pNETs与实性pNETs的临床资料和病理学特征,以期提高对囊性pNETs的认识。
一、资料与方法
1.病例资料:收集2000年1月至2019年7月间青岛大学附属医院系统数据库中72例行胰腺手术治疗并经病理确诊的pNETs患者的临床资料,所有患者均无其他恶性肿瘤病史且未合并严重的器官功能障碍。根据影像学和病理学检查结果将患者分为囊性pNETs组(11例)和实性pNETs组(61例)。本研究经医院伦理委员会批准(批件号QYFYWZLL25957)。
2.观察指标:记录患者性别、年龄、术前症状,是否功能性pNETs及功能性pNETs类型,是否合并多发性内分泌腺瘤(multiple endocrine neoplasia, MEN)-1型,影像学检查结果,术前诊断,术中所见,手术方式,术后并发症发生情况,病理学检查结果及TNM分期。采用电话回访进行随访,以确诊时间为随访起始时间,随访结束时间为2019年12月31日。总生存期指疾病确诊日期至死亡日或随访结束日,无病生存期指从疾病得以控制消失至疾病复发或由于疾病进展导致患者死亡日。
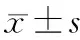
二、结果
1.囊性pNETs患者的一般情况:72例患者中11例(15.3%)为囊性pNETs,其中女性6例,男性5例,中位年龄56岁。6例(54.5%)因出现临床症状就诊,均有腹痛表现,其中1例伴腹胀,1例伴恶心呕吐,呕吐物为胃内容物。仅1例伴有糖尿病、胆石症,为功能性pNETs,结合病史及相关检查诊断为生长抑素瘤伴MEN-1。CT或MRI增强检查示病灶位于胰颈部2例,胰体部2例,胰尾部6例,1例有2个病灶,分别位于胰体和胰尾部;肿瘤长径为(32.82±15.49)mm(图1),增强后7例病灶周边明显强化。影像学诊断为囊腺瘤7例,腹膜后肿瘤1例,胰腺囊肿1例,胰腺占位性病变2例。
2.囊性pNETs患者的手术情况和病理特征:11例患者中4例行胰体尾联合脾切除术,1例行胰十二指肠切除术,4例行胰腺肿瘤剜除术,1例行胰腺中段切除术,1例行保留脾脏的胰体尾切除术。其中5例为传统剖腹手术,6例行腹腔镜手术,均为R0切除。病理学检查示肿瘤长径为(34.36±11.68)mm;所有肿瘤均为高分化,其中3例为G1,8例为G2;1例肿瘤侵犯胰周和神经,均无淋巴结和肝转移、微血管或淋巴管侵犯;1例瘤体出血,均未见肿瘤坏死;核分裂象1~3个/100倍视野;TNM分期Ⅰ期2例、ⅡA期6例、ⅡB期2例、ⅢA期1例。免疫组织化学染色示Syn阳性率100%,CgA阳性率81.8%,NSE阳性率90.9%,CD56阳性率36.4%(图2)。

图1 囊性胰腺神经内分泌肿瘤CT平扫见胰尾部类圆形软组织肿块影(↑),边界较清楚(1A) ;增强CT见胰尾部囊性低密度影(↑),病灶壁局部强化(1B) ;增强MRI见胰尾部类圆形稍长T1的囊实性团块病灶(↑),边界欠清楚,实性部分轻度强化(1C) 图2 囊性胰腺神经内分泌肿瘤病理学检查见肿瘤病理改变(2A,HE染色 ×20);Syn(2B)、CgA(2C)表达阳性(免疫组织化学染色 ×20)
3.囊性pNETs组与实性pNETs组相关指标的比较:囊性pNETs组患者的术前症状,合并MEN-1,手术方式及手术途径,是否R0切除,G分级,肿瘤坏死或出血,微血管或淋巴管侵犯、神经侵犯,淋巴结转移、肝转移,核分裂象,Syn、CgA及NSE阳性率,TNM分期,总生存期及无病生存期与实性pNETs组患者的差异均无统计学意义。与实性pNETs组比较,囊性pNETs多为无功能性,肿瘤多位于胰尾,体积较大,胰周侵犯较少,Ki-67指标较低,CD56阳性率较低,差异均有统计学意义(P值均<0.05,表1)。囊性pNETs患者的总生存期为45(14~101)个月,无病生存期为45(14~101)个月,1、3、5年生存率分别为100%、100%、80.0%,1、3、5年无病生存率均为100%;实性pNETs患者总生存期为45(9~62)个月,无病生存期为29(9~62)个月,1、3、5年生存率分别为100%、94.2%、67.6%,1、3、5年无病生存率分别为100%、96.4%、86.5%(图3)。

表1 囊性pNETs组与实性pNETs组相关指标的比较

图3 囊性胰腺神经内分泌肿瘤和实性胰腺神经内分泌肿瘤患者的总生存期(3A)及无病生存期(3B)的生存曲线
讨论囊性pNETs临床罕见,在所有行手术治疗的pNETs中占10%~17%[10],其临床病理特征和生物学行为尚不明确且存在争议。目前关于囊性pNETs的形成机制有两个主要的假设,部分学者认为pNETs的纤维囊剥夺了病变的血液供应,并通过坏死导致囊性变性,也有学者认为pNETs血供丰富,可能会发生病变内出血,引起囊性变性[6-9]。本研究未发现囊性pNETs中出现坏死,仅有1例肿瘤出血。Singhi等[4]证明囊性pNETs不可能出现坏死。本研究未发现囊性成分与肿瘤坏死、出血之间存在明确的关系,与部分研究的发现一致[4,11-12]。关于囊性pNETs形成的确切机制还未明确,仍有待进一步研究证实。
实性pNETs多为功能性pNETs,表现出相应的内分泌症状,如胰岛素瘤表现出低血糖对中枢神经系统的影响和引起儿茶酚胺过度释放症状,而囊性pNETs多为无功能性,无特异性临床表现,最常见的症状为腹痛。本研究6例出现临床症状的囊性pNETs患者均有腹痛表现,部分患者伴有腹胀、恶心、呕吐等,可能与肿瘤压迫邻近组织有关。囊性pNETs在CT或MRI上肿瘤的强化方式不典型且病灶多以囊性成分为主,多具有高血管周边强化的特点,仅仅依靠其非特异性的临床表现以及CT或MRI难以将囊性pNETs与其他常见的胰腺病变区分开来,且部分临床医师缺乏对该病的认识,导致术前难以明确诊断,易被误诊为胰腺恶性肿瘤、实性假乳头状瘤、囊腺瘤、腹膜后肿瘤或潴留囊肿等[13]。本研究中11例囊性pNETs术前均未得到准确诊断,7例被诊断为胰腺囊腺瘤,1例被诊断为腹膜后肿瘤,1例被诊断为胰腺囊肿,2例被诊断为胰腺占位性病变,误诊率较高。有研究表明,EUS诊断pNETs的灵敏度为82.0%,特异度为92.0%[14],对于胰头部病灶和小病灶灵敏度高[1],EUS和超声内镜引导下细针穿刺活检(EUS-FNA)在鉴别诊断囊性pNETs中可以发挥重要作用[15-16]。而EUS的局限性在于其对胰尾部的可视性较为有限,可能会降低胰尾肿瘤的敏感性[17]。本研究中所有囊性pNETs患者均未行EUS,而61例实性pNETs患者中有4例术前实施EUS且未发生误诊,因此根据临床表现以及CT或MRI难以明确诊断且不能排除本病的患者,应考虑行EUS进一步明确诊断。免疫组织化学指标Syn、CgA、NSE的表达在囊性pNETs与实性pNETs患者中差异无统计学意义,而囊性pNETs患者CD56阳性率明显低于实性pNETs,可有助于术前行EUS-FNA的pNETs患者鉴别囊实性。
手术是pNETs的主要治疗手段,根治性手术切除是pNETs患者能够获得长期生存的唯一选择[18]。主要术式包括肿瘤剜除术、胰体尾切除术、胰十二指肠切除术、节段性胰腺切除术、原发灶和肝转移灶同期或分期切除等[19],术后常见并发症包括胰瘘、切口愈合不良、出血、术后胰腺炎[20]。Paiella等[5]的研究显示囊性pNETs多位于胰尾,实性pNETs则多位于胰头。肿瘤位于胰腺不同部位对二者手术方式的选择产生影响。本研究中囊性pNETs多位于胰尾,但对二者手术方式及术后并发症进行比较发现差异无统计学意义。Canellas等[21]认为囊性pNETs在研究中多位于胰体或胰尾可能归因于选择偏倚,由于胰头切除或胰腺近端肿瘤切除死亡率远高于胰腺远端手术,外科医师更倾向于观察胰头部的囊性病变而非对其进行手术治疗。根据现有的共识指南,那些没有令人担忧的影像学特征的囊性病变若长径<3 cm通常不太可能是恶性的,因此对于肿瘤长径<3 cm的囊性pNETs,建议进行密切随访观察而非立刻手术治疗[22-24]。有研究表明生长抑素受体显像( somatostatin receptor scintigraphy,SRS)和生长抑素类似物可能对诊断和治疗囊性pNETs更有用,生长抑素受体(somatostatin receptor,SSTR)介导的放射性核素治疗可能更适用于囊性pNETs[25],本研究中尚无囊性pNETs患者接受该治疗方法,其临床疗效仍需进一步研究。
肿瘤大小被认为是评估pNETs的生物学行为和复发风险的关键因素,长径>2.0 cm的肿瘤更具侵袭性[26]。本研究发现囊性pNETs比实性pNETs体积更大,但G分级、淋巴结转移、微血管或淋巴管侵犯、神经侵犯、肝转移情况、总生存期以及无病生存期二者之间差异无统计学意义,且囊性pNETsKi-67增殖指数更低、胰周侵犯更为少见,提示囊性pNETs预后可能更好。
同时或先后有两个以上的内分泌腺由于增生、腺瘤或腺癌而引起多种内分泌腺功能亢进称为多发性内分泌肿瘤(multiple endocrine neoplasm,MEN),累及的腺体因不同的组合可以分为MEN-1型和MEN-2型。Ligneau等[24]首次报道了囊性pNETs与MEN-1的关联,但二者之间是否存在联系目前仍有争议[4-5,10,25,27]。本研究发现1例囊性pNETs合并MEN-1,未发现实性pNETs合并MEN-1。对于囊性pNETs的患者,应该在术前考虑MEN-1的可能。
本研究对囊性pNETs与实性pNETs进行对比,有利于提高临床医师对囊性pNETs的认识,对囊性pNETs的诊治具有一定的参考价值。结果表明,囊性pNETs临床罕见,好发于胰尾,多为无功能性pNETs,与实性pNETs相比体积较大,预后优于实性pNETs。本研究存在一定的局限性,病例数少,可能存在选择偏倚。同时本研究随访时间尚短且删失数据较多,未能得出囊性pNETs与实性pNETs患者的中位生存期、10年生存率及无病生存率等指标,总生存期及无病生存期仍需进一步随访。
利益冲突所有作者均声明不存在利益冲突
