基于Keap1/Nrf2通路介导的自噬探讨紫草素对膀胱上皮癌BUC细胞化疗敏感性的影响
2021-06-24刘扬帆金成允
张 辉,张 爽,刘扬帆,宋 菲,金成允
1.南阳市中心医院 肿瘤内科,河南 南阳 473000
2.郑州大学药学院 研究室,河南 郑州 450052
膀胱上皮癌(bladder urothelial carcinoma,BUC)是泌尿系统常见的恶性肿瘤之一,发病率居泌尿系统恶性肿瘤第2 位,是膀胱癌常见类型,占膀胱癌患者总数的90%以上[1]。目前BUC 治疗主要采用以顺铂为基础的化疗方案,但顺铂耐药性导致BUC 化疗敏感性低,治疗效果不佳,患者2年生存率低[2-3]。因此,如何提高化疗敏感性是目前BUC 治疗中亟需解决的问题。紫草素是从天然紫草根部提取出的一种活性蒽醌衍生物,具有抗氧化、抗炎、免疫调节、抗肿瘤等作用[4-5]。近年来研究发现,紫草素对卵巢癌等多种癌细胞均具有抗增殖、提高顺铂敏感性的作用[6-7]。自噬是通过降解受损的细胞器、变性的蛋白质等将能量再利用的过程,是细胞对抗不良生长环境的一种保护机制,其发生可降低肿瘤细胞的化疗敏感性[8]。Kelch 样 ECH 相关蛋白 1(Kelch-like ECHassociated protein 1,Keap1)/核因子E2 相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)通路是机体消除有害物质损伤作用、维持氧化还原平衡的重要通路,可介导自噬反应[9-10]。本研究基于Keap1/Nrf2通路介导的自噬探讨紫草素对BUC 细胞化疗敏感性的影响,以期为临床提高BUC 化疗敏感性提供参考。
1 材料与方法
1.1 试剂与仪器
人膀胱乳头状移行上皮癌细胞BIU-87(货号HZ-Y1072)购自美国ATCC 细胞库;顺铂(批号T1564,质量分数95%)购自南京赛泓瑞生物科技有限公司;紫草素(批号QY-0022,质量分数≥98%)购自上海乔羽生物科技有限公司;胎牛血清(货号FBS500-S)购自澳大利亚AusGeneX 公司;DMEM培养基(货号KL-P0032)购自德国Merck/Sigma公司;Lipofectamine 2000 转染试剂(货号11668019)购自美国 Invitrogen 公司;实时荧光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)试剂盒(货号K1002S)购自美国Promega 公司;negative control(NC)-Nrf2、hsa-Nrf2 mimic 及Nrf2、β-actin 引物均由生工生物工程(上海)股份有限公司合成;CCK-8 试剂(货号CK-04)购自日本同仁化学研究所;AnnexinV-FITC/PI细胞凋亡检测试剂盒(货号S0185)购自哈尔滨新海基因检测有限公司;Keap1 抗体、Nrf2 抗体、GAPDH 抗体(货号ab139729、ab89443、ab63817)购自Abcam 公司;微管相关蛋白 1 轻链 3(microtubule-associated protein 1 light chain 3,LC3)抗体(货号FNab04716)购自武汉菲恩生物科技有限公司;辣根过氧化物酶标记的羊抗兔(货号0295G-HRP)购自美国Santa公司;TY10GI2-2 培养箱购自美国Shellab 公司;MODEL550 酶标仪购自美国Bio-Rad 公司;ABI7500 荧光定量PCR 仪购自美国Applied Biosystems公司;BD FACSCanto II流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养 BIU-87 细胞常规培养于含10%胎牛血清的DMEM 培养基中,并置于37 ℃、5%CO2恒温饱和湿度培养箱内培养,传代3 次,取生长状态良好的对数生长期细胞进行实验。
1.2.2 顺铂对 BIU-87 细胞增殖的影响 调整BIU-87 细胞密度为1.5×105个/mL,以每孔100 μL接种于96 孔培养板,给予不同质量浓度的顺铂(10、20、40、80、160 µg/mL)处理,培养48 h,加入CCK-8 试剂,避光培养2 h,用酶标仪测定波长450 nm 处的吸光度(A)。以未给予顺铂处理细胞为对照,计算细胞增殖抑制率。实验重复6 次。
细胞增殖抑制率=(A对照-A给药)/A对照
1.2.3 紫草素对顺铂处理的BIU-87 细胞增殖的影响 调整BIU-87 细胞密度为1.5×105个/mL,以每孔100 μL 接种于96 孔培养板,在给予40 µg/mL 顺铂的基础上给予不同浓度的紫草素(2、4、8、16、32 µmol/L)处理,培养48 h,加入CCK-8 试剂,避光培养2 h,用酶标仪测定波长450 nm 处的A值。以未给予紫草素处理细胞为对照,计算细胞增殖抑制率,实验重复6 次。
1.2.4 qRT-PCR 法检测转染后BIU-87 细胞中Nrf2mRNA 表达情况 调整BIU-87 细胞密度为1.5×105个/mL,以每孔100 μL 接种于96 孔培养板,设置对照组、顺铂组(40 µg/mL)、紫草素组(40 µg/mL顺铂+8 µmol/L 紫草素)和NC 组(转染NC-Nrf2+40 µg/mL 顺铂+8 µmol/L 紫草素)、Nrf2 组(转染hsa-Nrf2 mimic+40 µg/mL 顺铂+8 µmol/L 紫草素)。细胞培养48 h,收集细胞,使用TRIzol 试剂提取总RNA,逆转录合成cDNA,qRT-PCR 法检测Nrf2mRNA 表达水平,内参基因为β-actin。反应程序:95 ℃、2 min,94 ℃、30 s,55 ℃、32 s,72 ℃、2 min,共循环 35 次。Nrf2上游引物:5’-ACGGGGCAGTCATGTACCA-3’,下游引物:5’-GTTGAAGAACTCCTCCTGCTTG-3’;内参β-actin上游引物:5’-CTGTGGCATCCACGAAACT-3’,下游引物:5’-GGACTCGTCATACTCCTGCTT-3’。Ct值为扩增产物的荧光信号达到临界阈值时对应的循环数,相对表达量以2-ΔΔCt表示,实验重复6 次。
1.2.5 CCK-8 法检测各组BIU-87 细胞增殖情况调整BIU-87细胞密度为1.5×105个/mL,以每孔100 μL 接种于96 孔培养板,分组及给药同“1.2.4”项。细胞培养48 h,加入CCK-8 试剂,避光培养2 h,用酶标仪测定波长450 nm 处的A值,计算细胞增殖抑制率,实验重复6 次。
1.2.6 流式细胞仪检测各组BIU-87 细胞凋亡情况调整BIU-87细胞密度为1.5×105个/mL,以每孔100 μL 接种于96 孔培养板,分组及给药同“1.2.4”项。细胞培养48 h,收集细胞,胰酶消化,PBS 洗涤,用结合缓冲液将细胞浓度调整为1×106个/mL,按照Annexin V-FITC/PI凋亡试剂盒说明书操作,加入5 μL Annexin V-FITC、5 μL PI,避光孵育1 h,用流式细胞仪测定细胞凋亡率,实验重复6 次。
1.2.7 蛋白免疫印迹(Western blotting)法检测各组BIU-87 细胞中Keap1/Nrf2 通路及自噬相关蛋白表达情况 调整BIU-87 细胞密度为1.5×105个/mL,以每孔2 mL 接种于6 孔培养板,分组及给药同“1.2.4”项。细胞培养48 h,收集细胞,加蛋白裂解液,离心收集蛋白并定量,取50 μg 蛋白进行SDS-PAGE 电泳、转膜,5%脱脂奶粉封闭2 h,加入Keap1 抗体(1∶300)、Nrf2 抗体(1∶300)、LC3 抗体(1∶300)、GAPDH 抗体(1∶500),4 ℃孵育过夜,加入羊抗兔二抗(辣根过氧化物酶标记,1∶2000),室温孵育1 h,ECL 化学发光法显色,曝光,Image J 软件分析条带灰度,实验重复6 次。
1.3 统计学分析
应用SPSS 24.0 统计学软件进行数据分析。计量资料均以x±s表示,多组间比较进行单因素方差分析,两两比较行SNK-q检验。当P<0.05 时,差异有统计学意义。
2 结果
2.1 顺铂对BIU-87 细胞增殖的影响
与对照组相比,10、20、40、80、160 µg/mL顺铂处理下BIU-87 细胞增殖抑制率均显著升高(P<0.05),半数抑制浓度(IC50)在20~40 µg/mL内,故后续实验中顺铂处理质量浓度均采用40µg/mL。见图1。
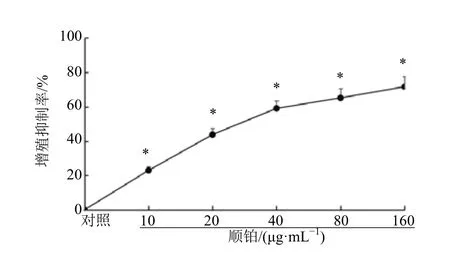
图1 不同质量浓度顺铂处理下BIU-87 细胞增殖抑制率(x± s,n=6)Fig.1 Proliferation inhibition rate of BIU-87 cells treated with different concentrations of cisplatin(±s,n=6)
2.2 不同浓度紫草素对顺铂处理下BIU-87 细胞增殖的影响
与对照组相比,2、4、8、16、32 µmol/L 紫草素联合顺铂处理下BIU-87 细胞增殖抑制率均显著升高(P<0.05),IC50在4~8 µmol/L 内,故后续实验紫草素处理浓度均采用8 µmol/L。见图2。

图2 不同浓度紫草素联合顺铂处理下BIU-87 细胞增殖抑制率(±s,n=6)Fig.2 Proliferation inhibition rate of BIU-87 cells treated with cisplatin and shikonin at different concentrations(±s,n=6)
2.3 转染后BIU-87 细胞Nrf2 mRNA 表达情况
紫草素组、NC 组BIU-87 细胞中Nrf2mRNA表达水平差异不具有统计学意义(P>0.05);与NC组相比,Nrf2 组BIU-87 细胞中Nrf2mRNA 表达水平显著升高(P<0.05)。见图3。
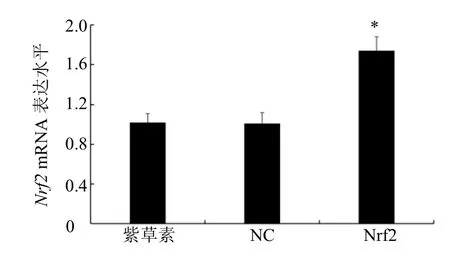
图3 转染后BIU-87 细胞Nrf2 mRNA 表达水平(±s,n=6)Fig.3 Nrf2 mRNA expression level in BIU-87 cells after transfection(±s,n=6)
2.4 转染后BIU-87 细胞增殖、凋亡情况
与对照组相比,顺铂组BIU-87 细胞增殖抑制率、凋亡率显著升高(P<0.05);与顺铂组相比,紫草素组BIU-87 细胞增殖抑制率、凋亡率显著升高(P<0.05);紫草素组、NC 组BIU-87 细胞增殖抑制率、凋亡率差异不具有统计学意义(P>0.05);与NC 组相比,Nrf2 组BIU-87 细胞增殖抑制率、凋亡率显著降低(P<0.05)。见图4、5。
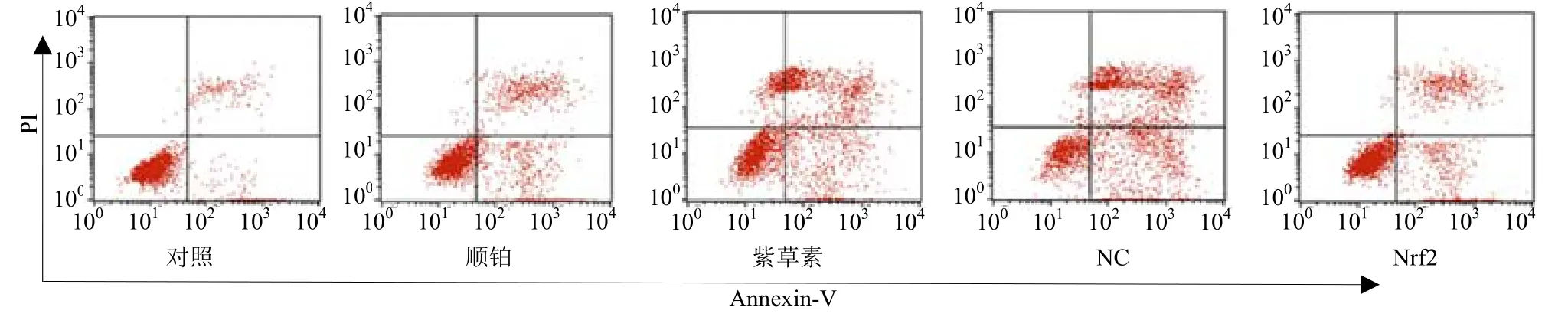
图4 各组BIU-87 细胞凋亡情况Fig.4 Apoptosis of BIU-87 cells in each group
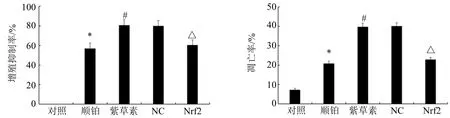
图5 各组BIU-87 细胞增殖抑制率、凋亡率Fig.5 Proliferation inhibition rate and apoptosis rate of BIU-87 cells in each group
2.5 转染后BIU-87细胞中Keap1/Nrf2通路相关蛋白表达情况
与对照组相比,顺铂组BIU-87 细胞中Keap1蛋白表达水平显著降低,Nrf2 蛋白表达水平显著升高(P<0.05);与顺铂组相比,紫草素组BIU-87细胞中Keap1 蛋白表达水平显著升高,Nrf2 蛋白表达水平显著降低(P<0.05);紫草素组、NC 组BIU-87 细胞中Keap1、Nrf2 蛋白表达水平差异不具有统计学意义(P>0.05);与NC 组相比,Nrf2 组BIU-87 细胞中Keap1 蛋白表达水平显著降低,Nrf2蛋白表达水平显著升高(P<0.05)。见图6。
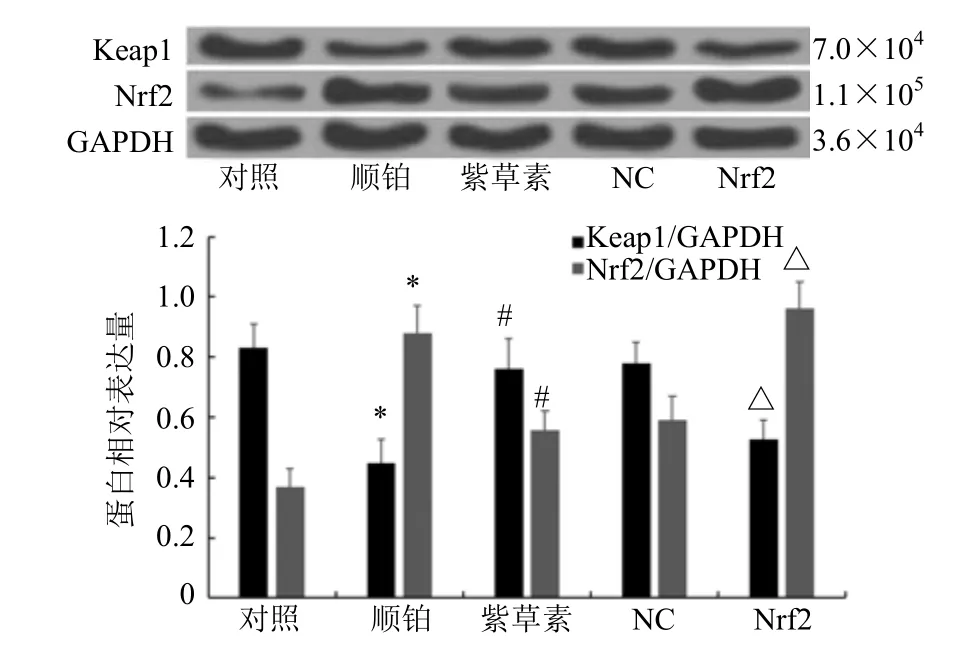
图6 各组BIU-87 细胞中Keap1、Nrf2 蛋白表达情况Fig.6 Expression of KEAP1 and Nrf2 protein in BIU-87 cells in each group
2.6 各组BIU-87 细胞中自噬相关蛋白表达情况
与对照组相比,顺铂组BIU-87 细胞中LC3I蛋白表达水平显著降低,LC3II蛋白表达水平显著升高(P<0.05);与顺铂组相比,紫草素组BIU-87细胞中LC3I蛋白表达水平显著升高,LC3II蛋白表达水平显著降低(P<0.05);紫草素组、NC 组BIU-87 细胞中LC3I、LC3II蛋白表达水平差异不具有统计学意义(P>0.05);与NC 组相比,Nrf2 组BIU-87 细胞中LC3I蛋白表达水平显著降低,LC3II蛋白表达水平显著升高(P<0.05)。见图7。
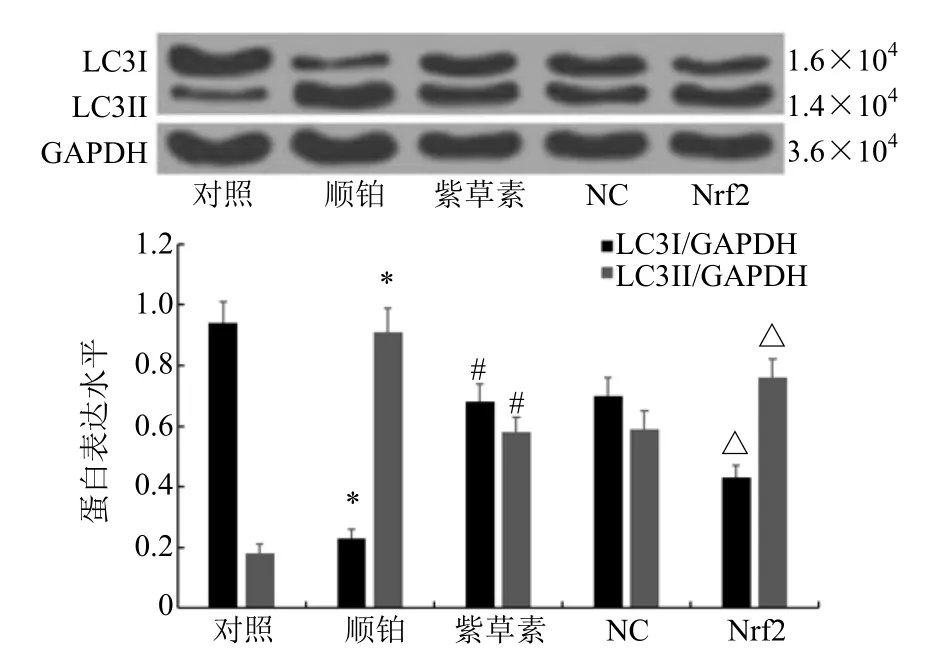
图7 各组BIU-87 细胞中LC3І、LC3II 蛋白表达情况Fig.7 Expression of LC3І and LC3II protein in BIU-87 cells in each group
3 讨论
化疗是治疗各种癌症的重要手段之一,其疗效经过长期广泛地研究验证,而肿瘤化疗的敏感性与患者的预后及生存质量息息相关[11]。顺铂是BUC化疗的一线基础治疗药物,在使用过程中,BUC 易对顺铂产生耐药性,导致化疗敏感性不高,影响治疗效果[12]。此外,BUC 作为一种具有复发倾向的恶性肿瘤,在接受多次、长期化疗后,对化疗药物的敏感性也会逐渐降低,最终影响治疗效果[13]。因此,寻找合适的治疗药物提高BUC 化疗敏感性具有重要意义。本研究通过设置顺铂质量浓度梯度,发现BIU-87 细胞的顺铂IC50在20~40 µg/mL,故最终选定40 µg/mL 作为后续实验中顺铂的处理浓度。
近年来,中药在肿瘤治疗中的作用越来越受到重视,许多抗肿瘤药物均来自中药提取物。紫草素是中药紫草的主要活性成分,具有抗氧化、抗菌、抗病毒、促进伤口愈合等一系列生物学特性[14-15]。目前,紫草素的抗肿瘤作用已在许多肿瘤中得到证实,其在肿瘤治疗中的作用日益受到重视。Huang等[16]研究发现,紫草素能通过调节微小RNA-106b(miR-106b)/第10 号染色体缺失的磷酸酶和张力蛋白同源蛋白(phosphatase and tensin homolog gene deleted on chromosome 10,PTEN)/蛋白激酶B(protein kinaseb B,Akt)/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路抑制子宫内膜样子宫内膜癌细胞的增殖并诱导其凋亡。Zhang 等[17]研究表明,紫草素类衍生物脱氧紫草素通过抑制Akt 信号介导的ATP 结合盒亚家族B成员1(ATP-binding cassette subfamily B member 1 transporter gene,ABCB1)表达来抑制NSCLC 细胞对顺铂的耐药。Shilnikova 等[7]发现紫草素能诱导顺铂耐药卵巢癌细胞凋亡。许静等[18]研究表明,紫草素可以逆转卵巢癌SKOV3/DDP 细胞的顺铂耐药效应。本研究结果显示,与单独顺铂处理相比,使用2、4、8、16、32 µmol/L 紫草素均可进一步提高BIU-87 细胞的增殖抑制率,紫草素组BIU-87 细胞增殖抑制率、凋亡率较顺铂组均显著升高,提示紫草素可以提高BIU-87 细胞的顺铂敏感性,但其作用机制还需进一步探究。
细胞自噬是维持细胞内环境稳态、生存的重要过程,利用溶酶体清除损伤、多余的蛋白质及细胞器并将能量供给自身再利用,在应激状态时起重要的防御作用[19]。然而,肿瘤细胞也能利用该过程在化疗中保护自身,影响化疗敏感性。石瑛等[20]研究发现抑制自噬可增强乳腺癌MCF-7 细胞对紫杉醇的敏感性。张建育等[21]研究表明,二十碳五烯酸可能通过抑制自噬反应提高膀胱癌细胞的顺铂化疗敏感性。殷雷等[22]研究发现,肿瘤抑制因子圆柱瘤基因CYLD能通过抑制自噬提高膀胱癌细胞对吉西他滨的化疗敏感性。LC3 是自噬体膜上的标志性蛋白,在细胞质中以LC3I、LC3II 2 种形式存在,在自噬过程中由LC3I转变为LC3II,进而与自噬体特异性结合[23]。本研究结果显示,与对照组相比,顺铂组BIU-87 细胞中LC3II蛋白表达水平显著升高,LC3I蛋白表达水平显著降低,提示BIU-87 细胞在抵御顺铂作用时发生了自噬反应;与顺铂组相比,紫草素组BIU-87 细胞中LC3II蛋白表达水平显著降低,LC3I蛋白表达水平显著升高,提示紫草素可以通过抑制BIU-87 细胞的自噬反应,进而加强顺铂对细胞增殖的抑制作用及对细胞凋亡的促进作用。
Keap1/Nrf2 通路是调控机体氧化应激的重要通路。在正常生理状态下,Keap1 和Nrf2 在细胞质内形成复合体,并介导泛素化持续降解Nrf2,以维持转录形成的Nrf2 之间的平衡。在应激条件下,Keap1中的半胱氨酸残基发生修饰,导致Keap1 构象发生改变,Nrf2 从Keap1/Nrf2 复合物中分离且不会被泛素化和降解,通过影响多种自噬凋亡基因的转录参与自噬调节[24-25]。本研究结果显示,与对照组相比,顺铂组BIU-87 细胞中Keap1 蛋白表达水平显著降低,Nrf2 蛋白表达水平显著升高,提示顺铂可激活Keap1/Nrf2 通路;与顺铂组相比,紫草素组BIU-87细胞中Keap1 蛋白表达水平显著升高,Nrf2 蛋白表达水平显著降低,提示紫草素可抑制Keap1/Nrf2 通路激活,推测紫草素可能通过影响Keap1/Nrf2 通路影响细胞自噬反应,进而影响BIU-87 细胞的顺铂敏感性。本研究在顺铂联合紫草素处理基础上,进一步通过转染处理细胞上调Nrf2 表达,发现BIU-87细胞增殖抑制率、凋亡率显著降低,细胞中Keap1、LC3I蛋白表达水平显著降低,Nrf2、LC3II蛋白表达水平显著升高,提示激活Keap1/Nrf2 通路后,BIU-87 细胞对顺铂的敏感性降低,细胞自噬反应增强,推测紫草素增强BIU-87 细胞的顺铂敏感性可能是通过抑制Keap1/Nrf2 通路激活,进而抑制自噬反应发挥作用的。
综上所述,紫草素可以增强BUC 细胞BIU-87对顺铂的敏感性,可能是通过抑制Keap1/Nrf2通路介导的自噬反应发挥作用的。但本研究仅针对BIU-87 细胞,在其他BUC 细胞系中的作用还需在后续实验中加以验证。
利益冲突所有作者均声明不存在利益冲突
