复叶地黄连化学成分及其抗烟草花叶病毒活性研究
2021-06-24毛远湖郝小江
晏 英,陈 洁,唐 攀,毛远湖,李 毅,汤 磊,郝小江
1.贵州医科大学医药卫生管理学院,贵州 贵阳 550025
2.贵州医科大学/贵州省化学合成药物研发利用工程技术研究中心,贵州 贵阳 550004
3.贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014
植物病毒是危害农作物的一类重要病原,因其危害大、防治困难,素有“植物癌症”之称。由于植物病毒对植物细胞的绝对寄生性,病毒复制所需要的物质、能量场所等完全由宿主提供,病毒能够胁迫宿主细胞的生化机制,使其与病毒本身的生化机制纠缠在一起难以识别,所以药物难以只对病毒进行选择性攻击而不伤害宿主细胞,导致研究高选择性的化学抗病毒制剂面临极大的困难,至今仍未取得重大突破。烟草花叶病毒(tobacco mosaic virus,TMV)是其中最具代表性的植物病毒,该病毒发现110年以来,已发现可感染的植物高达500 种以上。TMV 是烟草生产上的严重病害,烟草及其他农作物感染TMV 后,叶片叶绿素被破坏,光合作用减弱,生长受抑制,造成植株生长困难,畸形、矮化,甚至死亡。TMV 的防治较为困难,可导致农作物减产幅度为20%~80%,全球每年因TMV 造成的损失可达数亿美元[1]。烟草病毒病的发生日趋严重,尚未出现国际公认的抗TMV 药物[2]。因此,抗病毒制剂的研发和使用对于防治该病具有重要意义。
目前,传统的抗病毒制剂往往效果不佳,或者对植物有毒害作用。运用基因工程技术开发转基因抗病品种,如弱毒疫苗卫星核酸等又存在一定争议,不容易被采纳。植物源活性物质抗病毒效果良好,其治疗效果不亚于化学合成制剂,且资源丰富,绿色环保,不会造成环境污染和残留毒性问题,具有广阔的发展前景[3]。目前,从植物中分离得到的倍半萜内酯、柠檬苦素、苦木素、石蒜生物碱、3-acetonyl-3-hydroxyoxindole(AHO)等化合物均有很强抗TMV 活性,从植物中分离纯化化合物(即天然产物),筛选具有抗病毒活性的化合物,已经被证实是一种有效对抗植物病毒的方法[4-6]。前期,本课题组研究楝科植物复叶地黄连抗TMV 活性成分的过程中,应用TMV 活性追踪法,分离得到一系列的抗TMV 活性成分柠檬苦素。深入研究发现,该类化合物能诱导植物系统获得抗性抵御病毒侵染,是潜在的新型植物系统获得抗性化学诱导剂[7]。此类化合物对TMV 新颖的作用机制,有望突破抗植物病毒剂研究的瓶颈。同时植物中存在的化学防御物质对植物本身的自毒性是较小的,且具备特殊的识别病毒与宿主植物的能力,将有利于发现和研究新的抗病毒制剂。为了继续寻找抗TMV 的活性化学成分,本研究进一步了开展楝科复叶地黄连植物的化学成分和抗TMV 活性研究。从复叶地黄连的甲醇提取物中分离得到了13 个化合物,分别鉴定为nymania-3(1)、prieurianin(2)、munronin L(3)、12-O-methylvolkensin(4)、12-hydroxyisopimara-8(14),15-dien-7-one(5)、munronin R(6)、3β,4βdihydroxypregnan-16-one(7)、(E)-aglawone-3-one(8)、N-(N-benzoyl-S-phenylalaninyl)-S-phenylalaninol acetate(9)、N-(N-benzoyl-S-phenylalaninyl)-Sphenylalaninol benzoate(10)、glabrol(11)、syringaresinol(12)、7-methoxy-8-hydroxydihydroasarone(13)。其中,化合物5、7~13 为首次从该植物中分离得到。化合物1~3、5、9~12 具有较强的抗TMV 活性。
1 仪器与材料
Bruker AM-400/600 MHz 核磁共振仪、Bruker HTC/Esquire 质谱仪(德国布鲁克公司);高效液相色谱仪为Agilent 1200 型(美国安捷伦科技司);色谱柱Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm,美国菲罗门公司);旋转蒸发仪(东京理化,N-1300D-WD);BP211D 电子天平(Sartorouius 公司);高速冷冻离心机(2K15 型,德国Sigma 公司),Sephadex LH-20(瑞典Pharmacia 公司);C18反相硅胶(日本YMC 公司);正相硅胶和薄层色谱板(青岛海洋化工厂);核磁用氘代试剂(美国CIL 氘代试剂),四甲基硅烷(TMS)为内标;液相用水(娃哈哈纯净水);色谱级甲醇、乙腈(科密欧试剂公司);其余化学实验用溶剂为分析纯(天津市康科德科技有限公司)。
供试毒源:TMV(U1)普通株系,购于中国科学院武汉病毒研究所。保存于-20 ℃,临用时取出用0.01 mol/L PB 稀释至50 μg/mL。供试寄主:心叶烟Nicotiana glutinosa,为TMV 枯斑寄主,普通烟K326Nicotiana tabacumK326,温室中繁育,种子均购于中国农业科学院烟草研究所。
样品采自云南省文山州,经贵州中医药大学孙庆文教授鉴定为复叶地黄连Munronia henryiHarms,凭证标本(DHL201511)保存于贵州医科大学药学实验室。
2 方法
2.1 提取与分离
干燥的全株复叶地黄连10 kg,用甲醇回流提取3 次,每次2 h,趁热滤过,合并提取液,将其浓缩至无醇味得粗提物1043 g,加水混溶成浑浊液体,用醋酸乙酯等体积萃取3 次,回收醋酸乙酯得浸膏。浸膏417 g 经硅胶(100~200 目)柱色谱分离,以石油醚-丙酮体系为洗脱剂进行梯度洗脱(50∶1→30∶70),得到6 个组分Fr.1~6。Fr.3(39.7 g)经C18柱色谱分离,以甲醇-水(40∶60→100∶0)进行梯度洗脱,得到5 个亚组分(Fr.3A~3E)。Fr.3C 经硅胶(200~300 目)柱色谱进行分离,以二氯甲烷-甲醇(30∶1→50∶10)进行梯度洗脱,再经HPLC 制备[甲醇-水(80∶20)]得到化合物1(28.1 mg)、5(10.4 mg)和12(9.3 mg);Fr.3D 经硅胶(200~300 目)柱色谱进行分离,以石油醚-醋酸乙酯(80∶10→30∶10)进行梯度洗脱,再经凝胶反复柱色谱(甲醇)分离得到化合物4(13.7 mg)和6(15.8 mg)。Fr.4(51.6 g)经C18柱色谱分离,以甲醇-水(50∶50→100∶0)进行梯度洗脱,得到6 个亚组分(Fr.4A~4F)。4B 经硅胶(200~300目)柱色谱进行分离,以石油醚-醋酸乙酯(70∶10→20∶10)进行梯度洗脱,再经HPLC 制备[甲醇-水(73∶27)]得到化合物2(10.9 mg)、3(14.2 mg)和7(8.7 mg);Fr.4C 经硅胶(200~300 目)柱色谱进行分离,以二氯甲烷-甲醇(20∶1→30∶10)进行梯度洗脱,再经凝胶反复柱色谱(甲醇)分离得到化合物8(24.3 mg)。Fr.5(49.3 g)经C18柱色谱分离,以甲醇-水(60∶40→100∶0)进行梯度洗脱,得到4 个亚组分(Fr.5A~5D)。5B 经硅胶(200~300 目)柱色谱进行分离,以石油醚-醋酸乙酯(50∶10→10∶20)进行梯度洗脱,再经HPLC制备[甲醇-水(65∶35)]得到化合物10(18.4 mg)和11(14.6 mg);Fr.5D 经硅胶(200~300 目)柱色谱进行分离,以石油醚-醋酸乙酯(40∶10→10∶30)进行梯度洗脱,再经HPLC 制备[甲醇-水(60∶40)]得到化合物9(21.5 mg)和13(7.6 mg)。
2.2 活性筛选
2.2.1 化合物对TMV 的钝化作用 挑选健康长势一致的5~6 叶期的心叶烟,暗室放置1 夜。将供试化合物与50 μg/mL 的TMV 按1∶1 比例混合至所需浓度,混匀放置0.5 h。每棵烟挑选大小相似的4~6 片叶子,每片叶子的一半摩擦接种化合物与TMV 的混合溶液100 μL 作为处理组;另一半摩擦接种50 μg/mL 的TMV 100 μL 作为阳性对照组;摩擦接种相应浓度DMSO 溶液的叶片作为空白组[8]。2 h 后用无菌水将叶表面的金刚砂洗净。放入无虫温室中,3~4 d 后按公式计算TMV 抑制率,每个化合物重复3 次。
抑制率=1-处理的平均枯斑数/阳性对照的平均枯斑数
2.2.2 化合物对TMV 的保护作用 挑选健康长势一致的5~6 叶期的心叶烟,暗室放置1 夜。每棵烟挑选大小相似的4~6 片叶子,供试化合物用无菌水稀释为所需浓度,每片叶子的一半均匀施药(化合物)100 μL 作为处理组,24 h 后每片叶子摩擦接种200 μg/mL TMV 200 μL,未施药的一半作为阳性对照,未施药且摩擦接种相应浓度DMSO 溶液的叶片作为空白。2 h 后用无菌水将叶表面的金刚砂洗净。放入无虫温室中,3~4 d 后按公式计算TMV 抑制率,每个化合物重复3 次。
2.2.3 化合物对TMV 的治疗作用 挑选健康长势一致的5~6 叶期的心叶烟,暗室放置1 夜。每棵烟挑选大小相似的4~6 片叶子摩擦接种200 μg/mL TMV 200 μL,2 h 后每片叶子的一半均匀施药(化合物)100 μL 作为处理;另一半作为阳性对照;未施药且摩擦接种相应浓度DMSO 溶液的叶片作为空白。2 h 后用无菌水将叶表面的金刚砂洗净。放入无虫温室中,3~4 d 后按公式计算TMV 抑制率,每个化合物重复3 次。
新媒体以势不可挡的信息技术迅速改变着我们的生活世界,继而悄悄地然而又深刻地改变着我们所缔造的文化世界。不仅仅是改变个体和社会的精神生活方式,而且改变着个体的实体性认同,改变个体与他所处的整个世界的同一性方式和同一性性状,最后,改变这个世界的精神气质和精神本质,也就改变着我们的伦理世界。生活世界——文化世界——伦理世界,是新媒体逻辑和历史地改变世界的三部曲。归根结底,新媒体改变世界的基础是赋权,通过赋权赋予传播内容一定的伦理地位,以全新的传播和对话方式构建伦理话语和伦理共识,为当下的人类文明发展营造理想的伦理生态。
3 结果
3.1 结构鉴定
化合物1:白色粉末;ESI-MSm/z:593[M+Na]+,确定相对分子质量为570;分子式C31H38O10;1H-NMR(400 MHz,CDCl3)δ:7.29(1H,s,H-23),7.13(1H,s,H-21),6.95(1H,d,J=16.0 Hz,H-1),6.29(1H,d,J=16.0 Hz,H-2),6.16(1H,s,H-22),5.87(1H,d,J=8.0 Hz,H-12),5.62(1H,dd,J=8.0,12.0 Hz,H-11),5.37(1H,s,H-30b),5.25(1H,s,H-30a),3.89(1H,s,H-15),3.72(3H,s,7-OCH3),3.35(1H,d,J=8.0 Hz,H-5),3.09(1H,d,J=8.0 Hz,H-9),3.06(1H,dd,J=8.0,12.0 Hz,H-17),2.28(1H,d,J=16.0 Hz,H-6α),2.23(1H,dd,J=6.0,12.0 Hz,H-16α),2.19(1H,dd,J=8.0,16.0 Hz,H-6β),2.17(3H,s,12-OCOCH3),1.87(1H,dd,J=6.0,12.0 Hz,H-16β),1.73(3H,s,OCOCH3-11),1.56(3H,s,H-29),1.30(3H,s,H-19),1.01(3H,s,H-28),0.91(3H,s,H-18);13C-NMR(100 MHz,CDCl3)δ:173.5(C-7),170.3(12-OCOCH3),169.9(11-OCOCH3),166.6(C-3),148.4(C-1),142.5(C-23),140.2(C-21),136.6(C-8),121.2(C-30),121.1(C-2),122.0(C-20),111.1(C-22),83.5(C-4),74.2(C-12),71.0(C-11),71.0(C-14),59.5(C-15),53.2(C-17),52.3(OCH3-7),49.9(C-5),46.1(C-10),45.0(C-13),37.7(C-9),34.8(C-6),33.4(C-16),30.1(C-29),22.7(C-28),22.2(C-19),20.4(11-OCOCH3),20.3(12-OCOCH3),13.4(C-18)。以上数据与文献报道基本一致[9],故鉴定化合物1 为nymania-3。
化合物2:白色粉末;ESI-MSm/z:785[M+Na]+,确定相对分子质量762;分子式C38H50O16;1H-NMR(600 MHz,CDCl3)δ:7.77(1H,s,COOH-11),7.26(1H,s,H-23),7.19(1H,s,H-21),6.16(1H,s,H-22),6.00(1H,dd,J=10.8,7.2 Hz,H-11),5.73(1H,s,H-1),5.52(1H,d,J=10.8 Hz,H-12),5.52(1H,s,H-30a),4.95(1H,s,H-30b),4.12(1H,d,J=12.0 Hz,H-28β),4.01(1H,m,H-2′),3.97(1H,d,J=12.0 Hz,H-28α),3.69(3H,s,OCH3-7),3.19(1H,d,J=3.0 Hz,H-2),3.14(1H,d,J=7.2 Hz,H-5),3.00(1H,m,H-17),2.99(1H,m,H-17),2.93(1H,s,H-9),2.87(1H,m,H-6α),2.66(1H,m,H-6β),2.28(1H,m,H-16α),2.12(3H,s,28-OCOCH3),2.07(3H,s,1-OCOCH3),2.05(1H,m,H-16β),2.00(1H,m,H-3′),1.48(1H,s,H-29),1.46(1H,m,H-4′α),1.17(1H,m,H-4′β),0.86(3H,d,J=6.0 Hz,H-5′),0.84(3H,s,H-19),0.83(3H,s,H-18),0.74(3H,t,J=6.6 Hz,H-6′);13C-NMR(150 MHz,CDCl3)δ:206.2(C-15),174.9(C-7),170.2(C-3),169.6(28-OCOCH3),169.6(1-OCOCH3),168.5(C-1′),160.3(COOH-11),143.1(C-23),140.6(C-21),137.8(C-8),125.6(C-30),122.9(C-20),110.5(C-22),84.4(C-4),80.8(C-1),74.7(C-14),73.9(C-2′),71.4(C-11),71.4(C-12),69.7(C-28),53.4(OCH3-7),51.3(C-9),51.3(C-5),49.7(C-13),46.7(C-10),41.4(C-16),38.0(C-3′),36.9(C-17),35.2(C-2),32.8(C-6),25.9(C-29),23.0(C-5′),22.9(28-OCOCH3),20.7(1-OCOCH3),15.2(C-19),15.2(C-4′),13.0(C-18),11.5(C-6′)。以上数据与文献报道基本一致[10],故鉴定化合物2 为prieurianin。
化合物3:白色粉末;ESI-MSm/z:621[M+Na]+,确定相对分子质量598;分子式C34H46O9;1HNMR(600 MHz,CDCl3)δ:7.33(1H,s,H-23),7.15(1H,s,H-21),6.96(1H,m,H-3′),6.07(1H,s,H-22),5.15(1H,t,J=7.6 Hz,H-15),4.95(1H,t,J=3.4 Hz,H-3),4.80(1H,m,H-1),4.80(1H,m,H-7),4.11(1H,d,J=2.8 Hz,H-6),4.08(1H,m,H-12),3.61(1H,s,H-28),3.53(1H,d,J=8.8 Hz,H-17),3.21(3H,s,OCH3-12),2.86(1H,d,J=12.8 Hz,H-5),2.74(1H,d,J=8.4 Hz,H-9),2.20(1H,m,H-16α),2.06(1H,m,H-2α),2.06(1H,m,H-2β),2.02(1H,m,H-16β),1.92(3H,s,3-OCOCH3),1.91(1H,s,H-5′),1.85(3H,d,J=6.8 Hz,H-18),1.82(1H,d,J=6.8 Hz,H-4′),1.63(1H,m,H-11),1.19(1H,s,H-29),1.19(1H,s,H-30),1.91(1H,s,H-5′),0.96(3H,s,H-19);13C-NMR(150 MHz,CDCl3)δ:170.3(OCOCH3-3),166.8(C-1′),143.3(C-23),142.0(C-13),138.8(C-21),138.4(C-3′),136.7(C-14),128.6(C-2′),128.1(C-20),109.7(C-22),101.3(C-12),77.8(C-28),75.0(C-15),73.8(C-6),71.6(C-1),71.5(C-3),70.7(C-7),54.9(OCH3-12),49.7(C-8),44.8(C-17),42.7(C-4),40.8(C-10),38.8(C-5),38.2(C-16),35.2(C-9),28.4(C-11),27.7(C-2),20.9(OCOCH3-3),20.4(C-30),19.3(C-29),16.6(C-19),16.4(C-18),14.6(C-4′),12.0(C-5′)。以上数据与文献报道基本一致[11],故鉴定化合物3 为munronin L。
化合物4:白色粉末;ESI-MSm/z:621[M+Na]+,确定相对分子质量598;分子式C34H46O9;1HNMR(600 MHz,CDCl3)δ:7.31(1H,s,H-23),7.28(1H,s,H-21),6.97(1H,dd,J=7.2,6.0 Hz,H-3′),6.42(1H,s,H-22),4.96(1H,m,H-15),4.95(1H,d,J=3.0 Hz,H-3),4.74(1H,t,J=2.6 Hz,H-1),4.61(1H,s,H-12),4.37(1H,d,J=2.4 Hz,H-7),4.06(1H,dd,J=12.6,2.4 Hz,H-6),3.60(1H,d,J=7.2 Hz,H-28β),3.59(1H,d,J=7.2 Hz,H-28α),3.44(1H,d,J=9.0 Hz,H-17),3.18(1H,d,J=10.2 Hz,H-9),3.06(3H,s,OCH3-12),2.90(1H,d,J=12.6 Hz,H-5),2.60(1H,m,H-16α),2.24(1H,m,H-2β),2.17(1H,m,H-2α),2.01(3H,s,3-OCOCH3),1.95(1H,d,J=6.6 Hz,H-5′),1.83(1H,d,J=7.2 Hz,H-4′),1.77(1H,m,H-11α),1.76(3H,s,H-18),1.64(1H,m,H-16β),1.60(1H,m,H-11β),1.35(1H,s,H-30),1.20(1H,s,H-29),0.96(3H,s,H-19);13C-NMR(150 MHz,CDCl3)δ:170.5(3-OCOCH3),167.0(C-1′),144.7(C-14),143.0(C-23),139.3(C-21),139.1(C-13),136.8(C-3′),129.6(C-2′),128.9(C-20),110.7(C-22),98.2(C-12),78.2(C-28),77.0(C-15),74.1(C-6),73.6(C-7),71.8(C-3),71.0(C-1),54.1(OCH3-12),47.0(C-17),46.3(C-8),42.9(C-4),40.9(C-10),38.7(C-5),38.1(C-11),35.0(C-9),31.7(C-16),27.9(C-2),21.1(3-OCOCH3),20.9(C-30),19.9(C-29),16.3(C-18),16.3(C-19),14.4(C-4′),12.1(C-5′)。以上数据与文献报道基本一致[12],故鉴定化合物4 为12-O-methylvolkensin。
化合物5:白色粉末;ESI-MSm/z:415[M+Na]+,确定相对分子质量392;分子式C25H28O4;1HNMR(400 MHz,CDCl3)δ:6.57(1H,d,J=2.7 Hz,H-14),5.84(1H,dd,J=10.8,17.6 Hz,H-15),5.19(1H,dd,J=0.8,10.8 Hz,H-16b),5.18(1H,dd,J=0.8,17.6 Hz,H-16a),3.71(1H,dd,J=3.6,12.0 Hz,H-12),2.57(1H,dd,J=4.8,18.4 Hz,H-6α),2.28(1H,d,J=17.6 Hz,H-9),2.26(1H,d,J=18.4 Hz,H-6α),1.86(1H,m,H-11β),1.76(1H,m,H-1β),1.56(1H,m,H-11α),1.55(1H,m,H-3β),1.54(1H,m,H-2),1.52(1H,m,H-5),1.20(1H,m,H-3α),1.19(1H,m,H-1α),1.09(3H,s,H-17),0.88(3H,s,H-19),0.85(3H,s,H-18),0.85(3H,s,H-20);13C-NMR(100 MHz,CDCl3)δ:200.7(C-7),143.5(C-15),142.9(C-14),135.1(C-8),115.1(C-16),73.2(C-12),51.2(C-9),50.4(C-5),44.0(C-4),41.7(C-3),38.7(C-1),37.5(C-6),36.2(C-10),33.2(C-13),32.6(C-18),26.7(C-11),21.1(C-19),18.6(C-2),17.9(C-17),13.8(C-20)。以上数据与文献报道基本一致[13],故鉴定化合物5 为12-hydroxyisopimara-8(14),15-dien-7-one。
化合物6:白色粉末;ESI-MSm/z:373[M+Na]+,确定相对分子质量350;分子式C21H34O4;1HNMR(400 MHz,CDCl3)δ:5.70(1H,s,H-14),4.24(1H,s,H-6),3.71(1H,d,J=5.2 Hz,H-7),3.71(3H,s,OCH3-15),2.23(1H,m,H-12β),2.21(1H,m,H-11β),2.20(1H,m,H-12α),2.19(1H,m,H-16),2.18(1H,m,H-11α),1.81(3H,s,H-17),1.76(1H,m,H-1β),1.56(1H,m,H-2),1.43(1H,m,H-3β),1.37(1H,m,H-5),1.31(3H,s,H-18),1.21(1H,m,H-3α),1.21(3H,s,H-19),1.15(1H,m,H-1α),1.02(3H,s,H-20);13C-NMR(100 MHz,CDCl3)δ:167.4(C-15),160.5(C-13),145.7(C-9),125.2(C-8),115.0(C-14),76.3(C-7),71.9(C-6),51.1(OCH3-15),49.5(C-5),43.0(C-3),40.8(C-12),39.7(C-10),39.5(C-1),33.9(C-20),33.7(C-4),26.7(C-11),24.4(C-19),21.7(C-18),19.3(C-2),19.1(C-16),18.1(C-17)。以上数据与文献报道基本一致[14],故鉴定化合物6 为munronin R。
化合物8:白色粉末;ESI-MSm/z:337[M+Na]+,确定相对分子质量314;分子式C21H30O2;1HNMR(400 MHz,CDCl3)δ:6.53(1H,q,J=8.0 Hz,H-20),2.25(1H,m,H-12α),2.18(1H,dd,J=7.6,17.0Hz,H-15α),1.97(1H,dd,J=14.6,17.0 Hz,H-15β),1.86(3H,d,J=8.0 Hz,H-21),1.76(1H,m,H-2α),1.73(1H,m,H-11α),1.72(1H,m,H-8),1.70(1H,m,H-1α),1.69(1H,m,H-7α),1.68(1H,m,H-4α),1.65(1H,m,H-12β),1.48(1H,m,H-11β),1.46(1H,m,H-14),1.35(1H,m,H-5),1.33(1H,m,H-2β),1.30(1H,m,H-4β),1.06(3H,s,H-18),1.04(3H,s,H-19),0.97(1H,m,H-1β),0.91(1H,m,H-7β),0.89(1H,m,H-9);13C-NMR(100 MHz,CDCl3)δ:211.6(C-3),206.2(C-16),147.7(C-17),129.2(C-20),53.4(C-9),49.8(C-14),46.5(C-5),44.5(C-4),43.3(C-13),38.1(C-12),38.0(C-15),37.8(C-2),36.1(C-1),35.7(C-10),34.0(C-8),31.6(C-7),28.6(C-6),21.1(C-11),17.6(C-18),13.2(C-21),11.4(C-19)。以上数据与文献报道基本一致[16],故鉴定化合物8 为(E)-aglawone-3-one。
化合物9:白色粉末;ESI-MSm/z:467[M+Na]+,确定相对分子质量444;分子式C27H28N2O4;1H-NMR(600 MHz,CDCl3)δ:7.76(2H,d,J=6.0 Hz,H-2′,6′),7.56(1H,t,J=7.2 Hz,H-4′),7.48(2H,t,J=7.6 Hz,H-3′,5′),7.33~7.09(10H,m,H-2′′~6′′,2′′′~6′′′),6.77(1H,d,J=8.4 Hz,H-5),5.98(1H,d,J=9.6 Hz,H-5),4.80(1H,m,H-7),4.37(1H,m,H-4),3.97(1H,dd,J=12.0,4.8 Hz,H-3β),3.85(1H,dd,J=12.0,4.8 Hz,H-3α),3.26(1H,dd,J=12.0,6.0 Hz,H-10β),3.10(1H,dd,J=12.0,6.0 Hz,H-10α),2.81(2H,m,H-11),2.05(3H,s,H-1);13C-NMR(150 MHz,CDCl3)δ:170.8(C-2),170.2(C-6),167.1(C-9),136.7(C-1′′),136.6(C-1′′′),133.6(C-1′),131.9(C-4′),129.3(C-3′′),129.3(C-5′′),129.3(C-3′),129.3(C-5′),129.1(C-3′′′),129.1(C-5′′′),128.8(C-2′′),128.8(C-6′′),128.6(C-2′),128.6(C-6′),128.6(C-2′′′),128.6(C-6′′′),127.2(C-4′′),126.8(C-4′′′),64.6(C-3),55.0(C-7),49.4(C-4),38.4(C-10),37.4(C-10),20.8(C-1)。以上数据与文献报道基本一致[17],故鉴定化合 物 9 为N-(N-benzoyl-S-phenylalaninyl)-Sphenylalaninol acetate。
化合物10:白色粉末;ESI-MSm/z529[M+Na]+,确定相对分子质量506;分子式C32H30N2O4;1H-NMR(600 MHz,CDCl3)δ:7.71(1H,d,J=7.2 Hz,H-2′),7.69(1H,d,J=7.2 Hz,H-6′),7.67(1H,d,J=7.2 Hz,H-2′′′′),7.65(1H,d,J=7.2 Hz,H-6′′′′),7.53(1H,t,J=7.6 Hz,H-4′′′′),7.21~7.46(16H,m,H-3′~5′,2′′~6′′,2′′′~6′′′,3′′′′~5′′′′),6.70(1H,d,J=8.4 Hz,H-4),6.59(1H,d,J=6.4 Hz,H-7),4.94(1H,q,J=6.8 Hz,H-6),4.63(1H,m,H-3),4.05(1H,dd,J=4.4,11.6 Hz,H-2),3.32(1H,dd,J=6.4,14.0 Hz,H-10);13C-NMR(150 MHz,CDCl3)δ:171.9(C-5),167.4(C-8),167.2(C-1),137.1(C-1′′′),135.7(C-1′′),134.1(C-1′),133.2(C-1′′′′),132.0(C-4′′′′),131.4(C-4′),129.3(C-3′′),129.3(C-3′′′),129.1(C-5′′),129.1(C-5′′′),128.8(C-6′′′′),128.8(C-6′′′),128.8(C-2′′),128.7(C-2′′′′),128.7(C-2′′′),128.7(C-6′′),128.6(C-6′),128.4(C-2′),127.4(C-4′′),127.1(C-5′),127.1(C-3′′′′),127.1(C-5′′′′),127.0(C-3′),126.8(C-4′′′),65.3(C-2),54.5(C-6),50.2(C-3),37.5(C-9),37.2(C-10)。以上数据与文献报道基本一致[18],故鉴定化合物10 为N-(N-benzoyl-S-phenylalaninyl)-S-phenylalaninol benzoate。
化合物11:黄色粉末;ESI-MSm/z:415[M+Na]+,确定相对分子质量392;分子式C25H28O4;1HNMR(400 MHz,CDCl3)δ:7.76(1H,d,J=8.4 Hz,H-5),7.07(1H,s,H-6),7.07(1H,s,H-6′),6.55(1H,d,J=8.4 Hz,H-5′),6.20(1H,s,H-2′),5.36(1H,dd,J=3.2,12.8 Hz,H-2),5.36(1H,t,J=6.0 Hz,H-2′′′),5.35(1H,t,J=6.0 Hz,H-2′′),3.43(2H,d,J=7.2 Hz,H-1′′′),3.38(2H,d,J=7.2 Hz,H-1′′),3.04(1H,dd,J=3.0,16.8 Hz,H-3β),2.83(1H,dd,J=7.2,16.8 Hz,H-3α),1.78(3H,s,H-4′′′),1.78(3H,s,H-5′′′),1.74(3H,s,H-4′′),1.74(3H,s,H-5′′);13C-NMR(100 MHz,CDCl3)δ:191.7(C-4),161.3(C-7),160.9(C-8a),152.9(C-4′),135.2(C-3′′′),134.7(C-3′′),130.7(C-1′),127.3(C-2′),127.3(C-3′),126.5(C-5),125.7(C-6),125.7(C-6′),121.7(C-2′′),121.0(C-2′′′),115.0(C-8),114.5(C-4a),110.4(C-5′),79.7(C-2),44.1(C-3),29.7(C-1′′′),25.8(C-4′′),25.8(C-4′′′),22.3(C-1′′),17.9(C-5′′),17.9(C-5′′′)。以上数据与文献报道基本一致[19],故鉴定化合物11 为glabrol。
化合物12:白色粉末;ESI-MS:m/z441[M+Na]+,确定相对分子质量418;分子式C22H26O8;1H NMR(400 MHz,CDCl3)δ:6.60(1H,s,H-2′),6.60(1H,s,H-2′′),6.60(1H,s,H-6′),6.60(1H,s,H-6′′),4.75(1H,d,J=3.4 Hz,H-2),4.75(1H,d,J=3.4 Hz,H-6),4.32(1H,dd,J=7.2,5.5 Hz,H-4α),4.32(1H,dd,J=7.2,5.5 Hz,H-8α),3.94(6H,s,3′,3′′-OCH3),3.92(3H,s,5′-OCH3),3.91(3H,s,5′′-OCH3),3.85(1H,m,H-4β),3.85(1H,m,H-8β);13C-NMR(100 MHz,CDCl3)δ:147.2(C-5′),147.2(C-5′′),147.2(C-3′),147.2(C-3′′),134.3(C-4′),134.3(C-4′′),132.1(C-1′),132.1(C-1′′),102.7(C-2′),102.7(C-2′′),102.7(C-6′),102.7(C-6′′),86.1(C-2),86.1(C-6),71.8(C-4),71.8(C-8),56.4(3′-OCH3),56.4(3′′-OCH3),56.4(5′-OCH3),56.4(5′′-OCH3),54.4(C-1),54.4(C-5)。以上数据与文献报道基本一致[20],故鉴定化合物12 为syringaresinol。
化合物13:白色粉末;ESI-MSm/z:279[M+Na]+,确定相对分子质量256;分子式C13H20O5;1HNMR(600 MHz,CDCl3)δ:6.90(1H,s,H-6),6.53(1H,s,H-3),4.42(1H,d,J=6.0 Hz,H-7),3.85(3H,s,4-OCH3),3.83(3H,s,5-OCH3),3.81(1H,s,H-8),3.78(3H,s,2-OCH3),3.23(3H,s,7-OCH3),1.01(1H,d,J=6.4 Hz,H-9);13C-NMR(150 MHz,CDCl3)δ:152.7(C-2),149.3(C-4),143.6(C-5),118.3(C-1),111.1(C-6),97.4(C-3),81.7(C-7),71.8(C-8),57.4(7-OCH3),56.7(2-OCH3),56.7(5-OCH3),56.3(4-OCH3),18.0(C-9)。以上数据与文献报道基本一致[21],故鉴定化合物13 为7-methoxy-8-hydroxydihydroasarone。
3.2 抗TMV 活性实验结果
复叶地黄连全株中分离得到的化合物1~13 的抗TMV 活性结果见表1,从钝化活性结果来看,化合物1~3、5、9~12 的抑制率高于宁南霉素,表明这些化合物在体外能作用于病毒;从保护活性来看,化合物1、3、4、10、11 高于宁南霉素,化合物2、5 与宁南霉素相当,其余化合物均低于宁南霉素,表明化合物1~5、10、11 能诱导烟草获得植物系统抗性抵御病毒;从治疗活性来看,化合物1、4、5、11 高于宁南霉素,化合物2、3、9、12 和宁南霉素相当,表明化合物1~5、9、11、12 能直接作用于病毒,不影响宿主细胞;从钝化活性的IC50值结果来看,化合物1、2、3、5、9~12 具有较强的抗TMV 活性。结果显示柠檬苦素类化合物除了能诱导烟草获得植物系统抗性抵御病毒,同时能作用于病毒,从结构上看,化合物1 和2 属于A,B 环开裂的柠檬苦素,化合物3 和4 属于C 环开裂的柠檬苦素,说明不同结构类型的柠檬苦素抗植物病毒能力不同。二萜化合物、二肽类化合物、黄酮化合物既能诱导烟草获得植物系统抗性抵御病毒,也能作用于病毒,具有较强的抗植物病毒能力,丰富抗植物病毒化合物结构多样性。
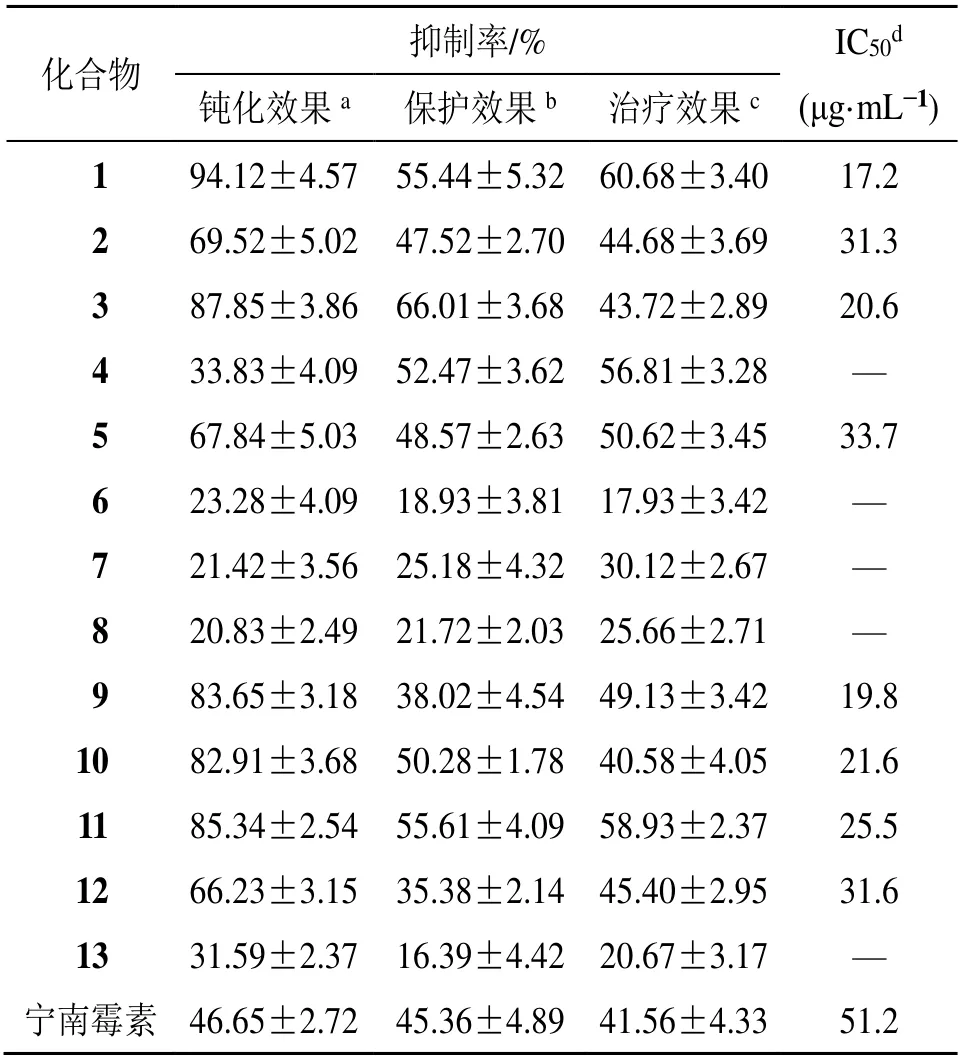
表1 化合物1~13 的抗TMV 活性Table 1 Antiviral activities of compounds 1−13 against tobacco mosaic virus
4 讨论
通过应用多种色谱方法从楝科植物复叶地黄连全株的甲醇提取物中分离得到13 个单体化合物,化合物5、7~13 为首次从该植物中分离得到。对化合物1~13 进行抗TMV 活性测试,发现化合物1~3、5、9~12 具有较强的抗TMV 活性,其活性高于阳性对照药物宁南霉素。柠檬苦素类化合物、二萜化合物、二肽类化合物、黄酮化合物既能诱导烟草获得植物系统抗性抵御病毒,也能作用于病毒,具有较强的抗植物病毒能力,柠檬苦素类化合物抗植物病毒活性可能和骨架类型紧密相关。本研究结果丰富了复叶地黄连的化学成分及生物活性内容,为其进一步的研究开发奠定了理论基础。
利益冲突所有作者均声明不存在利益冲突
