一测多评法同时测定阿娜尔妇洁液中7种成分
2021-06-24宋忠兴唐志书史鑫波刘红波马虎强解亚娟王昌利
杨 莎,宋忠兴,唐志书*,史鑫波,刘红波,马虎强,解亚娟,王昌利,
1.陕西中医药大学/陕西省中药资源产业化省部共建协同创新中心/秦药特色资源研究开发重点实验室(培育)/陕西中药产业研究院,陕西 咸阳 712083
2.陕西海天制药有限公司,陕西 咸阳 712083
阿娜尔妇洁液由苦豆子、蛇床子、花椒、石榴皮、没食子、冰片、珊瑚7 种药材组成,具有清热燥湿、止痒的功效,用于各种细菌性、霉菌性、滴虫性外阴炎、阴道炎所致妇女阴部瘙痒、红肿、白带过多等症状。处方中蛇床子具有温肾壮阳、杀虫止痒、祛风燥湿等功效,可用于治疗阴痒带下、湿疹瘙痒、肾虚阳痿、湿痹腰痛、宫冷不孕等症[1]。临床上外用可用于治疗各种皮肤病及滴虫性阴道炎,手、足癣感染等疾病。蛇床子主要药效成分为香豆素类成分,主要包括蛇床子素、花椒毒酚、花椒毒素、佛手柑内酯、欧前胡素、异茴芹内酯等成分[2-3]。现代药理研究表明,蛇床子在抗菌、抗病毒、抗诱变、抗肿瘤、抗炎等方面疗效显著[4-8]。处方中花椒主要具有温中止痛、杀虫止痒功效,用于治疗脘腹冷痛、呕吐泄泻、虫积腹痛;外治湿疹阴痒。研究表明,花椒的化学成分主要有挥发油、酰胺、生物碱、香豆素、木脂素、黄酮等[9],而花椒中以花椒素为代表的链状不饱和脂肪酸酰胺是花椒麻味的主要成分[10]。现代药理研究表明,花椒具有镇痛、抑菌、抗炎、抗肿瘤、抗凝血、抗氧化、抗腹泻、抑制平滑肌收缩等活性成分[11-12]。
中药复方制剂组成复杂多样,通过多成分、多靶点协同作用而达到治疗作用,单一成分的检测难以全面评价复方整体质量,故多指标成分质量控制模式已广泛应用于中药及其制剂的质量控制中。因此,建立多组分质量控制方法对提升本产品的质量控制水平具有重要意义。
有文献报道了HPLC 法测定阿娜尔妇洁液中的蛇床子素和欧前胡素的含量[13],苦参碱和槐定碱含量[14],且均采用外标法对一种或几种成分的含量进行测定,未见更多组分同时在阿娜尔妇洁液测定中的报道。一测多评(QAMS)法[15]利用中药有效成分间存在的内在函数关系,建立内标与其他成分之间的相对校正因子(fs/i),仅使用一种质量稳定、易于获得、价格低廉的对照品,实现对中药及其制剂中多指标成分含量的同时测定,正成为质量评价新模式。近年来,该方法广泛地应用于同类型化学成分以及一些紫外吸收相近的不同类型化学成分的定量分析,如木脂素类、黄酮类、蒽醌类、生物碱类以及皂苷类等[16-20]。综上所述,花椒和蛇床子在本制剂中活性成分较为明确,鉴于目前,对于同时测定花椒和蛇床子中更多成分的定量鉴别还没有相应的测定方法,笔者通过查阅大量的文献,结合本品制备工艺方法,拟采用QAMS 法在其成品质量控制中选择以花椒和蛇床子中的7 种成分作为定量测定指标。因此本实验采用该方法,以花椒毒酚为内参物,建立了花椒毒酚与花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素之间的fs/i,利用fs/i计算阿娜尔妇洁液中7种成分的含量并与外标法所得的结果进行对比,验证所建QAMS 法的可行性和准确性,为进一步提高该制剂质量控制和评价水平提供科学依据。
1 材料
1.1 仪器
Waters e2695 型高效液相色谱仪,Waters 2998检测器,Empower 色谱工作站,Waters 公司;Agilent 1260 型高效液相色谱仪,包括自动进样装置,二元梯度泵,柱温箱,DAD 检测器,美国安捷伦科技公司;色谱柱为Agilent TC-C18(250 mm×4.6 mm,5 μm)、Diamonsil C18(250 mm×4.6 mm,5 μm)、YMC-Pack ODS-A(250 mm×4.6 mm,5 μm);CPA225D 电子天平,北京赛多利斯科学仪器有限公司;KQ-300DE 型数控超声波清洗器,昆山市超声仪器有限公司;Milli-Q 型纯水器,美国Millipore公司。
1.2 试药
对照品花椒毒酚(批号P28M10M89335,质量分数98%)、花椒毒素(批号P30J7M16998,质量分数98%)、异茴芹内酯(批号R01J11F117174,质量分数98%)均购自上海源叶生物科技有限公司;对照品羟基-α-山椒素(批号HR-2528W1,质量分数98%)、羟基-β-山椒素(批号HR-9532W1,质量分数98%)均购自宝鸡晨光生物科技有限公司;对照品蛇床子素(批号110822-201710,质量分数99.5%)、欧前胡素(批号110826-201616,质量分数99.6%)均购自中国食品药品检定研究院。蛇床子、花椒、苦豆子、冰片、珊瑚、石榴皮、没食子均由陕西海天制药有限公司提供,经陕西中医药大学刘世军高级工程师鉴定均为正品,蛇床子为伞形科蛇床属植物蛇床Cnidium monnieri(L.)Cuss.的干燥成熟果实,花椒为芸香科花椒属植物花椒Zanthoxylum bungeanumMaxim.的干燥成熟果皮,苦豆子为豆科槐属植物苦豆子Sophora alopecuroidesL.的干燥成熟种子,冰片为菊科植物艾纳香Blumea balsamifera(L.)DC.的新鲜叶经提取加工制成的结晶,珊瑚为矶花科动物桃色珊瑚Corallium japonicumKishinouye 等珊瑚虫分泌的石灰质骨骼,石榴皮为石榴科植物石榴Punica granatumL.的干燥果实,没食子为壳斗科植物没食子树Quercus infectoriaOlivier 幼枝上由没食子蜂Cynips gallae-tinctoriaeOlivier 寄生而成的虫瘿。阿娜尔妇洁液(150 mL/瓶,批号190603、190701、190702、190703、190704、190705、190706、191001、191002、191003)由陕西海天制药有限公司提供。甲醇和乙腈均为色谱纯,上海霍尼韦尔贸易有限公司;水为超纯水,其他试剂为分析纯。
2 方法与结果
2.1 色谱条件
采用Agilent TC-C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈-0.1%磷酸水溶液,梯度洗脱:0~8 min,2%~7%乙腈;8~13 min,7%~12%乙腈;13~39 min,12%~55%乙腈;39~42 min,55%~60%乙腈;42~55 min,60%~70%乙腈;55~60 min,70%~2%乙腈;体积流量1 mL/min;柱温30 ℃;检测波长218 nm(花椒毒酚、花椒毒素、异茴芹内酯、欧前胡素[1,21-22]),267 nm(羟基-α-山椒素、羟基-β-山椒素[23]),320 nm(蛇床子素);进样量10 μL。该条件下,理论塔板数按花椒毒酚计算不低于1×105,各成分分离度良好(R>1.5),色谱图见图1。
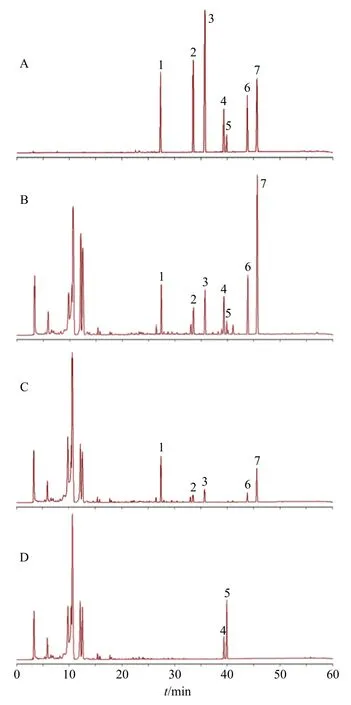
图1 混合对照品(A)、阿娜尔妇洁液供试品(B)、缺花椒阴性样品(C)和缺蛇床子阴性样品(D)的HPLC 图Fig.1 HPLC of mixed reference substances(A),sample of A'naer Vigills(B),negative sample of Z.bungeanum(C),and negative sample of C.monnieri(D)
2.2 溶液的制备
2.2.1 对照品溶液的制备 分别精密称取花椒毒酚、花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素和蛇床子素对照品适量,用甲醇制成质量浓度分别为300、410、820、530、280、340、500 μg/mL 的混合对照品溶液,摇匀,于4 ℃冰箱中避光保存,备用,滤过,取续滤液,即得。
2.2.2 供试品溶液的制备 精密量取阿娜尔妇洁液10 mL,置分液漏斗中,加水20 mL,氨试液6 mL,混匀,用三氯甲烷提取5 次(20、20、15、15、15 mL),合并三氯甲烷层,加5 g 无水硫酸钠脱水,滤过,滤液蒸干,残渣用甲醇溶解并定容至50 mL 量瓶中,摇匀,滤过,取续滤液,过0.22 μm 微孔滤膜即得。
2.2.3 阴性样品溶液的制备 按照处方比例以及制剂工艺,分别制备缺花椒、缺蛇床子的阴性样品,按照“2.2.2”项下方法制备,即得。
2.3 方法学考察
2.3.1 线性关系考察 分别精密吸取适量“2.2.1”项下的混合对照品溶液1、2.5、5、7.5、10、15 μL,按照“2.1”项下色谱条件进样测定,以进样量作为横坐标(X),峰面积积分值为纵坐标(Y),进行线性回归分析,得回归方程花椒毒酚Y=226 602X-68 179,r2=1.000 0,线性范围30~450 μg;花椒毒素Y=311 951X-106 820,r2=0.999 9,线性范围41~615 μg;异茴芹内酯Y=486 372X-144 726,r2=0.999 9,线性范围82~1230 μg;羟基-α-山椒素Y=166 140X-56 687,r2=0.999 8,线性范围53~795 μg;羟基-β-山椒素Y=66 487X-21 410,r2=0.999 7,线性范围28~420 μg;欧前胡素Y=212 190X-66 499,r2=0.999 6,线性范围34~510 μg;蛇床子素Y=290 272X-92 455,r2=0.999 7,线性范围50~750 μg。结果表明,7 种成分在各自相应范围内线性关系良好。
2.3.2 精密度试验 取“2.2.1”项下混合对照品溶液10 μL,按“2.1”项下色谱条件重复进样6 次,记录各组分峰面积,结果花椒毒酚、花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素的峰面积RSD值分别为0.49%、0.64%、0.67%、0.66%、0.57%、0.70%、0.61%,表明在该条件下仪器精密度良好。
2.3.3 稳定性试验 取同一批阿娜尔妇洁液样品(批号191001),按照“2.2.2”项下方法制备供试品溶液,室温下放置,分别于0、2、4、8、12、24 h,按照“2.1”项下色谱条件进样测定,记录峰面积,得花椒毒酚、花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素的峰面积RSD 值分别为2.20%、1.49%、1.48%、1.32%、1.29%、1.43%、1.43%,表明该供试品溶液在室温下24 h内稳定性良好。
2.3.4 重复性试验 取同一批阿娜尔妇洁液样品(批号191001),按照“2.2.2”项下操作条件平行制备6 份供试品溶液,按照“2.1”项下色谱条件进行测定,计算花椒毒酚、花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素的含量及其RSD,结果测得7 个成分平均质量浓度分别为0.464 4、0.351 1、0.747 1、1.318 2、0.565 5、0.965 4、2.883 1 mg/mL,RSD 值分别为2.05%、2.74%、1.91%、1.68%、1.48%、1.60%、1.66%,说明该方法的重复性良好。
2.3.5 加样回收率试验 取同一批阿娜尔妇洁液样品(批号191001)共9 份,每份10 mL,分成3组,置100 mL 具塞锥形瓶中,分别按已知质量浓度的50%、100%、150% 3 个水平加入各对照品溶液,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,记录色谱峰,计算加样回收率。结果花椒毒酚、花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素的平均加样回收率分别为102.51%、99.75%、98.80%、103.70%、100.82%、98.67%、101.06%,RSD 分别为1.53%、1.30%、1.75%、2.69%、1.16%、1.74%、1.78%,表明该方法准确度良好。
2.4 fs/i 的确定及其耐用性考察
2.4.1fs/i的测定 取“2.2.1”项下的混合对照品溶液,按照“2.1”项下色谱条件进样1、3、5、7、9、11 μL,记录各成分峰面积,以花椒毒酚为内参物,采用多点校正法,按照下面公式分别计算花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素的fs/i,结果见表1。
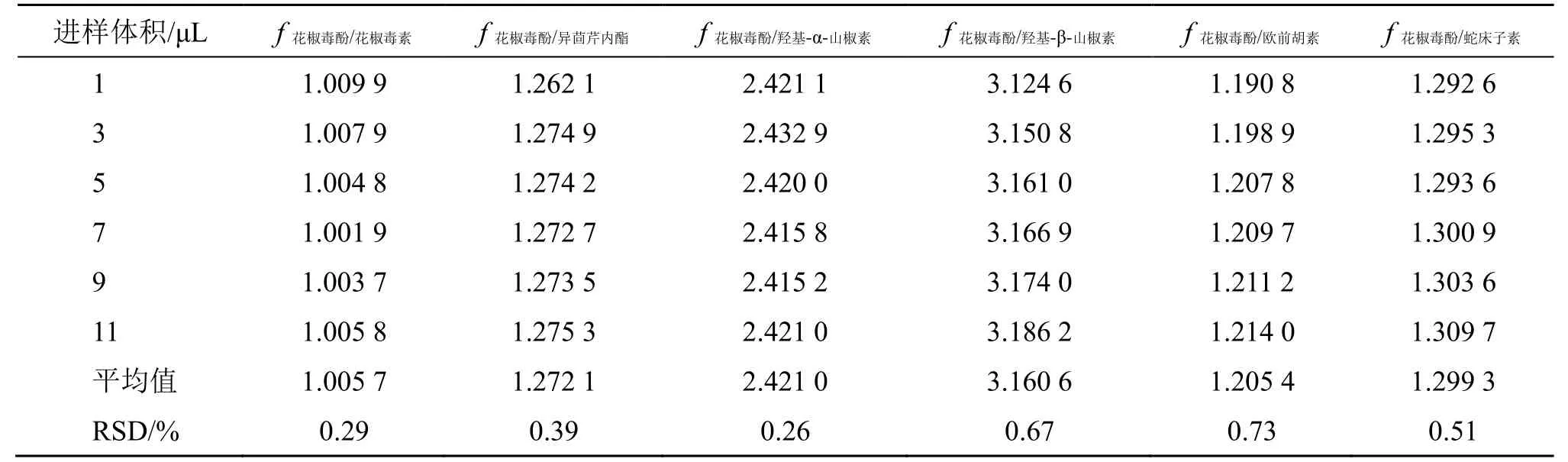
表1 各组分的fs/iTable 1 fs/i values of each component
fs/i=fs/fi=AsCi/AiCs
As为花椒毒酚对照品的峰面积,Cs为花椒毒酚对照品的质量浓度,Ai为待测成分峰面积,Ci为待测成分的质量浓度
2.4.2 不同仪器对fs/i的影响 考察了2台仪器对fs/i的影响,结果见表2。表明不同仪器对所测组分的fs/i无明显影响。

表2 不同仪器对fs/i 的影响Table 2 Effects of different instruments on fs/i
2.4.3 不同色谱柱对fs/i的影响 考察了Agilent 5 TC-C18(250 mm×4.6 mm,5 μm)、Diamonsil C18(250 mm×4.6 mm,5 μm)、YMC-Pack ODS-A(250 mm×4.6 mm,5 μm)对7 个组分fs/i的影响,结果见表3。表明3 根色谱柱对各成分的fs/i无明显影响。
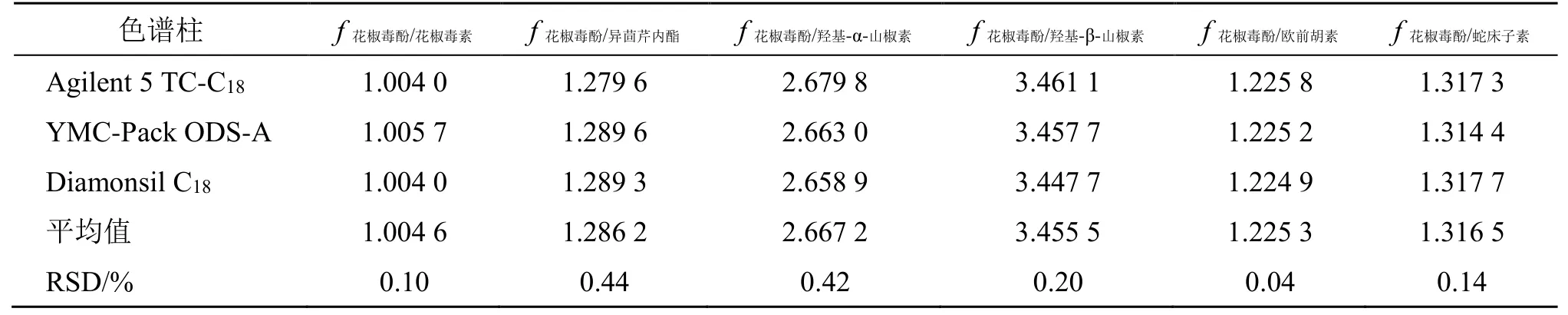
表3 不同色谱柱对fs/i 的影响Table 3 Effects of different columns on fs/i
2.4.4 不同柱温对fs/i的影响 考察了柱温25、28、30、32、35 ℃对fs/i的影响,结果见表4。表明不同柱温对各成分的fs/i无明显影响。

表4 不同柱温对fs/i 的影响Table 4 Effects of different column temperatures on fs/i
2.4.5 体积流量对fs/i的影响 本实验考察了不同体积流量0.8、0.9、1.0 mL/min 对fs/i的影响,结果见表5。表明不同体积流量的变化对各成分的fs/i无明显影响。

表5 不同体积流量对fs/i 的影响Table 5 Effects of different volumetric flow rates on fs/i
综上几种因素,说明该方法对fs/i耐用性良好。
2.5 待测组分色谱峰定位
取“2.2.1”项下混合对照品溶液,按“2.1”项下色谱条件进样测定,以花椒毒酚为内标,并考察其他6 种成分在不同仪器、色谱柱的相对保留时间(ts/i),对待测成分色谱峰进行定位,结果见表6。

表6 不同色谱柱测得的相对保留值Table 6 Relative retention value of different columns
2.6 QAMS 法与外标法结果对比
取10 批样品,按照“2.2.2”项下条件制备供试品溶液,在“2.1”项下色谱条件进行测定,记录峰面积,采用QAMS 法建立内参物花椒毒酚与花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素的fs/i,对10 批阿娜尔妇洁液样品中7种成分进行含量测定,同时采用外标法对花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素成分进行含量测定,结果见表7。结果发现,外标法与QAMS 法测定的组分含量基本一致,经t检验比较显示,外标法实测各成分含量值与QAMS 法所测成分含量值无显著性差异,10 批样品中花椒毒酚与花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素外标法与QAMS 法综合质量浓度分别为0.450 3~0.523 3、0.355 2~0.395 8、0.744 7~0.819 3、1.275 9~1.356 0、0.546 6~0.592 4、0.941 3~1.053 1、2.796 6~3.152 9 mg/mL,以蛇床子素、羟基-α-山椒素、欧前胡素等成分含量较高。
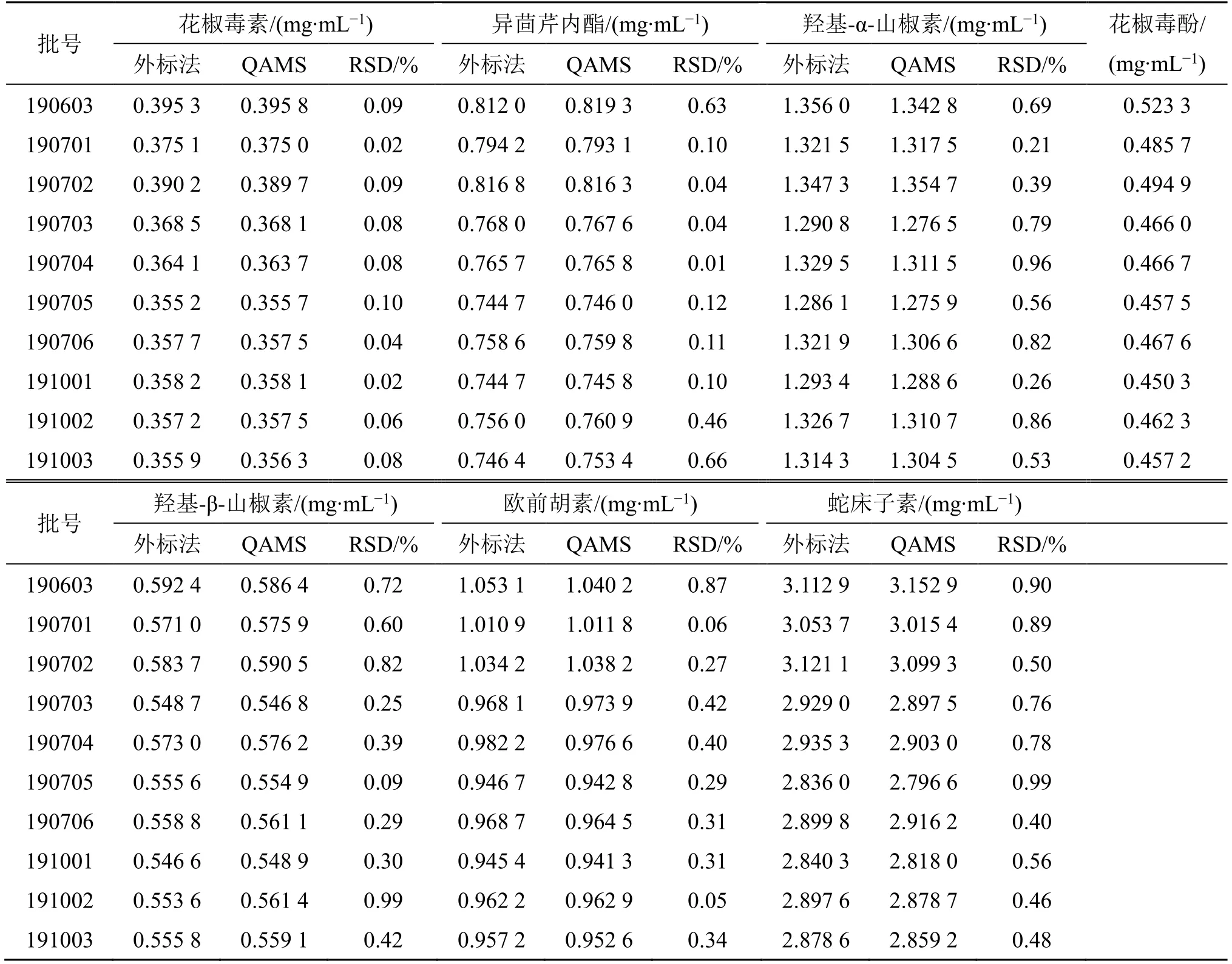
表7 QAMS 法与外标法测定10 批阿娜尔妇洁液中7种成分的质量浓度Table 7 Content of seven constituents in ten batches of A'naer Vigills by QAMS and ESM
3 讨论
3.1 供试品溶液制备方法的筛选
本实验考察了供试品溶液制备方法,即取样品适量用甲醇直接稀释滤过制得样品;取本品适量置分液漏斗中,加乙醚提取4 次(30、30、20、20 mL),提取液蒸干,残渣加适量甲醇使溶解滤过制得样品[24];量取本品适量,水浴蒸干,残渣加适量甲醇溶解,超声处理,滤过制得样品[25];取本品适量,置分液漏斗中,加水20 mL,氨试液6 mL,混匀,用三氯甲烷提取5 次(20、20、15、15、15 mL),合并三氯甲烷层,加5 g 无水硫酸钠脱水,滤过,滤液蒸干,残渣用甲醇溶解并定容至50 mL 量瓶中,摇匀,滤过制得样品。结果发现第4 种方法制得的样品检测出的谱图相对较多,各峰高比例适中,分离度较好,基线平稳,因此以第4 种方法作为阿娜尔妇洁液供试品的制样方法。
3.2 流动相的筛选
本实验考察了甲醇、乙腈-水、甲醇-0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液、甲醇-0.1%磷酸水溶液、乙腈-0.1%磷酸水溶液等不同体系流动相,结果表明乙腈-0.1%磷酸水溶液作为流动相色谱峰峰形较好,各峰之间的分离度良好,基线较平稳,最终选择乙腈-0.1%磷酸水溶液作为流动相。
3.3 检测波长的选择
通过紫外扫描光谱可知花椒毒酚、花椒毒素、异茴芹内酯、羟基-α-山椒素、羟基-β-山椒素、欧前胡素、蛇床子素的最大吸收波长分别为218.5、217.4、223.3、270.6、267.0、218.5、321.7 nm,通过比较分析在波长218 nm 条件下的峰数目、峰形、分离度、对称因子、理论塔板数等参数发现,在波长218 nm 条件下,上述信息均相对较好,故选择以218 nm 作为含量分析波长。
4 结论
本研究首次建立了QAMS 法同时测定阿娜尔妇洁液中7种成分的含量,通过考察不同液相色谱仪、不同品牌色谱柱、柱温以及体积流量对fs/i的影响,对QAMS 法的可行性进行了探讨,结果表明,在本实验条件下外标法和QAMS 法均无显著差异。同时采用QAMS 法和外标法分别测定10 批阿娜尔妇洁液中7种成分的含量,结果表明QAMS 法和外标法测得的结果没有显著差异,说明在对照品短缺的情况下,以花椒毒酚为内参物建立的QAMS 法可用于阿娜尔妇洁液指标性成分含量测定和质量评价,为全面评价该制剂质量提供参考依据。
利益冲突所有作者均声明不存在利益冲突
