2005—2020年申请临床试验中药新药的审评审批情况分析
2021-06-24王玲玲胡流芳张晓东周跃华
王玲玲,胡流芳,张晓东,周 刚,周跃华
国家药品监督管理局 药品审评中心,北京 100022
自1985年《新药审批管理办法》颁布以来,中药新药的注册相关管理法规历经多次修订。2002年国家药品监督管理局颁布《药品注册管理办法》(试行)(局令第35 号)。2005年《药品注册管理办法》(局令第17 号)正式实施。2007年国家药品监督管理局再次修订《药品注册管理办法》(局令第28 号)。2020年国家市场监督管理总局颁布《药品注册管理办法》(市场监督总局令第27 号)[1],中药注册分类调整为新的4 分类法。2020年9月27日,国家药品监督管理局发布《中药注册分类及申报资料要求》(2020年第68号通告)[2],对中药注册分类进一步细化,明确了申报资料要求,于2021年1月1日起正式实施。
《药品注册管理办法》从2005年正式实施至2020年再次修订,中药新药的注册分类基本一致。对2005—2020年申请的中药新药的研发及审评审批情况进行分析,对今后中药新药的研究与评价具有重要的参考价值。本文较系统地回顾了2005—2020年中药新药临床试验(investigational new drug,IND)申请及审评审批情况,以期为今后中药新药的研发提供参考。
1 数据来源与研究方法
1.1 数据来源
国家药品监督管理局药品审评中心(center for drug evaluation,CDE)审评数据库。
1.2 数据范围
本文选取同时符合以下条件的品种为分析对象:(1)由国内药品生产企业提出的IND 申请(不含进口植物药及按进口药管理的品种);(2)CDE 接受申报资料的时间为2005年5月1日—2020年12月31日;(3)已完成审评,有明确审评结论并已报送国家药品监督管理局;(4)注册分类为1~6 类的中药新药;2020年7月1日—2020年12月31日为中药注册分类及申报资料要求的过渡期,这段时间申请的品种按原中药注册分类进行归纳。此外,根据“一个受理号对应一个新药制剂品种”的原则对上述IND 申请的受理号进行删减,具体情形为:(1)同一品种同时申请多个规格的,按1 个品种计;(2)考虑到有效部位、有效成分、新药材、新药用部位等原料药不直接用于临床,故仅对制剂进行统计,原料药不计算在内;(3)正在审评、未经审评而撤回等未完成审评的品种不计算在内。
1.3 数据处理
采用Microsoft Excel 2016 处理数据。
2 中药新药IND 申请及审评审批情况
2.1 申请品种数量
2005—2020年,CDE 共受理的中药1~6 类IND 注册申请的制剂品种数共1096 个,按CDE 承办年份进行分类统计,见表1。由表1 可知,2005—2007年中药新药IND 申请数量较多。2008—2015年申请数量相对稳定,在一定范围内波动。2016年后申请数相对较少。

表1 2005—2020年申请IND 的中药新药制剂的受理情况Table 1 Acceptance of new Chinese medicine preparations applying for IND from 2005 to 2020
2018年7月,国家药品监督管理局发布了《关于调整药物临床试验审评审批程序的公告》(2018年第50 号)[3],要求申请人在提出新药首次药物临床试验申请之前,应向CDE 提出沟通交流会的申请。据不完全统计,2018—2020年已开展中药新药临床前(pre-IND)的品种数分别为9、40、41 个。已召开pre-IND 沟通交流会但未申报的品种有望在进一步研究后正式提出IND 申请。此外,2021年1月1日—2021年4月30日,CDE 已承办中药1 类创新药IND 申请品种数为13 个(以制剂受理号计)。
2.2 审评结论情况
选择完成药品技术审评后送国家药品监督管理局的时间为结束审评的时间点,对2005—2020年申请IND 的1096 个中药新药制剂的审评结论进行了分析(批准或不批准)。批准率=某年申请IND的中药新药制剂中获批的品种数/同年申请IND 的中药新药制剂的品种总数(以CDE 承办年份计)。由于各种情况,已审结品种的审评结论有多种表达形式,将退审、不批准、各种原因终止审评(不含未经审评而撤回的品种)的品种按不批准处理。2020年实施默示许可制度后,获得临床试验通知书的品种归入批准临床,暂停临床试验的品种按不批准处理。
从图1 可以看出,2005—2015年IND 申请的中药新药制剂的批准率相对稳定,2016年后明显提高。

图1 2005—2020年申请IND 的中药新药制剂的审评结论情况(时间为CDE 承办年份)Fig.1 Review conclusions of new Chinese medicine preparations applying for IND from 2005 to 2020(time of CDE acceptance)
2.3 注册分类
2005年《药品注册管理办法》(局令第17 号)[4]与2007年《药品注册管理办法》(局令第28 号)[5]在中药新药的注册分类方面基本一致。1 类:未在国内上市销售的从植物、动物、矿物等物质中提取的有效成分及其制剂。2 类:新发现的药材及其制剂。3 类:新的中药材代用品。4 类:药材新的药用部位及其制剂。5 类:未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂。6 类:未在国内上市销售的中药、天然药物复方制剂。批准率=某注册分类批准品种数/某注册分类品种(批准+不批准)总数。2005—2020年申请IND 中药新药制剂的注册分类及审评结论情况见表2。

表2 2005—2020年申请IND 的中药新药制剂的注册分类与审评结论情况Table 2 Registration classification and review conclusions of new Chinese medicine preparations applying for IND from 2005 to 2020
由表2 可知,中药6 类申报量最多,申报量约占申请IND 中药新药制剂总量81.66%,其批准率为58.77%,相对较高。中药5 类,申报量较多,但批准率较低,仅为25.00%。数据显示,中药5 类新药的研发难度与研发风险相对较大。
2.4 治疗领域
2005—2020年申请IND 中药新药制剂的不同治疗领域及审批情况见图2。按注册申请的功能主治进行分类统计,同品种中涉及多个适应症的以最主要的适应症为准。适应症分为16 类:(1)呼吸类,主要涉及上呼吸道感染、肺相关疾病(如肺结核、肺炎等)、支气管炎、支气管哮喘等呼吸系统疾病;(2)消化类,主要涉及胃、肝、肠、胆等相关的消化系统疾病;(3)精神神经类,如中风、抑郁症、焦虑、失眠、痴呆、多动症等;(4)妇科类,主要与女性相关的疾病,如子宫及附件疾病、绝经期综合征、阴道炎、盆腔炎、乳腺增生、不孕症等;(5)心血管类,主要与心脏、血管相关的疾病,如高血压、冠心病、心绞痛、心肌炎等;(6)五官类,主要与耳、鼻、喉、口、眼相关的疾病,如中耳炎、鼻出血、咽炎、口腔溃疡、牙周炎、干眼症等;(7)骨科类,主要与骨骼相关的疾病,如肩周炎、腰椎间盘突出、颈椎病、软组织损伤、股骨头坏死、绝经后骨质疏松等;(8)肿瘤类,如肺癌、肝癌、乳腺癌、胃癌、食管癌等;(9)内分泌类,主要涉及糖尿病、甲亢、代谢异常综合征、内分泌失调等;(10)风湿免疫类,主要为风湿、类风湿;(11)泌尿生殖类,主要涉及前列腺疾病、尿路感染、少精子症、阳痿、滑精、早泄等;(12)皮肤类,主要涉及皮肤疾病,如湿疹、白癜风、黄褐斑、扁平疣、银屑病、荨麻疹、生殖器疱疹、尖锐湿疣等;(13)外科类,主要涉及痔疮、肛裂、烫/烧伤、跌打损伤、伤口感染等;(14)肾病类,主要与肾脏相关疾病,如肾功能衰竭、肾盂肾炎、糖尿病肾病、尿毒症等;(15)艾滋病类,主要为治疗艾滋病用药;(16)其他,为疼痛、中毒、血液病等难以归类的5 个品种,因申报量较少而未在图2 中呈现。批准率=某治疗领域批准品种数/某治疗领域品种(批准+不批准)总数。

图2 2005—2020年申请IND 的中药新药制剂的的治疗领域分布情况Fig.2 Distribution of therapeutic areas of new Chinese medicine preparations applying for IND from 2005 to 2020
从图2 可知,中药IND 申请品种的适应症相对集中,62%品种集中在呼吸、消化、精神神经、妇科、心血管5 个方面,其他治疗领域的申报量相对较少。其中,呼吸系统的申报量最高,有153 个品种;其次为消化系统151 个;第3 为精神神经用药134 个。皮肤、外科、肾脏病、艾滋病等方面的申报量较少,仅占8.39%。
从批准率分析,批准率大于60%治疗领域有呼吸、风湿免疫、肾脏病。批准率较低的治疗领域有肿瘤、内分泌。肿瘤适应症的不批准品种中有38.89%为中药1 类和5 类,内分泌适应症的不批准品种中有31.37%为中药1 类和5 类。
2.5 处方来源
将2005—2020年申请IND 中药新药制剂的处方来源分为11 类:(1)临床经验方,为医生的临床经验方或医院协定处方;(2)有效部位,新的有效部位制剂;(3)院内制剂,按国家有关要求获得院内制剂批号的制剂;(4)古方化裁,在古代医籍方剂的基础上加减化裁而来的处方;(5)科研方,主要依据动物实验等研究结果确定的处方;(6)古代医籍方,古代医籍收载的方剂;(7)民间经验方,来源于民间的处方;(8)有效成分,从植物、动物、矿物等物质中提取的有效成分;(9)家族传承方,为家族几代人传承的处方;(10)二次开发,主要为已上市中药制剂、保健品、卫消字号等产品二次开发的品种;(11)其他,为未明确处方来源、新药材及其制剂、新药用部位及其制剂、药材替代品等。对申请IND 中药新药制剂的处方来源前10 类的分类统计情况见图3。批准率=某处方来源批准品种数/某处方来源(批准+不批准)总数。处方来源为第11 类“其他”的制剂共涉及42 个;其中,批准品种21 个(17 个未明确处方来源,4 个品种为新药材及其制剂、新药用部位及其制剂及药材替代)、不批准品种21 个(18 个品种未明确处方来源,3 个品种为新药材及其制剂、新药用部位及其制剂及药材替代)。
从图3 可知,处方来源于临床经验方、有效部位、院内制剂、古方化裁较多,占整体的74.08%。具有人用经验的临床经验方、院内制剂、古方化裁、家族传承方的批准率较高,均大于60%;而有效部位、科研方的批准率相对较低,不高于40%。数据显示,具有人用经验的中药新药研发成功率相对较高。
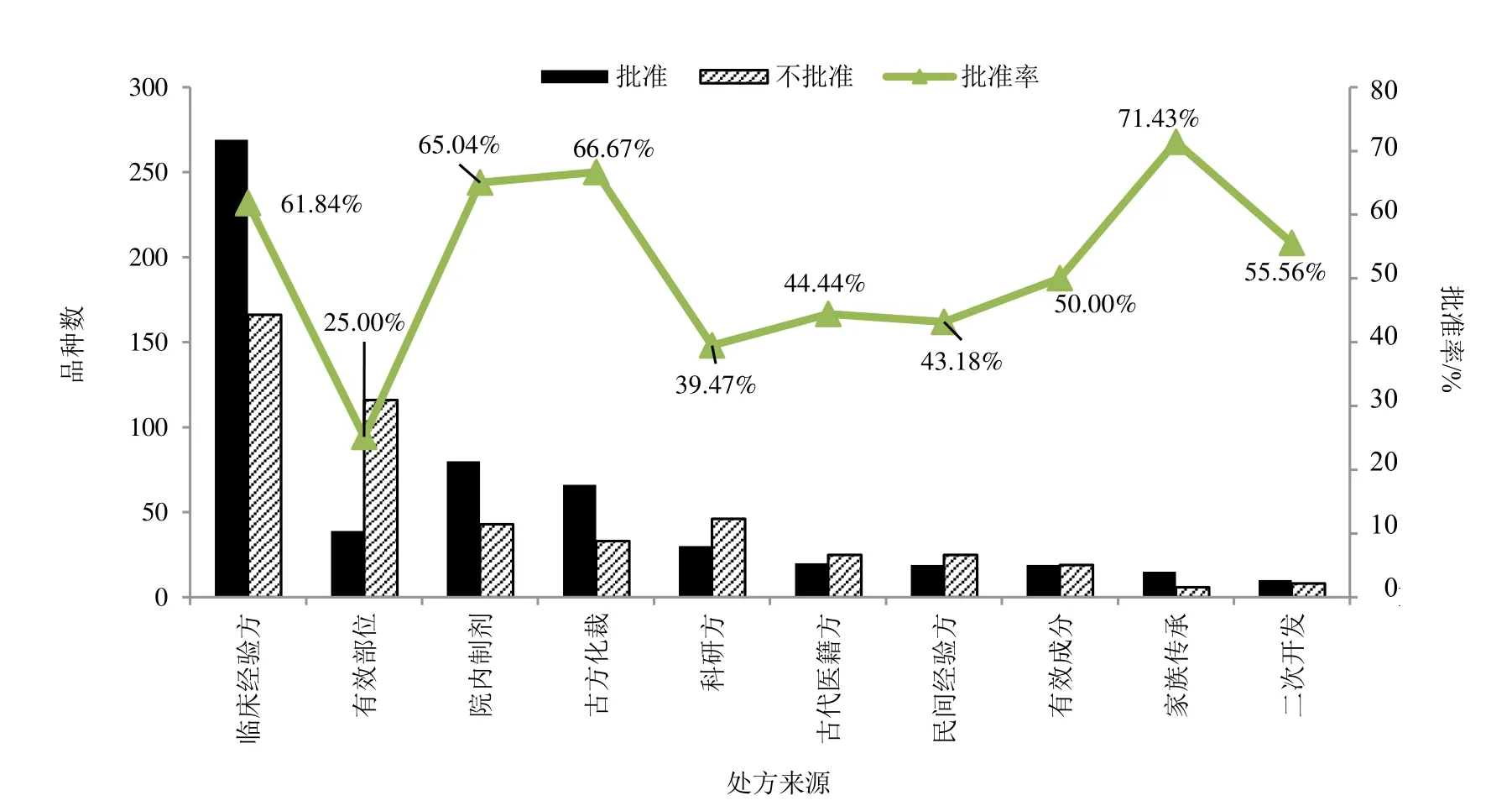
图3 2005—2020年申请IND 的中药新药制剂的处方来源分布Fig.3 Distribution of prescription sources of new Chinese medicine preparations applying for IND from 2005 to 2020
2.6 剂型分布
2005—2020年申请IND 中药新药制剂的剂型分布情况见图4。其中,涉及剂型种类有27 种。。批准率=某类剂型批准品种数/某类剂型品种(批准+不批准)总数。申报总量在5 个以下的剂型,有膏药、糖浆剂、乳膏剂、鼻用制剂、洗剂、茶剂、灌肠剂等12 种,仅涉及25 个品种,未在图4 中呈现。
由图4 可知,申报数量较多的前5 种剂型分别为胶囊剂、颗粒剂、片剂、注射剂、丸剂,占IND品种的85.31%。其中,在批准的IND 品种中以胶囊剂、颗粒剂、片剂、丸剂数量较多,占批准IND品种的82%。

图4 2005—2020年申请IND 的中药新药制剂的剂型分布Fig.4 Distribution of dosage forms of new Chinese medicine preparations applying for IND from 2005 to 2020
从批准率情况分析,颗粒剂、片剂的批准率较高。注射剂、眼用制剂为高风险制剂,批准率较低。中药注射剂的批准率最低,为8.89%。搽剂批准率较低有其具体原因,5 个不批准品种的原因为:3 个品种存在非临床安全性问题、1 个立题依据不充分、1 个因补充资料超时不批准。
2.7 地域分布
2005—2020年申请IND 中药新药制剂的申报单位所在省份的统计结果见表3。涉及多家申报单位的以排名第1 位的申报单位所在省份为准。由表3 可知,申报单位所在地区共有30 个省、直辖市、自治区。在中药新药研发数量上,江苏、北京、广东居前3 名。

表3 2005—2020年申请IND 的中药新药制剂的申请单位的地域分布Table 3 Regional distribution of applicants for new Chinese medicine preparations applying for IND from 2005 to 2020
2.8 开展临床试验情况
为加强临床试验期间新药安全性监管,保护受试者安全,2012年CDE 开通了《药物临床试验登记和信息公示平台》,要求凡获国家药品监督管理局临床试验批件并在我国进行临床试验的,均应在该平台进行登记与信息公示。截至2021年4月30日,2005—2020年申请IND 中药新药获得批准的588个制剂中,可查询到319 个中药新药进行了临床试验登记(不包含已申请药品上市许可的品种),见表4。
根据CDE 网站《药物临床试验登记填写指南》(V2.0 版)[6],临床试验登记平台中“试验状态”为8 类,分别为进行中、已完成、主动暂停、主动终止、IEC/IRB 暂停、责令暂停、IEC/IRB 终止、责令终止。在当前中药临床试验登记品种中“试验状态”主要涉及前3 类:(1)进行中,包含尚未招募、招募中和招募完成3 种状态(尚未招募:该临床试验尚未开始招募受试者,如正处于准备阶段或伦理委员会的审核阶段,即尚未签署首例知情同意书;招募中:该临床试验已进行,正在招募受试者,即已签署首例知情同意书;招募完成:该临床试验尚在进行中,但已经完成了全部预定受试者的招募过程);(2)已完成,该临床试验正常完成,按照临床方案已经完成计划的试验数据的全部临床收集工作,即最后一例受试者完成给药和全部检查,数据盲态审核启动前;(3)主动暂停,指申请人由于某种原因主动暂停了(可能再启动并继续进行)该临床试验的进程。
从表4 可见,2005—2020年申请IND 中药新药获得批准品种中,临床试验阶段处于Ⅱ期有239个,在Ⅲ期有46 个。已完成Ⅲ期临床试验及招募完成的有14 个,完成Ⅱ期临床后正在进行Ⅲ期临床试验招募的有30 个。表中40 多个已完成或正在开展Ⅲ期临床试验的品种,有望在近年中提出药品上市许可申请(new drug application,NDA)。
此外,588 个获准开展临床试验的中药新药中,可追溯到27 个品种申报NDA,其中包含了国家食品药品监督管理总局发布《关于药物临床试验数据自查核查撤回注册申请情况的公告》(2015年第201号)公告后撤回的14 个品种。14 个撤回的品种中,随着研究的完善,截至2021年4月30日,已有3个品种在撤回后又重新申报了NDA,有1 个撤回品种在临床试验登记平台重新登记了Ⅲ期临床试验研究。需要说明的是,可能有部分品种在申报NDA 时变更了药品名称而无法溯源,实际申报NDA 品种数量可能大于可追溯数量。
3 分析与讨论
3.1 申请品种
2005—2020年CDE 共受理1096 个申请IND的中药新药制剂。IND 申请的品种数可大致反映出当年新药研发者新药研究的积极性。从2005—2007年受理的品种数看,中药新药研发的积极性相对较高。2008—2015年新药研发总体平稳,申请IND 的数量在一定范围内正常波动。2015年,国家药品监督管理局发布《关于开展药物临床试验数据自查核查工作的公告》(2015年第117 号)[7]后,大部分已完成临床试验申请NDA 的品种撤回,中药新药研发者的信心受到影响,申请新药IND 的数量减少,2019年申请数量达到低谷。
2018—2020年已完成pre-IND 沟通交流会的品种数明显增加。如2019、2020年,虽然分别仅有14、15 个中药新药提出IND 申请,但有40、41 个品种召开了pre-IND 沟通交流会,暂时未申请的品种有望在进一步研究后正式申报。此外,2021年1月1日—2021年4月30日,CDE 已承办中药新药IND 申请品种数为13 个。从上述情况分析,中药新药研发的积极性正在逐渐恢复。
申请IND 的中药新药制剂的品种数受多种因素的影响。政策方面有:药品注册法规、国家医疗保险、国家基本药物、医疗改革、科技政策、产业政策等。技术方面有:中药新药研究相关技术指导原则、申报资料要求、中药新药相关基础研究、新药试验研究所需技术条件、新药相关研究的规范性要求,以及新思路、新方法、新技术、新设备带来的机遇与挑战等。市场方面有:相同适应症领域不同治疗手段的竞争、同类产品的市场竞争情况、医院控费、西医开中药的限制、招标采购、研发成本、研发周期、投资回报等。上述因素均可对中药新药的研发积极性产生影响。
3.2 审评结论
由于某年申请IND 中药新药制剂的审评结论一般会在后续若干年内陆续产生,而同一年内完成审评形成结论的品种主要是前几年申请的品种。故直接以当年批准或不批准的品种数除以当年申请品种总数得到的“当年批准率”或“当年不批准率”,难以准确反映申请品种的实际审批情况。如2008年申请IND 的品种数为74 个,但IND 审结品种数为301 个,按以上算法无法计算批准率。本文跟踪2005—2020年申请品种的最终审评结论,对每年申请品种中最终结论为批准及不批准的品种数进行分析,可以相对准确地反映出这15年中每年申请品种的批准与不批准的实际情况。审批结论可在一定程度上反映出新药临床前研究结束后,提出IND注册申请时的研究状况及后续补充资料是否符合相关指导原则要求的情况。
从批准率的走势看,整体上IND 品种的批准率呈上升的趋势。自2015年药品审评审批制度改革以来,中药新药IND 品种批准率显著上升,2017年批准率已经达到了82.14%。2019—2020年IND 品种的批准率高达100%,一定程度上反映出IND 申请改为默示许可带来的影响。当然,批准率的提高并不意味着中药研发水平的迅速提高或新药审评技术要求的降低。2017年10月,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42 号)[8]要求加强临床试验申请前及过程中与申请人的沟通交流,及时解决相关问题。此后,新药IND 申请前,要求申请人与CDE 进行沟通交流,如研究中存在严重缺陷,可以待充分研究后再正式提出注册申请。这样可能使某些中药新药IND 申请的时间相对滞后,但经过事先充分的沟通交流后再提出IND 申请的批准率大幅度提高。此外,中药新药的评价根据研发规律进行分阶段要求,对IND 批准率的提高也生产了积极的影响。
3.3 注册分类
从2005—2020年申请IND 中药新药制剂的注册分类看,6 类中药新药IND 申请的批准率为58.77%,相对较高。此类品种大多有一定的人用经验,研发者对于其临床定位、临床价值、药品的安全性及有效性有一定认识。5 类中药新药的批准率相对较低,为25.00%。此类品种的人用经验相对缺乏,临床前大多通过动物实验预测其安全性及有效性,从单一药材中提取质量分数大于50%的有效部位,在工艺及质量标准方面的难度也相对较高。从2005—2020年中药新药IND 注册申请的批准情况看,不同注册分类情形的批准率与中药的人用经验大致成正比。新的“中药注册分类及申报资料要求”中,中药按4 分类法。原来的新药材、新的药用部位、有效成分、有效部位、复方制剂等的注册分类均纳入创新药的范畴。上述不同人用经验背景与品种批准率的相关性可能将延续。此外,从注册分类看,2、3、4 类中药IND 申请的数量均较少。新药材、新药用部位及药材代用品的人用经验较少,研发风险及难度相对较大。
3.4 治疗领域
中药新药IND 申请的临床定位非常重要。对于拟研发中药新药,需要充分认识在现有医疗手段干预的背景下,研发新药的临床定位、临床价值、临床优势和特点。从不批准的新药IND 申请看,大多未充分考虑中药的临床优势或特点,临床定位不够清晰,临床价值不够明确。从2005—2020年不同适应症新药IND 申请的批准率看,用于肿瘤、内分泌等适应症的新药批准率较低。肿瘤中药新药的研发,应根据近年来中药新药治疗恶性肿瘤的临床优势与特点,以及现代医学治疗肿瘤的最新进展,明确拟研发新药在肿瘤治疗中的临床定位、具体适应症。如为肿瘤治疗用药,应以生存期延长和/或生活质量的改善作为主要疗效指标,同时以瘤灶缩小或持续稳定等为前提条件。生活质量需要严格定义,如仅以生活质量改善作为主要疗效指标,临床试验至少需要安慰剂对照。肿瘤治疗用药还应明确是否为单独使用中药治疗,或中药联合化疗、放疗、靶向药物等常规治疗增加其临床疗效,或为手术、化疗、放疗、靶向药物等常规治疗后的中药巩固治疗或维持治疗。如为肿瘤治疗辅助用药,应在不影响原有常规治疗方法(如手术、放疗、化疗等)疗效的前提下,预防和/或减轻肿瘤治疗所致的不良反应的。如为改善肿瘤症状用药应以改善肿瘤相关的主要症状为疗效指标,包括癌性疼痛、癌性发热、癌因性疲乏等。
3.5 处方来源
从本文的统计数据看,中药新药的处方来源为临床经验方、院内制剂、古方化裁、家族传承的IND批准率较高。有效部位、科研方、有效成分的批准率较低。前者往往已经在临床使用多年,积累了较丰富的人用经验,在临床适应症、适用人群选择,产品的临床优势和特点等方面有着较清晰的认识,也体现了中药新药研发路径为“临床-实验室-临床”的特点。后者一般缺乏人用经验,更接近于天然药物,其研发路径也是“实验室-实验室-临床”,与化学药相似。对于后者而言,在新药发现阶段需要进行较充分的基础研究,并进行系统的非临床安全性、有效性研究,由于缺少相关人用经验,此类药物的研发风险相对较高。
3.6 剂型分布
中药新药IND 申请最多的剂型是胶囊剂、颗粒剂、片剂,其中,颗粒剂批准率最高。颗粒剂具有载药量大、制备工艺简单等特点,是最适合于中药复方制剂的剂型之一。胶囊剂、片剂虽然具有服用、携带方便等优点,但因其载药量较小,要求在工艺过程中尽可能多地去除杂质,保留有效成分,工艺研究的难度相对较大。值得注意的是,90 个中药注射剂IND 申请中仅批准了8 个。与已上市中药注射剂的销售额较高,多年来居于我国医院用药(中药)排名前列的现状形成强烈反差。由于中药注射剂与中医传统给药途径的差距较大,临床风险较高,应遵循“能口服不注射,能肌注不静注”的原则,慎重开发中药注射剂。
3.7 地域分布
从中药新药IND 申请的地域分布看,2005—2020年申请数大于100 的有江苏、北京,这两地的优势是:整体科研力量较强、中医临床医疗水平较高,本土企业资本雄厚。申请数为50~100 个的有广东、四川、陕西、山东、上海、吉林,这些地区在药材资源、研发实力、医疗水平或产业基础等某些方面具有一定优势。在其他地区中,新疆近些年新药研发的数量上升较快,可能得益于地方政府的大力支持。中药新药的研发受到多方面因素的影响,其中,科研实力、产业基础、临床水平、政策支持、药材资源等都是重要的影响因素。
3.8 开展临床试验情况
以往未见对批准开展临床试验的中药新药后续是否开展临床试验进行过跟踪分析。从本文统计的结果看,2005—2020年获批开展临床试验的588个中药新药制剂中,在临床试验平台登记开展临床试验的有319 个品种,可追溯已完成临床试验申请新药上市许可的27 个品种。
已登记开展临床试验的319 个品种中,处于Ⅱ期临床试验的品种超过74.9%。已完成Ⅲ期临床试验的10 个,完成招募的4 个,这14 个品种有可能在近期申请NDA。此外,还有48 个已完成Ⅱ期临床试验或完成招募,30 个品种正在进行Ⅲ期临床试验研究,1 个品种在撤回后重新进行了Ⅲ期临床试验,这79 个新药有望成为今后几年中新的中药新药NDA 申请的主要来源。上述数据显示,在中共中央国务院《关于促进中医药传承创新发展的意见》[9]、国家药品监督管理局《关于鼓励中药传承创新发展的实施意见》[10]等利好政策的持续激励下,中药新药的研发积极性开始恢复。
已开展临床试验的品种中,有47 个品种处于Ⅱa、Ⅱb、Ⅱc 的临床试验中,对使用人群、剂量、疗程等临床方案相关内容进行探索。表现出新药研发者对新药Ⅱ期临床试验的重视程度有所提高,对临床试验规律的认识逐步加深,对探索性临床试验的风险意识有较大提升。
此外,Ⅱ期临床试验暂停5 个,Ⅲ期临床试验暂停2 个。虽然放弃或暂停临床试验的具体原因不明,但从一个侧面反映出新药研发的风险较高。如IND 结果显示其安全性或有效性不理想,及时止损也是明智的选择。
3.9 其他说明
本次统计的数据与以往文献报道的结果不尽相同,主要原因有:(1)品种数的处理原则不同。为避免原料药及多规格的干扰,本文按“一个受理号对应一个新药制剂”的原则,对原料药、同时申请的多规格受理号进行了删减;(2)统计数据的时间点不同。本文统计申请IND 的时间点以CDE 承办日期(申报资料进入CDE 的时间)计算。审结时间点为完成审评转送国家药品监督管理局的时间;(3)统计的申请人范围不同。本文统计的中药新药不包含国外进口植物药及按进口药管理的IND 申请;(4)批准率的统计口径不同。本文中的批准率为某年申请IND 的中药新药最终获得批准的品种数占该年份申请IND 的全部中药新药的百分比,与以往文献中批准率按当年批准IND 品种数占同年申请IND 品种总数的百分比不同。
4 小结与建议
本文对2005—2020年申请IND 的中药新药进行了较系统的分析,结果显示:(1)据不完全统计2005—2020年申请IND 的中药新药品种总数为1096 个,目前均已审结。(2)2005—2007年申请IND 的品种较多,2008—2015年相对稳定,2015年后申请数相对较少,2019年最低。(3)2005—2015年中药新药IND 申请的批准率相对稳定,2016年后明显提高。中药审评审批改革成效明显。(4)中药新药IND 申请以6 类最多,占81.66%,其批准率相对较高,为58.77%。而中药5 类的批准率仅为25.00%。(5)中药新药IND 申请的适应症相对集中,62%品种集中在呼吸、消化、精神神经、妇科、心血管。批准率大于60%的有呼吸、风湿免疫、肾脏病。批准率较低的治疗领域有肿瘤、内分泌等。(6)处方来源于临床经验方、有效部位、院内制剂、古方化裁的中药新药品种较多,占总数的74.08%。处方来源为具有人用经验的临床经验方、院内制剂、古方化裁、家族传承方的批准率较高,均大于60%。而有效部位、科研方的批准率相对较低,不高于40%。(7)中药新药IND 申请涉及的28 种剂型中,申报数量较多的前5 种为胶囊剂、颗粒剂、片剂、注射剂、丸剂,占IND 品种的85.31%。胶囊剂、颗粒剂、片剂、丸剂的批准品种数较多,约占批准IND 品种的82%。注射剂的批准率较低。(8)中药新药IND 申请品种的地域分布上,江苏、北京、广东居前3 名。(9)获得IND 批准的588 个中药新药制剂中,有319 个品种进行了临床试验登记,可追溯到27 个已申请NDA。
从本文统计的中药新药召开pre-IND 沟通交流会的品种数、IND 申请获批后开展临床试验的情况、2021年申请IND 的品种数分析,在国家鼓励中药传承创新的持续利好政策激励下,中药新药研发积极性有明显提高的迹象。中药新药的研发有望迎来新的良好发展时期,预计今后几年批准的中药新药数量可能会较前几年有所增加。
中药新药的研发应遵循中医药理论,尊重中药新药的研发规律和中药自身的特点。中药新药研发应以临床为导向,重视中药的临床价值及优势。从本文统计的情况看,具有较好人用经验的中药新药研发成功的比例较高,这也是中药新药研发路径“临床-实验室-临床”特点的体现。在新药研发的适应症选择上,建议重点关注中医优势病种和未被满足的临床需求,找准临床定位。
利益冲突所有作者均声明不存在利益冲突
