圆二色和拉曼光谱法分析Ⅰ型胶原蛋白二级结构及热变性
2021-06-24程红,王玲
程 红, 王 玲
(华中科技大学分析测试中心,武汉 430074)
0 引 言
Ⅰ型胶原蛋白是皮肤、肌腱、骨骼和其他结缔组织的主要结构成分,在生物医学中得到了广泛的应用。近年来,胶原蛋白已被用于止血海绵、真皮等效物、软组织增强注射材料、细胞制品基质和药物输送载体[1]。此外,胶原蛋白涉及许多病理学,其中成骨不全症、先天性结缔组织发育不全综合征和纤维化是最严重的。在所有这些疾病中,胶原蛋白构象的变化从展开到最终形成和纤颤是主要问题[2]。通过实验测定蛋白质二级结构,从而预测蛋白质构象可为理解其功能提供重要线索[3]。
研究蛋白质二级结构的常用实验方法是X-射线衍射和核磁共振波谱。这些技术的数据需要通过计算转换成原子结构,但如果蛋白质很难分离或结晶,则实验常常需要在电子结构预测中得到补充[4]。通常α-螺旋、β-折叠和非周期构象中的肽键部分可以通过高灵敏度的光学测量来估计,例如圆二色(CD)、红外(IR)和拉曼(Raman)光谱[5-7]。使用光谱测量来分析二级结构,是评估蛋白质聚集性和稳定性的一个有价值的工具。对于分子生物学中的许多重要问题,如蛋白质折叠、蛋白质-蛋白质相互作用和蛋白质-核酸相互作用,二级结构的定量测量提供了生物功能结构特征的重要线索[3]。光谱技术的优势是测试非常迅速,所需材料很少,而且可以很方便地考察温度变化带来的影响。CD是一种古老的光谱技术,在球形蛋白中研究的比较透彻,但在纤维状的胶原蛋白中二级结构呈现出一些特殊的特征,如PPII(P2)结构,还需要更全面地理解。IR和Raman同属于分子振动光谱,两者相比,后者不易受水峰干扰,可以更容易地检测出,主要反映在脂质、酰胺、脯氨酸和羟基脯氨酸区的任何构象变化[5],因此更适合胶原蛋白的二级结构研究[8]。本文采用CD和Raman两种光谱技术分别对同一种Ⅰ型胶原蛋白的溶液态和固态进行二级结构分析,并观察随温度变化,二级结构发生的改变(即热变性),旨在为胶原蛋白相关研究提供二级结构分析的实验参考和技术支撑。
1 仪器与试剂
1.1 仪器及试剂
日本Jasco公司J-810型圆二色光谱仪(配有Julabo F12水浴变温装置);Horiba Jobin Yvon公司HR-800型激光共焦拉曼光谱仪(配有Linkam 600型冷热台)。所有试剂均为分析纯;实验用水为超纯水(电阻率为18 MΩ·cm)。
1.2 样 品
固态Ⅰ型胶原蛋白:由武汉某生物材料有限公司提供的胶原蛋白海绵,批号:YF19070001,使用前未做任何处理。
溶液态Ⅰ型胶原蛋白:准确称取一定量的固态胶原蛋白溶于0.01 mol/L乙酸水溶液,配置成浓度为0.1 mg/ml的溶液,于4℃冰箱中放置2 d,使肽段充分折叠。
2 实验方法与结果分析
2.1 圆二色光谱分析
2.1.1 分析原理
基于对CD光谱的经验分析,有许多解卷积算法可用于测定蛋白质二级结构含量。这些方法都是利用已知晶体结构的蛋白质的CD谱数据集的信息,从CD谱中计算出感兴趣的蛋白质(查询蛋白)的结构。它们基于这样的假设:参考蛋白质(reference proteins)的结构在晶体状态和溶液中相同,并且单个二级结构对CD光谱的贡献是相加的,如下式[9]:
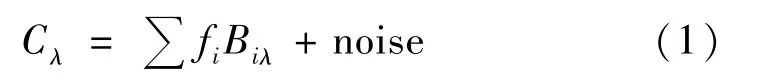
式中:Cλ指蛋白质的CD光谱,为波长的函数;fi是给定类型的二级结构的分数;Biλ是每种二级结构类型(螺旋、折叠、转角、无序等)在每个波长下的椭圆度;noise项中包括芳香族侧链的贡献。
随着计算机技术的发展,有一些算法的软件语言已经变得晦涩难懂,现在仍然可以下载或在线使用的算法包括SELCON3和CDSSTR,它们是基于奇异值分解(Singular Value Decomposition,SVD)方法和变量选择方法的算法,CONTINLL是使用脊回归和变量选择的修改版本,以及神经网络。所有这些算法都对光谱的大小敏感,因此精确的二级结构分析取决于有良好的校准数据、光谱中的宽波长覆盖,以及具有与查询蛋白类似的蛋白质结构特征的参考数据集[9]。
2.1.2 仪器的校准
单色仪的失调会使波长产生微小的偏移,表现为CD峰位的偏移,并对二级结构分析产生重大影响。本文使用有证书的氧化钬玻璃对波长进行校准。
此外,使用6 mg/mL的d-10-樟脑磺酸铵溶液对光谱强度进行校准,保证圆二色光谱仪处于良好的工作状态。
2.1.3 光谱的采集
CD测量是在相对稀释的蛋白质溶液(0.01~0.2 mg/mL)上进行,样品在感兴趣波长范围内的最大吸光度不得超过2[3]。稀溶液的优点是使样品的浓度依赖性聚集最小化。本次实验溶液样品浓度为0.1 mg/mL,使用同一个池长为0.1 cm的石英比色皿(Type:31/B/Q/1,Starna Scientific Ltd.Hainault,Essex IG6 3UT,United Kingdom)分别装载背景溶液和样品溶液进行测试。
为了防止光谱变形,仪器参数的设置也有推荐的经验选择[9],扫描速度×响应时间<带宽<光谱特征宽度/10。如要解析特征宽度为10 nm的光谱,需要小于1 nm的带宽;如果使用1 s响应时间,则扫描速度不应超过10 nm/min。
本文采用的测试参数为:扫描速度100 nm/min,响应时间0.5 s,带宽1 nm,累积次数3次。分别采集20、30、40、50、60、70℃下的样品溶液CD光谱图。得到的谱图经过扣除背景、平滑处理后见图1。
2.1.4 二级结构分析

图1 不同温度下胶原溶液的圆二色光谱图
蛋白质的二级结构是由一组二面角(φ,ψ)决定的,它定义了肽主链的空间方向,以及特殊氢键的存在。当主链二面角有重复值时,肽形成规则的二级结构[3]。胶原蛋白结构为3条平行的多肽链,以左旋、聚脯氨酸II型(P2)螺旋构象相互缠绕,1个残基交错形成右手三螺旋[10]。三螺旋结构中紧紧包裹着P2螺旋的要求每隔2个残基就出现1个Gly,这导致了1个重复的XaaYaaGly序列,其中胶原的Xaa和Yaa位置的氨基酸通常分别为(2S)-脯氨酸(Pro,28%)和(2S,4R)-4-羟脯氨酸(Hyp,38%)[10]。因此,胶原蛋白的二级结构中除了局部相邻氨基酸发生盘曲而形成螺旋、折叠、转角及无规则卷曲等二级结构以外,还有一个特殊的PPII(P2)螺旋结构。计算时会有一些特殊的要求,比如,按照文献[11]中介绍的在线计算二级结构的网站,本文选用DichroWeb(http://dichroweb.cryst.bbk.ac.uk/html/home.shtml)网站在线计算二级结构,将采集到的光谱数据输入网址进行数据分析,网站要求reference的设置只能是set5,并且数据的扫描范围为178~260 nm。选用CONTIN解卷积算法,按照要求输入后计算结果见表1。
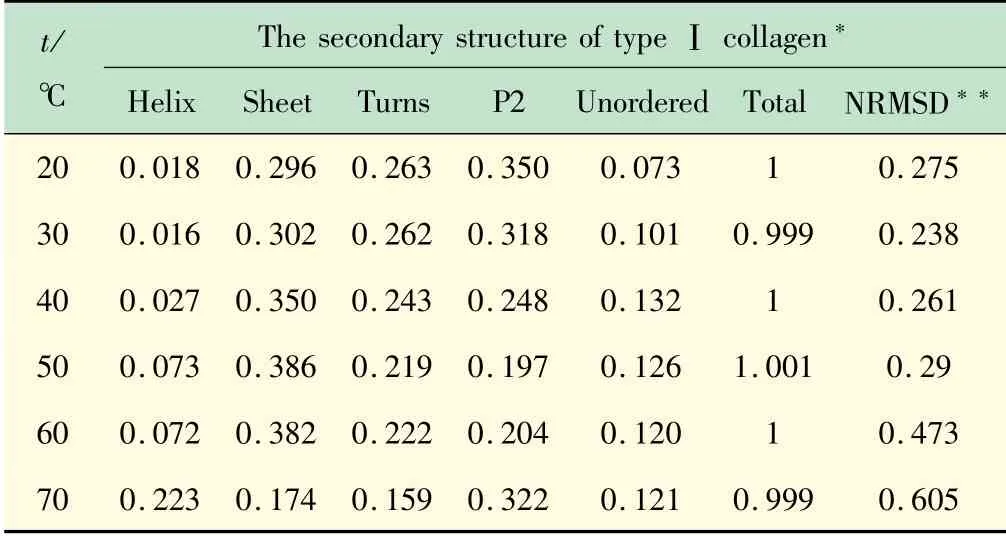
表1 不同温度下胶原溶液的二级结构计算结果
从表1的数据结合图1可以看出,在温度低于40℃时,P2结构随温度升高而降低,说明温度使胶原蛋白的三螺旋发生解旋,P2结构被逐步破坏;而当温度大于40℃后,α-螺旋结构随温度升高逐渐增加,这种构象的转变引起胶原功能的改变,造成胶原的变性[13]。
2.2 拉曼光谱分析
2.2.1 分析原理
拉曼光谱定义为入射光和散射光频率之间的差异,该频率差与键的类型及其振动类型有关。特征原子群会产生频率接近相同的振动带,而与它们所在的分子无关。在该范围内的精确波数取决于分子间和分子内的影响,包括肽键角度和氢键模式。拉曼光谱中酰胺Ⅰ带和Ⅲ带通常被用来归属蛋白的二级结构,参考具有α-螺旋或β-折叠结构的同型多肽和蛋白质的光谱、理论计算(正态模式分析)、合成肽和具有已知三维结构的蛋白质来确定特定频率与二级结构[3]。通过酰胺带相关拉曼光谱指标的变化,可以观察到从胶原的有序结构(即三螺旋结构)到由于内部(如老化和疾病)或外部(如热变性和机械变性)影响而导致向较不有序的结构形式的转变[7]。
2.2.2 仪器校准
由于每天的温度和湿度会有差别,导致峰位会有些差异,因此最好能在使用仪器前对峰位进行校正。峰位校正以单晶硅的一阶峰(520.7 cm-1)作为参考峰位进行。校正前,确保用于校正的激光器已打开,并且最少预热10 min,使激光器达到稳定状态。
2.2.3 光谱采集
在拉曼光谱实验中,为了获得最佳的拉曼信号,需要考虑每种激光波长的优缺点。散射的光子数与激光波长间接相关,拉曼线的强度与激光频率的4次方成正比[14]:

式中:l为拉曼线的强度;ν为激光源的频率。因此,当比较532 nm激光器和785 nm激光器时,

式中:c为光速;λ为激光源的波长。
可以看出,非共振条件下,532 nm激光产生的拉曼谱线强度比785 nm激光器产生的拉曼线强度强4.7倍。但是在样品有较强荧光干扰时,可以使用长波长的激光器如785 nm激光器和1 064 nm激光器来减少干扰。
本文采用生物样本中常用的Nd-YAG:532 nm激光源,光栅600 gr/mm,×50LWD物镜,200μm针孔,60 s曝光时间,将样品置于Linkam变温台的比色皿中采集不同温度下的光谱数据,得到的谱图见图2。
2.2.4 二级结构分析
拉曼光谱中,酰胺I和酰胺III带的频率可以检测二级结构的差异,该区域与碳氢伸缩振动区(即脂质区,lipids)、脯氨酸和羟脯氨酸区一起是胶原结构构象变化的3个主要区域[5],如图3所示(图示为温度20℃时固态胶原蛋白的拉曼光谱图),正是这些二级结构为胶原蛋白提供稳定性和纤维状结构。酰胺I带从1 700~1 600 cm-1,是肽链振动,主要来源于C=O伸缩振动(~80%)和C—N伸缩振动和N—H弯曲振动(~20%)。它产生一个非常强烈的信号,并且对蛋白质二级结构敏感;酰胺III带(~1 310~1 175 cm-1)主要与C—N伸缩振动和N—H弯曲振动(各约30%)、C—C伸缩(~20%)和C—H弯曲(~10%)有关[6]。尽管它的强度很低,大约比酰胺Ⅰ降低80%,但它对蛋白质的二级结构也非常敏感,而且不受吸水率的影响[6]。根据现有的文献,将指纹区峰值进行归属,与二级结构的对应关系见表2。
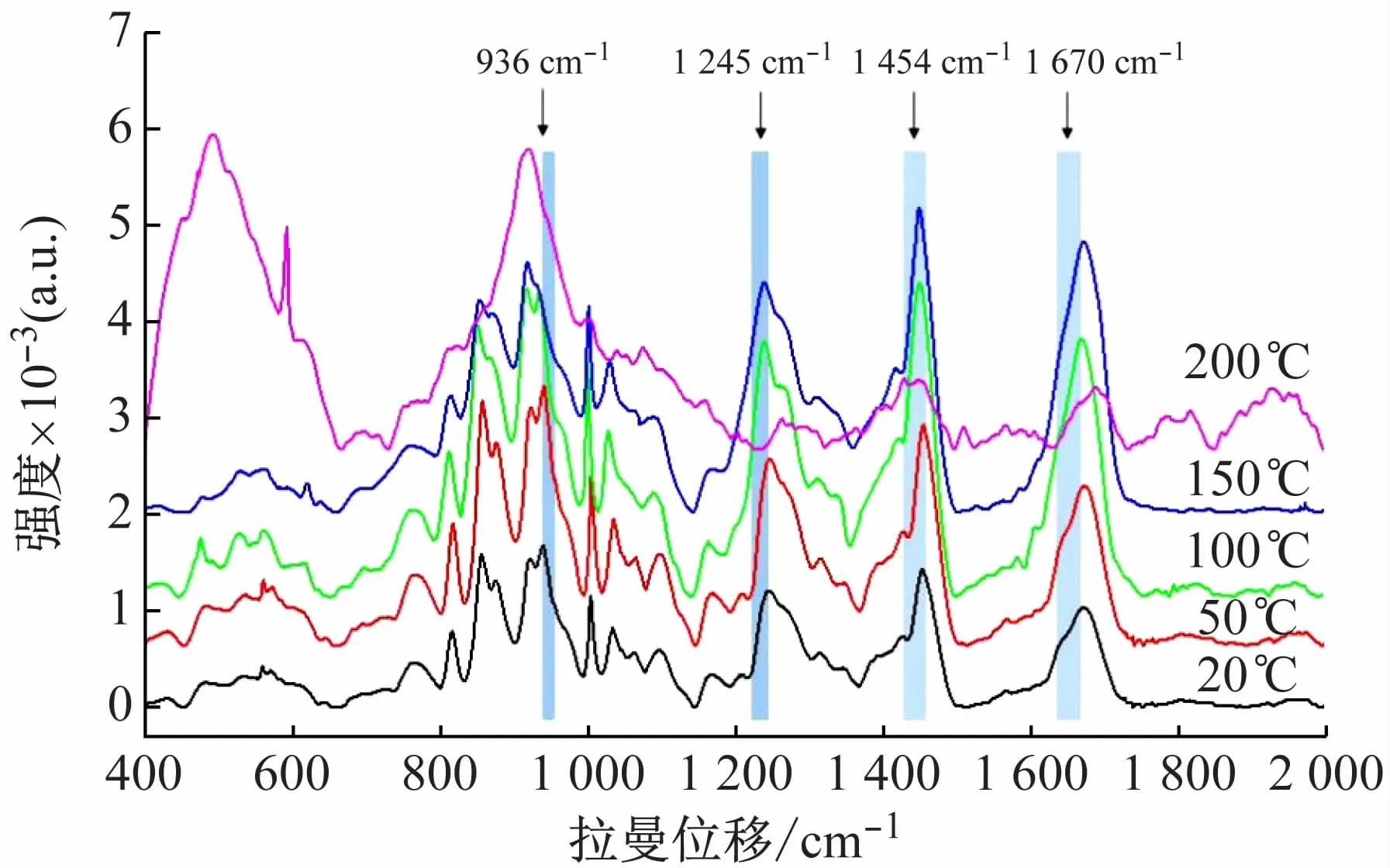
图2 固态胶原蛋白的变温拉曼光谱图
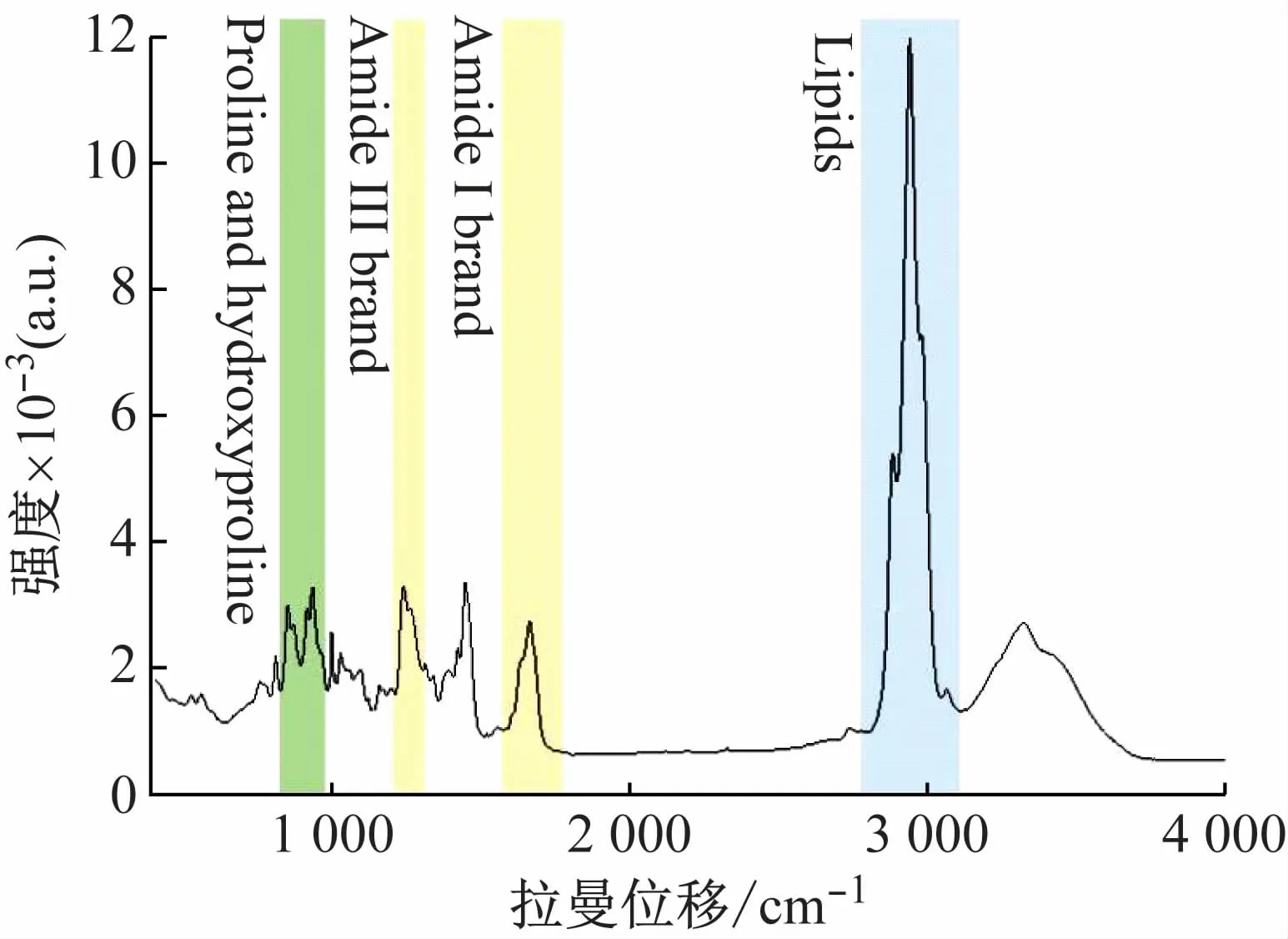
图3 反映构象变化的主峰所在3个主要光谱区域

表2 固态胶原蛋白的拉曼光谱指纹区的主要谱峰归属及其与二级结构的对应关系
结合图2和表2可以看出,蛋白质主链的C—C伸缩振动峰936 cm-1谱峰的强度随着温度升高而降低,至200℃时完全消失,这可能是因为随着温度的升高,分子和原子之间的距离也会增加,从而削弱氢键和范德华力,导致三螺旋结构的破坏[13]。根据反应二级结构中有序和无序结构对应谱峰的比例关系,可以判断胶原蛋白的变性与否,比如I1 670/1 640,I1 245/1 270,I1 245/1 454,其中I1 245/1 454逐渐减小,I1 670/1 640,I1 245/1 270逐渐升高,这些峰值强度比可以作为新的光谱生物标志物来评估胶原蛋白的质量和完整性[16-17]。变性过程中这些比值的变化可能反映出胶原二级结构的变化,特别是从有序结构到低有序结构的转变[17]。根据图2的数据,以最高峰的峰高为基峰进行归一化处理,得到这些光谱生物标志物随温度变化的值,列于表3。
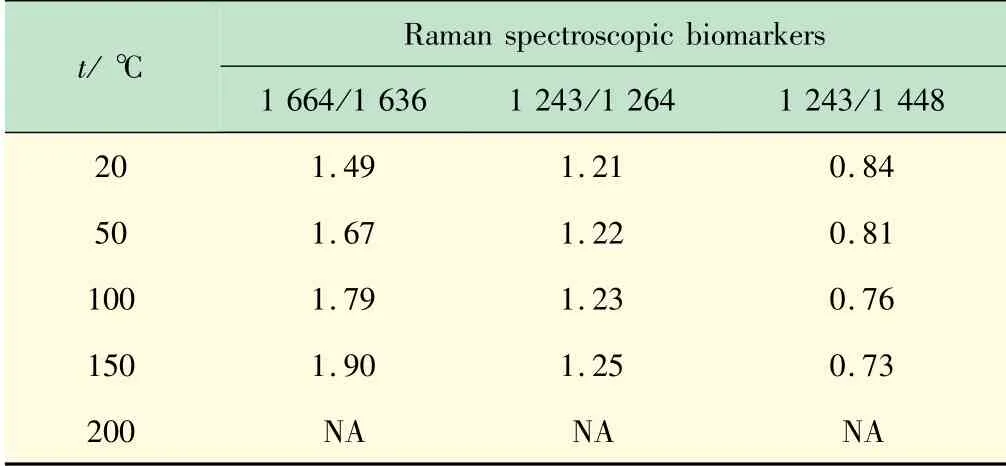
表3 本次实验中拉曼光谱生物标志物的强度比
从表3可以看出,固态胶原蛋白的三螺旋结构在200℃以内保持稳定,超过200℃后发生变性。肉眼可见白色的胶原蛋白海绵在200℃变性温度下开始发黄。该结果与差热分析(DSC,测试条件:在氮气气氛下,以5℃/min的升温速率从30℃升至250℃,所得谱图见图4,在80℃和220℃左右有吸收峰,第1个峰面积和宽度较大,是胶原蛋白海绵失水放热峰;第2个峰面积较小,是胶原蛋白海绵在热收缩过程中结构破坏所对应的晶区熔融峰)对应发生热变性的温度范围的结果基本吻合,说明使用拉曼光谱生物标志物来判断变性是科学可行的。
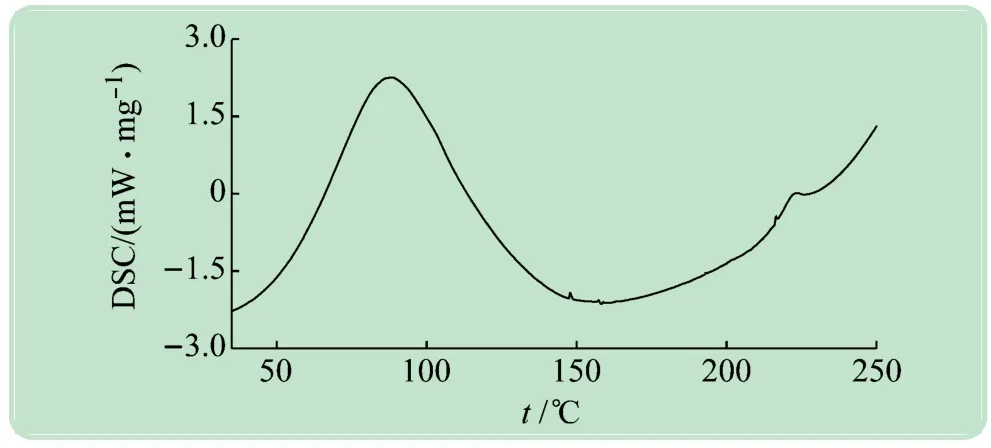
图4 固体胶原蛋白的DSC图
3 结 语
CD是一种广泛应用的分析蛋白二级结构的光谱技术,该技术可用于区分无序和有序结构。在球形蛋白,如牛血清白蛋白、溶菌酶和α-糜蛋白酶等蛋白中研究的比较透彻,而在纤维状的胶原蛋白中二级结构呈现出一些特殊的特征,还需要更全面的理解。Raman光谱分析胶原蛋白可以提供很多信息,并且随着理解的加深,它可以识别由于疾病或老化过程而导致胶原蛋白变化的化学途径,人们将了解到胶原是如何随着年龄、疾病和创伤而改变的。目前,拉曼光谱的潜力还没有被完全挖掘,虽然数据采集速度很快,但数据分析需要相当的技能和时间。因此,基于这两种光谱技术,本文对溶液态和固态的Ⅰ型胶原蛋白的二级结构进行分析,详细叙述了实验原理及实验过程,考察温度对于二级结构的影响,该工作可作为胶原蛋白相关研究的实验引导和示范。实验结果表明,Ⅰ型胶原蛋白溶液态的变性温度约为40℃,固态(又称胶原蛋白海绵)的变性温度约为200℃,固态比液态稳定,尤其是在室温范围内不会变性,这有利于其在临床上的推广应用。
