展示犬瘟热病毒抗原表位的犬细小病毒样颗粒构建
2021-06-24窦小龙马文戈苗书魁米晓云盛肖刚魏玉荣
窦小龙,马文戈,苗书魁,米晓云 ,盛肖刚 ,魏玉荣 *
(1青岛拜特尔生物科技有限公司,山东 青岛 266114)
(2新疆畜牧科学院兽医研究所,新疆 乌鲁木齐 830013)
(3新疆动物疫病研究重点实验室,新疆 乌鲁木齐 830013)
(4新疆维吾尔自治区动物卫生监督所,新疆 乌鲁木齐 830011)
犬瘟热病毒(canine distemper virus,CDV)感染引起的犬瘟热是一种急性、亚急性、高度接触性传染病,犬和肉食目中许多动物都可感染。犬细小病毒(canine parvovirus,CPV)是引起犬急性出血性胃肠炎和幼犬非化脓性心肌炎的重要病原,可促进肠道细菌易位,并引起严重的免疫抑制[1]。临床上两种病常常并发或继发感染,危害严重[2]。目前,对CDV及CPV防控主要是以弱毒疫苗免疫预防为主,虽然广泛应用的弱毒联苗具有保护力强等优点,但弱毒苗在使用过程中也存在弱毒株毒力返祖、与野毒基因重组加速病毒变异、对某些敏感性动物依然致病等诸多问题,需要开发新型疫苗来弥补这些不足。病毒样颗粒(virus-like particles,VLPs)可模拟病毒自身特有的结构但不能自我复制,确保了免疫原的安全性及免疫原性,具有良好开发前景[3-5]。
核衣壳蛋白VP2是CPV的主要保护性抗原[6],在体外表达后可以自我装配成VLPs[7]。已有研究证明VP2蛋白上某些氨基酸片段缺失或替代并不影响其在体外组装成VLPs[8],这使得VP2蛋白可作为外源抗原的载体形成VLPs制备多价抗原。CDV融合蛋白(F)是构成病毒囊膜的主要成分,在病毒感染和致病性方面起着重要作用。麻疹病毒属成员中CDV、麻疹病毒(measles virus,MV)和牛瘟病毒(rinderpest virus,PRV)群特异性表位主要在F蛋白上,是异型免疫的主要交叉抗原[9]。F蛋白的400-LSEVKGVIVHRLEAVS-415基序是重要的T细胞表位,能诱导CTL活性,516-INQSPDKLLTF-526基序是B细胞抗原表位。基于T细胞表位和B细胞表位的合成肽免疫小鼠后能对MV、CDV的攻击产生明显的保护反应[10]。本实验将CDV F蛋白的B细胞表位插入CPV VP2的氨基端,并用CDV F蛋白的T细胞表位替换CPV VP2蛋白loop 2区域的218-LIPSHTGTS⁃GTPTNIY-233氨基酸序列,人工合成编码该融合蛋白的核苷酸序列,并克隆到pET-28a(+)载体上,转化BL21(DE3),表达的重组蛋白能组装成VLPs,且具有良好的免疫原性。本实验为重组CDV和CPV新型亚单位疫苗的研究提供了新的探索途径。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞、表达载体及实验动物
感受态JM109、BL21(DE3)及表达载体pET-28a(+)均由新疆畜牧科学院兽医研究所病毒研究室保存。BALB/c小鼠购自新疆医科大学实验动物中心。
1.1.2 主要试剂
限制性内切酶BamH I、XhoI,T4 DNA Poly⁃merase,Prestained Protein Ladder购自 Thermo Fisher Scientific;DL15 000DNA Marker购自TakaRa;质粒小提试剂盒(Plasmid Miniprep Kit)购自爱思进生物技术(杭州有限公司);兔抗犬IgG(Anti-Dog IgG-Perox⁃idase antibody produced in rabbit)购自SIGMA。206佐剂由新疆畜牧科学院兽医研究所病毒研究室保存。
1.2 方法
1.2.1 FB-FT-VP2基因合成及表达质粒的构建
参考CPV VP2蛋白(GenBank ID:ACS50333.1)和CDV F蛋白(GenBank ID:AAK54668.1)序列,选择CDV F蛋白的B细胞表位516-INQSPDKLLTF-526氨基酸序列融合到CPV VP2蛋白的氨基端,并用CDV F蛋白上的T细胞表位400-LSEVKGVIVHRLEAVS-415氨基酸序列替换CPV VP2蛋白loop 2区域的218-LIPSHTGTS GTPTNIY-233氨基酸序列,融合蛋白氨基酸序列如图1。委托生工生物工程(上海)股份有限公司合成编码该融合蛋白的核苷酸序列,并克隆到pET-28a(+)载体上,命名为pET-28a-FBFT-VP2。

图1 FB-FT-VP2融合蛋白氨基酸序列
1.2.2 融合蛋白的表达
重组质粒pET-28a-FB-FT-VP2经酶切、测序鉴定正确后转化BL21(DE3)感受态细胞,涂布含50 μg/mL硫酸卡那霉素LB平板,筛选阳性克隆菌株命名为BL21-pET-28a-FB-FT-VP2。接种含50 μg/mL硫酸卡那霉素的LB培养液,37℃,250 r/min摇床培养至OD600nm为0.6~0.8。加入100 mmol/L的IPTG至终浓度为1 mmol/L,37℃再培养3 h。
1.2.3 融合蛋白SDS-PAGE及Western-blot检测
取200 μL菌液12 000 r/min离心5 min,沉淀用10 μL PBS重悬,加入2×SDS上样缓冲液10 μL,经沸水浴处理10 min后取10 μL进行SDS-PAGE电泳及Western-blot检测。Western-blot检测时脱脂乳封闭1 h。一抗是CPV阳性血清,37℃孵育1 h。PBS洗涤后加辣根过氧化物酶标记的兔抗犬IgG为二抗,37℃孵育1 h。PBS洗涤后用DAB显色液显色。
1.2.4 融合蛋白的包涵体变性、复性及内毒素去除
菌体超声破碎、离心取沉淀,加入沉淀重量10倍体积含1% Triton X-114的20 mmol Tris-HCl(pH7.4)缓冲液充分悬浮,室温静止5 min,12 000 r/min离心5 min,收集沉淀。重复2~3次以充分去除内毒素。按每克原菌体湿重加入6 mol/L尿素溶液2 mL重悬,室温下作用1 h变性。将变性蛋白液缓缓加入10倍体积的20 mmol Tris-HCl缓冲液(pH8.0)中,混匀后4℃静止过夜。12 000 r/min离心5 min收取上清即为复性的FB-FT-VP2融合蛋白。
1.2.5 重组VLPs的透射电镜检测
取 FB-FT-VP2融合蛋白液 1 mL,加入 10 μL CPV阳性血清,37℃作用30 min,迅速放置4℃平衡1 h。4℃条件下12 000 r/min离心30 min,弃上清液900 μL,留100 μL上清溶解沉淀作为电镜样品,4 ℃条件下送新疆大学理化测试中心电镜室,醋酸铀负染色,于H-600透射电镜下观察VLPs组装情况。
1.2.6 融合蛋白的血凝效价测定
96孔微量板从第1孔至12孔,每孔加PBS 25 μL。FB-FT-VP2融合蛋白液25 μL,从第1孔起,依次做2倍系列稀释,至最后1个孔,弃去25 μL液体。每孔加入0.5%豚鼠红细胞悬液25 μL,并设不加样品的红细胞对照孔,在微量板振荡器上摇匀,置室温1 h,当对照孔中的红细胞呈显著纽扣状时判定结果。以使红细胞完全凝集的最高稀释度作为判定终点。
1.2.7 融合蛋白免疫效果检测
1.2.7.1 亚单位疫苗配制
取FB-FT-VP2融合蛋白液用生理盐水稀释至蛋白浓度为200 μg/mL,与206佐剂1∶1混合乳化。
1.2.7.2 BALB/c小鼠免疫
7周龄雌性BALB/c小鼠随机分成2组,每组10只,第一组为试验组,腹腔注射FB-FT-VP2亚单位疫苗0.1 mL/只(10 μg FB-FT-VP2蛋白),第二组为对照组注射生理盐水0.1 mL/只。免疫后第21天小鼠尾静脉采血分离血清。
1.2.7.3 CDV中和抗体检测
将免疫小鼠血清用不含牛血清的细胞维持液从1∶16作倍比稀释至1∶128,取 4个稀释度分别与200 TCID50/0.1 mL的CDV毒液等量混合,另取200 TCID50/0.1 mL的病毒液加入等体积细胞维持液作为病毒对照,置37℃作用1 h,接种Vero细胞单层96孔培养板,每个稀释度8孔,每孔0.1 mL,同时设对照细胞8孔(只加维持液)。接种后,置5%二氧化碳、37℃条件下培养5 d,观察CPE,病毒对照细胞孔均应出现CPE,细胞对照孔无CPE,按Reed-Muench法计算血清中和抗体效价。
1.2.7.4 CPV中和抗体检测
小鼠免疫血清CPV中和抗体检测方法同
1.2.7.3,所用细胞为F81。
2 结果
2.1 FB-FT-VP2基因合成及表达质粒的鉴定
合成FB-FT-VP2基因共1 788 bp,并将该片段克隆到pET-28a(+)载体上构建pET-28a-FB-FTVP2质粒,经BamHI、XhoI双酶切鉴定,酶切得到的目的片段为1 788 bp,见图2。
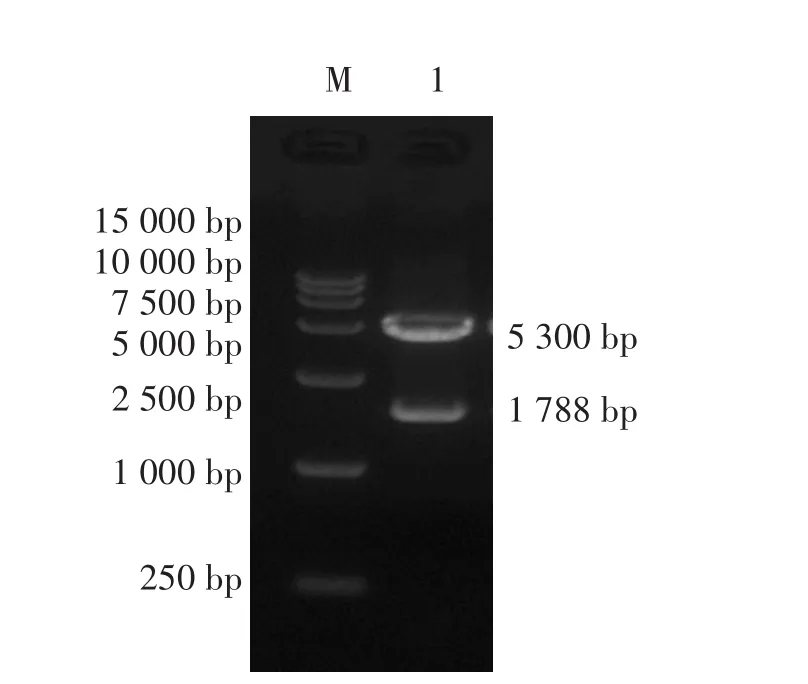
图2 pET-28a-FB-FT-VP2的酶切鉴定
2.2 融合蛋白的表达
以BL21(DE3)未转化菌体蛋白做阴性对照,SDS-PAGE电泳,Western-blot检测pET-28a-FBFT-VP2转化菌表达融合蛋白情况。考马斯亮蓝染色,在66 KDa左右出现特异性条带,见图3。用CPV阳性血清作一抗,用辣根过氧化物酶标记的兔抗犬抗体作二抗对表达产物进行Western-blot,经DAB显色液显色,在66 KDa左右出现特异性条带,见图4。结果表明FB-FT-VP2融合蛋白与CPV阳性血清可特异性结合。

图3 FB-FT-VP2融合蛋白的SDS-PAGE检测

图4 FB-FT-VP2融合蛋白的Western-blot检测
2.3 VLP的透射电镜检测
透射电镜检测显示,能观察到直径约22 nm大小的VLPs,见图5。
2.4 融合蛋白的血凝效价测定
FB-FT-VP2融合蛋白液对0.5%豚鼠红细胞悬液的凝集价为1∶1 024,对照孔中的红细胞无血凝,呈显著纽扣状,见图6。
图6 FB-FT-VP2融合蛋白的血凝效价测定
2.5 融合蛋白免疫效果检测
7周龄雌性BALB/c小鼠腹腔注射FB-FT-VP2亚单位疫苗0.1 mL/只(10 μg FB-FT-VP2蛋白),免疫后第21天尾静脉采血分离血清。免疫组CDV中和抗体 1∶32(4/10)至 1∶64(6/10);CPV 中和抗体 1∶64(10/10)。对照组均未检测到中和抗体。免疫小鼠血清中和后病毒接种细胞与细胞对照相比,细胞无明显变化,形态基本完整;接种病毒的细胞病变明显,成团、聚集或脱落。可见免疫小鼠血清中含有效中和抗体,见图7。

图7 免疫小鼠血清病毒中和实验
3 讨论
利用VLPs展示外源病原的抗原表位,将外源表位正确折叠且充分暴露于VLPs表面更易于表位与B细胞受体结合,从而诱导高滴度的抗体水平。由于组装的VLPs能模拟病毒结构,可使VLPs疫苗达到与全病毒相近的免疫效果。CPV疫苗能刺激有效的免疫保护[11-12]。随着CPV衣壳结构的解析,基于VP2蛋白亚单位疫苗的研究不断深入。研究者在CPV VLPs制备方面进行了大量研究,借助原核、真核、杆状病毒及家蚕表达系统表达的CPV的VP2蛋白均可以自组装成VLPs,重组的VP2 VLPs疫苗,能够刺激较高的抗体滴度从而保护试验动物抵抗CPV病毒攻击[13-16]。CPV VP2蛋白组装成的VLPs能模拟完整蛋白结构,比单独的表位疫苗免疫原性好,能够诱导高水平的体液免疫和细胞免疫。探索在不破坏VP2上自身抗原表位的同时将外源表位正确展示在VLPs表面的多价抗原,免疫动物可以获得同时抵御CPV及外源病原攻击的保护,可达到一针多防的效果。
本实验将CDV F蛋白的B细胞表位插入CPV VP2的氨基端,用CDV F蛋白的T细胞表位替换CPV VP2蛋白loop 2区域的218-LIPSHTGTSGTPTNIY-233氨基酸序列,人工合成编码该融合蛋白的核苷酸序列,并克隆到pET-28a(+)载体上,转化BL21(DE3)感受态,成功表达了FB-FT-VP2融合蛋白。表达的重组蛋白纯化后能体外组装成VLPs,透射电镜可以观测到约22 nm大小VLPs结构,与天然的CPV粒子大小接近。FB-FT-VP2融合蛋白组成的VLPs具有与天然CPV粒子相似的血凝特性。Western-blot结果证实,该重组融合蛋白具有良好的反应原性。免疫BALB/c小鼠能刺激产生针对于CPV和CDV的中和抗体。本实验为重组CDV和CPV新型亚单位疫苗的研究提供了新的探索途径,为犬的多价亚单位疫苗研究奠定了一定的基础。
4 结论
大肠杆菌表达系统表达的含CDVF基因B、T细胞抗原表位重组CPV VP2蛋白可自我组装成VLPs,并具有血凝活性,可产生刺激机体中和抗体。基于体外中和实验,构建的双价疫苗有望可同时预防犬细小病毒病和犬瘟热。
