永生化绵羊瘤胃成纤维细胞系的建立
2021-06-23赵霏霏辛雅明杨银凤
赵霏霏,杨 丹,辛雅明,杨银凤
(1. 内蒙古农业大学兽医学院, 内蒙古 呼和浩特 010018;2. 内蒙古自治区兽医学重点实验室, 内蒙古 呼和浩特010018)
传代细胞系是开展基础研究和动物病毒研究的基础, 许多与动物病毒相关的研究由于缺乏特定种属的稳定细胞系受限制, 绵羊源的细胞系尤其缺乏, 严重阻碍了绵羊病毒的生物学研究和疫苗的开发。 成纤维细胞是结缔组织中最主要的细胞,在动物体内分布广泛,体外培养条件相对简单,生长速度快,培养成本低,遗传信息稳定[1]。 但正常的原代细胞经过多次分裂会出现细胞衰老的现象[2],因此,需要建立生理状态正常并且可以长期传代的永生化细胞系用于试验研究。 目前已知能使细胞永生化的方法有很多种, 常用的方法有将SV40、HPV、EB 等病毒转染细胞, 建立永生化细胞系[3],此外,还可以将原癌基因导入细胞或利用放射性因素、 化学药物的刺激建立永生化细胞系, 这些方法建立的细胞系往往会出现细胞形态改变、 核型改变或失去接触性抑制, 成为转化细胞。 近年来报道最多的是将人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)转入细胞使其永生化,hTERT 永生化细胞具有原代细胞的原始特性及传代细胞无限增殖的能力[4]。
端粒是位于真核细胞染色体末端的特殊结构,由一段特殊的DNA 重复序列和相关的蛋白质组成,可保护DNA 不被降解[5]。 正常体细胞随细胞分裂次数的增加端粒逐渐缩短, 端粒缩短到一定程度时细胞就会停止分裂增殖, 激活端粒酶可延长端粒。 端粒酶逆转录酶 (telomerase reverse transcriptase,TERT)能激活端粒酶、延长端粒,使体外培养的细胞永生化[6]。 目前将hTERT 转染到细胞基因组建立的永生化细胞系有山羊子宫内膜上皮细胞系[7]、猪小肠上皮细胞系[8]、人软骨细胞[9]、牛 乳 腺 上 皮 细 胞 系[10]、绵 羊 附 睾 上 皮 细 胞系[11]等多种永生化细胞系,但未见永生化绵羊瘤胃成纤维细胞系的报道。
该试验通过PEI 介导pCI-neo-hTERT 质粒转染绵羊瘤胃成纤维细胞建立永生化绵羊瘤胃成纤维细胞系, 旨在为绵羊源病毒致病机理和疫苗的研究提供体外永生化细胞模型。
1 材料与方法
1.1 试验材料
取屠宰场健康的绵羊瘤胃组织。
1.2 主要仪器及试剂
CO2培养箱(Thermo)、显微成像系统(CKX41,Olympus)、蔡司共聚焦显微镜(LSM 800,Zeiss)、多功能酶标仪(SynergyTMH4,BioTek)、基础电泳仪电源(Bio-Rad)、小型转印槽(Bio-Rad)、垂直电泳仪(Bio-Rad)、细胞冻存盒、反转录试剂盒(TaKaRa)、总RNA 提取试剂盒 (Axygen Scientific)、Premix TaqTM(TaKaRa)、DMEM/F12 培养基(Gibco)、胎牛血清(杭州四季青生物工程材料有限公司)、0.25%胰蛋白酶-EDTA 消化液(北京索莱宝科技有限公司)、G418 (北京索莱宝科技有限公司)、Anti-Telomerase reverse transcriptase 抗体 [Y182](Abcam)、HRP-conjugated anti-rabbit secondary (北京博奥森生物技术有限公司);pCI-neo-hTERT 质粒由内蒙古农业大学刘淑英教授惠赠; 其余试剂均为实验室常规试剂。
1.3 绵羊瘤胃成纤维细胞(ORFCs)的分离培养
原代绵羊瘤胃成纤维细胞采用组织块贴壁法培养: 将新鲜的瘤胃组织用生理盐水反复冲洗干净,置于含5 倍双抗、5 倍庆大霉素、5 倍两性霉素B 的PBS 中浸泡1 h; 将组织带入超净工作台,剪成1 mm3大小的组织块,放入50 mL 离心管,加入组织块两倍体积的胰蛋白酶,放入37 ℃温箱消化30 min(隔10 min 摇晃1 次离心管,使胰蛋白酶与组织块充分混合),用200 目细胞筛分离消化液与组织; 将组织块均匀铺在25 cm2的细胞培养瓶底部, 将细胞培养瓶倒置后加入4 mL 完全培养基(含10%FBS、1%PS 的DMEM/F12),倒置细胞培养瓶于37 ℃、5%CO2、 饱和湿度为40%的培养箱中静置培养4 h;4 h 后翻转细胞培养瓶, 继续培养。 待ORFCs 从贴壁的组织块中爬出并生长,细胞汇合度达到80%以上进行ORFCs 的传代培养。
1.4 G418 最佳筛选浓度的确定
将绵羊瘤胃成纤维细胞接种于24 孔细胞培养板, 加入1 mL 含有不同浓度G418 的筛选培养基 (G418 浓度为100~1 100 μg/mL, 共11 个梯度),同时设1 个阴性对照(不加G418),每个梯度设置4 个重复。 2 周后在显微镜下观察细胞生长状况,能杀死所有细胞的最低G418 浓度即为最佳筛选浓度,确定G418 最佳筛选浓度为500 μg/mL。
1.5 绵羊瘤胃成纤维细胞的转染
将绵羊瘤胃成纤维细胞接种于6 孔板中,用含10%FBS 的DMEM/F12 培养基培养,待瓶底细胞汇合度达到60%~70%时,用转染试剂PEI 介导pCI-neo-hTERT 质粒转染绵羊瘤胃成纤维细胞,同时以未转染的细胞作为对照。 48 h 后弃掉原培养基,用含有最佳筛选浓度的G418 筛选培养基进行筛选;待对照组细胞全部死亡后,将筛选培养基的G418 浓度减半,继续培养;直到出现阳性克隆细胞, 用纸片消化法分离阳性克隆细胞并扩大培养, 筛选出来的阳性克隆细胞命名为hTERTOvine Ruminal Fibroblasts Cells (hTERT-ORFCs)。
1.6 ORFCs 和hTERT-ORFCs 生长曲线的绘制
将培养到第3 代(F3)的原代ORFCs 和第35代(F35)的hTERT-ORFCs 弃掉培养基,用PBS 清洗3 遍后, 将贴壁生长的ORFCs 用胰酶消化下来。 调整细胞数量,以每孔1×104个的量分别接种于24 孔板。 放入二氧化碳细胞培养箱培养24 h,细胞贴壁后开始细胞计数,每24 h 利用血球计数板进行一次细胞计数, 每次对试验组和对照组的3 孔细胞进行计数,取3 孔细胞的平均值,持续计数7 d。 根据7 d 的计数结果, 利用Graphpad Prism 7.0 软件,以天数为横坐标、细胞数为纵坐标绘制细胞生长曲线。
1.7 hTERT-ORFCs 外源hTERT 基因的检测
按照总RNA 提取试剂盒(Axygen)的说明书同 时 提 取Hela、ORFCs 和hTERT-ORFCs 的 总RNA;按照去基因组DNA 的反转录试剂盒(TaRa-Ka)的说明书进行反转录, 得到的cDNA 于-20 ℃条件保存备用。 以上述cDNA 为模板,参考刘腾等[12]的文献设计特异性引物(见表1),PCR 反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35 个循环,72 ℃延伸10 min,4 ℃终止反应,进行3%琼脂糖凝胶电泳。

表1 目的基因大小及引物序列
1.8 hTERT-ORFCs hTERT 蛋白表达的检测
使用生工生物工程(上海)股份有限公司的动物细胞全蛋白提取试剂盒提取hTERT-ORFCs 第15 代(F15)、第35 代(F35)的细胞全蛋白,同时提取HeLa 和ORFCs 细胞的全蛋白分别作为阳性、阴性对照, 采用Western Blot 方法检测hTERT 蛋白表达的情况。
2 结果
2.1 原代ORFCs 的分离培养结果
原代ORFCs 分离培养结果如图1 所示。 原代ORFCs 培养3 d, 可见ORFCs 均匀地从组织块四周爬出,贴壁生长状态良好,细胞形态为梭形,呈放射状生长, 细胞核呈卵圆形 (见图1A)。 原代ORFCs 培养5 d,细胞大面积生长且均匀分布(见图1B)。 原代ORFCs 培养6 d,细胞生长汇合度达到80%以上,贴壁生长,生长状态良好,无细胞老化现象(见图1C)。
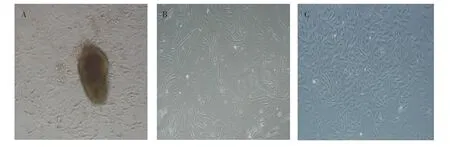
图1 原代ORFCs 分离培养结果
2.2 G418 筛选阳性克隆细胞
将培养好的F3代ORFCs 接种到6 孔细胞培养板中,细胞汇合度达到50%~70%后,转染pCIneo-hTERT 质粒。48 h 后用500 μg/mL 的G418 筛选培养基筛选阳性克隆细胞, 筛选结果如图2 所示。 筛选第2 天,未成功转染pCI-neo-hTERT 质粒的细胞大量死亡(见图2A)。在G418 的筛选下,筛选出较耐受ORFCs(见图2B、图2C)。 当对照组ORFCs (未转染pCI-neo-hTERT 质粒的ORFCs)全部死亡后,将G418 选择培养基的G418 含量减半维持筛选,阳性克隆细胞生长良好,细胞汇合度逐渐增大(见图2D、图2E)。 筛选14 d 后,出现大片生长的阳性克隆细胞(见图2F),此时用纸片法分离并扩大培养。

图2 ORFCs 阳性克隆筛选结果
2.3 ORFCs 和hTERT-ORFCs 生长曲线
F3代ORFCs 和F35代hTERT-ORFCs 的 生 长曲线如图3 所示,hTERT-ORFCs 在第2 天进入对数生长期,ORFCs 在第4 天进入平台期,hTERTORFCs 在 第5 天 进 入 平 台 期。 相 比ORFCs,hTERT-ORFCs 生长更活跃,细胞对数期持续时间更长,增殖能力更强。
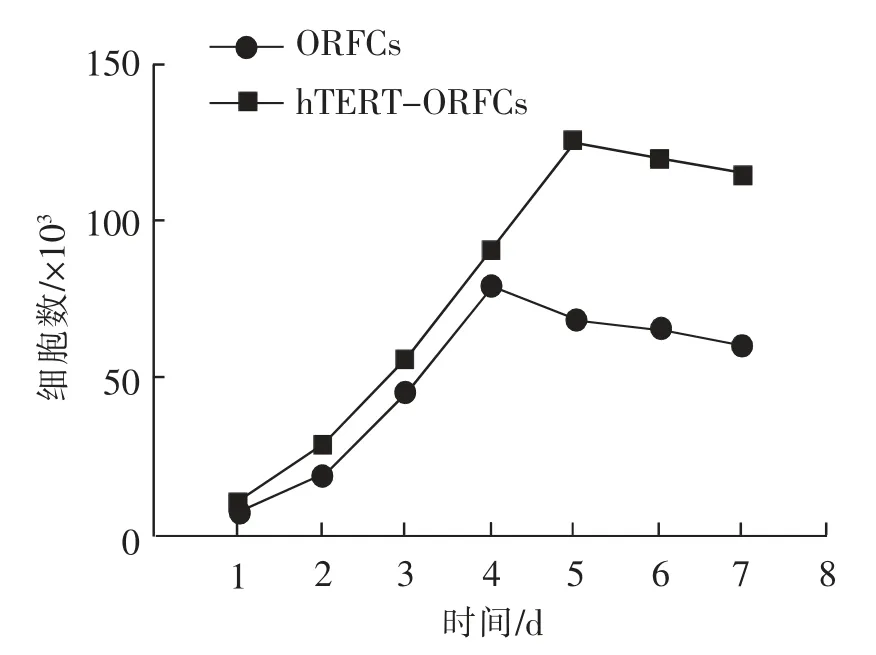
图3 ORFCs 和hTERT-ORFCs 细胞生长曲线
2.4 hTERT-ORFCs 与ORFCs 的细胞形态
将pCI-neo-hTERT 质粒转染ORFCs, 经过G418 筛选后的阳性克隆细胞与原代细胞相比,细胞形态未发生明显改变,为长梭形,具有典型的成纤维细胞特征,如图4 所示。
2.5 hTERT-ORFCs 外源hTERT 基因的检测
通过RT-PCR 方法检测hTERT-ORFCs 外源hTERT 基因的表达情况, 试验结果如图5 所示,Hela 细胞作为阳性对照,未转染的ORFCs 为阴性对照,Hela 细胞、F15代和F35代hTERT-ORFCs 在214 bp 处有清晰的单一的特异性条带, 条带大小与目的片段大小相符, 说明hTERT 基因成功在ORFCs 中表达。
2.6 hTERT-ORFCs hTERT 蛋白表达的检测
利用生工生物工程(上海)股份有限公司的动物细胞全蛋白提取试剂盒, 提取hTERT-ORFCs蛋白。 提出蛋白后利用BCA 蛋白浓度测定试剂盒和酶标仪测算在562 nm 处的蛋白OD 值。 以蛋白标准品的浓度作为横坐标,OD 值作为纵坐标,绘制标准曲线。根据标准曲线计算目的蛋白的浓度,从而确定上样量。Hela 细胞设为阳性对照,ORFCs设为阴性对照,F15代和F35代hTERT-ORFCs 为试验组,进行Western Blot 检测,结果如图6 所示。由图6 可知, 以人源端粒酶逆转录酶作为一抗,βacting 作为内参蛋白,F15代和F35代hTERT-ORFCs 的目的蛋白均有表达。
3 讨论
成纤维细胞自身的生物学特性是可以多向分化、持续增殖,可以分化为多种细胞,在伤口修复、骨折痊愈和胶原细胞的再生等方面具有重要作用[13]。此外,在保护珍稀野生动物种质资源方面也有广阔的前景, 另一方面成纤维细胞也是常用的研究机体功能和疾病的重要种子细胞。
正常的体细胞在体外培养分裂一定的次数后,进入衰老期,逐渐停止分裂。 细胞的永生化是指细胞经过自身或受外界条件刺激而逃避了增殖衰老乃至凋亡,从而具有了无限增殖的能力。细胞永生化的常用的方法有慢病毒感染法、 端粒酶法等。采用病毒感染法建立的永生化细胞系,往往会出现细胞形态改变、细胞核型发生变化、具有致瘤性等问题。 而TERT 介导的永生化细胞系是正常细胞,具有正常的核型、正常的生长速率[14]。 利用细胞内hTERT 基因的过表达建立的细胞系既具有原代细胞的性状又具有连续培养的特性, 具有良好的应用价值。F15代和F35代hTERT-ORFCs 的hTERT 基因和蛋白表达结果表明,成功将hTERT基因稳定地整合到了hTERT-ORFCs 的基因组中, 并能表达相应蛋白。 显微镜下对比hTERTORFCs 与ORFCs 细胞的形态发现,hTERT-ORFCs 未发生明显改变, 通过分析ORFCs 和hTERT-ORFCs 的生长曲线发现hTERT-ORFCs的增殖能力明显高于ORFCs。

图4 ORFCs 和hTERT-ORFCs 细胞形态
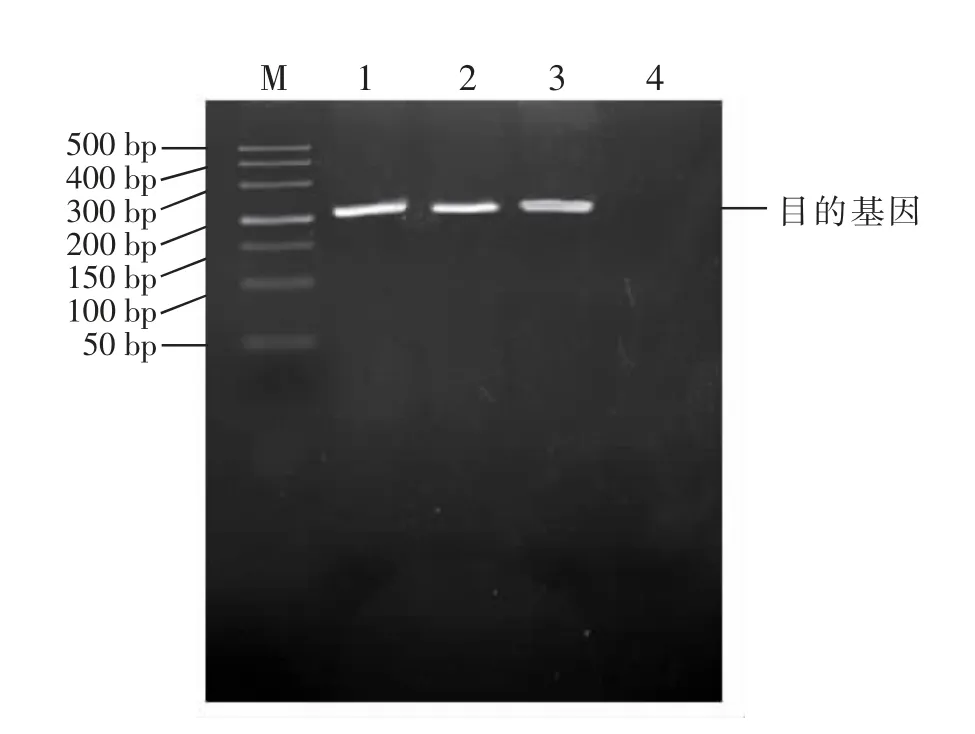
图5 目的基因hTERT 的RT-PCR产物琼脂糖凝胶电泳结果
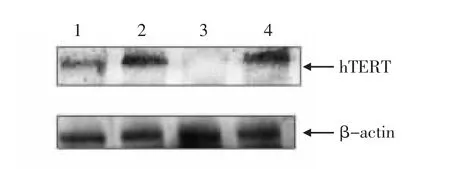
图6 Western Blot 检测hTERT-ORFCs 中的hTERT 蛋白
该试验采用pCI-neo-hTERT 质粒转染ORFCs,得到阳性克隆细胞。 细胞生长曲线、RT-PCR和Western Blot 的结果显示, 外源基因hTERT 在ORFCs 稳定表达并且细胞增殖活力明显增加。 该试验成功建立了永生化绵羊瘤胃成纤维细胞系,减少了每次试验需培养原代ORFCs 的时间和成本,为需要以ORFCs 作为基础细胞系和重要组织工程优质种子细胞的各项试验研究提供便利。
