硝酸胍热分解特性及其动力学分析
2021-06-23陈东梁张东胜何向向王玉丰
杨 冉 陈东梁* 张东胜* 何向向 王玉丰
(1.北京化工大学 机电工程学院, 北京 100029; 2.常熟理工学院 材料工程学院, 常熟 215500)
引 言
硝酸胍(GN)是一种新型的精细化工产品,外观多为白色结晶粉末或颗粒,是医药、农药、染料、炸药等化工原料的重要中间体[1],同时也是汽车安全气囊的新型气体发生剂,其广泛应用于医药合成、消毒剂、油漆工业、火箭推进剂等众多领域。
硝酸胍因具有强氧化性,被认定属于危险品5.1范畴[2],遇明火、摩擦、碰撞、打击等可发生爆炸,高温下易发生分解、燃烧和爆炸,生成有毒的氮氧化物等物质。硝酸胍的分子式为CH6N4O3,含有硝基活性基团,性质极不稳定,可以在不需要外界氧的参与下自发分解[3],增大了其在生产、储运和使用过程中的危险性。例如2012年2月28日,河北克尔化工有限公司发生的重大火灾爆炸事故[4],就是由于硝酸胍和未反应完的硝酸铵局部受热,二者急剧分解发生爆炸,又引爆堆放在反应釜附近的硝酸胍,发生二次爆炸,事故造成25人死亡、4人失踪、46人受伤,爆炸所释放的能量相当于6.05吨三硝基甲苯(TNT)。因此,研究硝酸胍的热解行为具有重要的实际意义。Sankaranarayanan等[5]通过热重- 红外- 质谱联用(TG- FT- IR- MS)分析硝酸胍的热分解行为,指出其主要分解产物为NH3、N2O、NO2、H2O和CO2。王学志[3]通过差示扫描量热法(DSC)测定硝酸胍的热流曲线,结果表明硝酸胍的分解存在吸放热耦合现象,符合自催化反应特征。王凯[6]指出对于存在耦合现象的物质,通过热重数据进行热动力学计算,能在一定程度上避免或减弱熔融吸热和分解放热之间的影响。硝酸胍具有较大的热危险性,但目前对其热动力学分析的研究较少,对热安全应用参数的研究尚未展开。因此,本文采用热重分析法,通过不同的线性升温速率来探究硝酸胍的热分解过程,利用Flynn- Wall- Ozawa(FWO)和Kissinger Akahira and Sunose(KAS)法估算其表观活化能,采用Coats- Redfern(CR)法探究最适反应机理函数,并计算其热安全性参数,研究结果可以为硝酸胍的生产、储运及使用过程中的安全应用提供理论参考。
1 实验部分
1.1 实验原料
硝酸胍,分析纯,阿拉丁试剂(上海)有限公司。
1.2 实验方法
采用STA449F5型同步热分析仪(德国NETZSCH仪器制造有限公司)进行热重法分析。取约7 mg硝酸胍于氧化铝坩埚中进行热分析测试,温度范围为450~700 K,升温速率为5、10、15、20 K/min,吹扫气和保护气均为氮气,气体流量为50 mL/min。
采用DSC 250型差示扫描量热仪(美国TA仪器公司)进行DSC信号测试。由于蓝宝石是单晶氧化铝(α-Al2O3),其物化性质稳定,可提高比热容实验的准确性,故采用蓝宝石法测定比热容,并在开始和结束段各设5 min的等温段,以补偿温度漂移,即303.15 K时恒温5 min,然后以10 K/min的升温速率升至373.15 K,再恒温5 min。
上述实验均在相对密闭的空间中进行,以减小热量损失。
2 结果与讨论
2.1 硝酸胍热分解过程
图1为硝酸胍在5、10、15、20 K/min的升温速率下的TG和微商热重(DTG)曲线,表1为硝酸胍的热分解参数。由结果可知,硝酸胍在450~700 K的温度范围内呈一步失重,TG的平均外推起始温度为580.28 K,平均外推终止温度为607.78 K,该阶段为硝酸胍的主要分解阶段,反应速率较大,700 K时平均质量残留率为18.74%。不同升温速率并未改变硝酸胍的热分解过程,但随着升温速率的增大,硝酸胍的分解过程存在滞后效应,即分解的外推起始温度、峰值温度和外推终止温度均向高温方向推移,且最大热解速率增大。

表1 硝酸胍的热分解参数Table 1 Thermal decomposition parameters of guanidine nitrate

图1 不同升温速率下硝酸胍的热分解曲线Fig.1 Thermal decomposition curves of guanidine nitrate at different heating rates
2.2 热动力学分析
根据热动力学理论,在非等温非均相体系中,动力学方程可表示为[7]
(1)
式中,α为转化率;T为热力学温度,K;β为升温速率,K/min;k(T)为反应速率常数;f(α)为微分机理函数。其中,转化率α可表示为[7]
a—升温速率;b—外推起始温度;c—外推终止温度;d—700 K时质量残留率;e—峰值温度。
(2)
式中,m0为起始质量,g;mt为任意时刻t的质量,g;m∞为最终质量,g。
根据Arrhenius方程,反应速率常数k(T)和热力学温度T的关系可表示为[7]
(3)
式中,A为指前因子;Eα为表观活化能,kJ/mol;R为摩尔气体常数,8.314 J/(mol·K)。
联立式(1)和(3),热动力学方程可写为
(4)
其中,积分和微分的关系式可表示为[7]
(5)
式中,g(α)为积分机理函数。
2.2.1无模型拟合法
无模型拟合法,又称等转化率法,是指在不假定反应机理函数的情况下直接求取表观活化能Eα的方法,避免了因假设不同的反应机理而导致的误差[8-9],其广泛应用于热动力学分析。常用的无模型拟合法有FWO法、KAS法和Friedman法等。
本文对450~700 K的温度范围内硝酸胍的分解过程进行热动力学分析,采用FWO法和KAS法对转化率在0.1~0.9内的曲线数据进行线性拟合。
FWO法中,热动力学方程可表示为[7]
(6)
KAS法中,热动力学方程可表示为[7]
(7)
图2和图3分别为不同转化率下FWO和KAS法的拟合曲线,拟合参数(Eα和相关系数r)见表2。从表2可以看出,FWO和KAS法得到的r值均较高,说明线性拟合较好。FWO法得到的表观活化能范围为110.80~155.65 kJ/mol,平均值为140.43 kJ/mol;KAS法得到的表观活化能范围为107.01~153.57 kJ/mol,平均值为137.82 kJ/mol。两种方法得到的表观活化能相差较小,且表观活化能都具有随转化率的升高而增大的趋势,说明反应难度随反应程度的加大而增加。
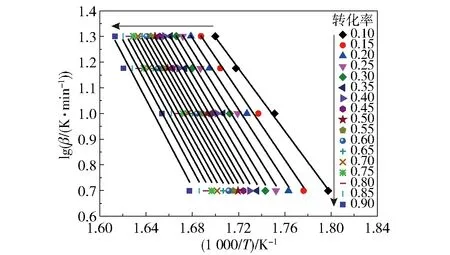
图2 不同转化率下FWO法的拟合曲线Fig.2 Fitting curves of the FWO method for different conversion rates
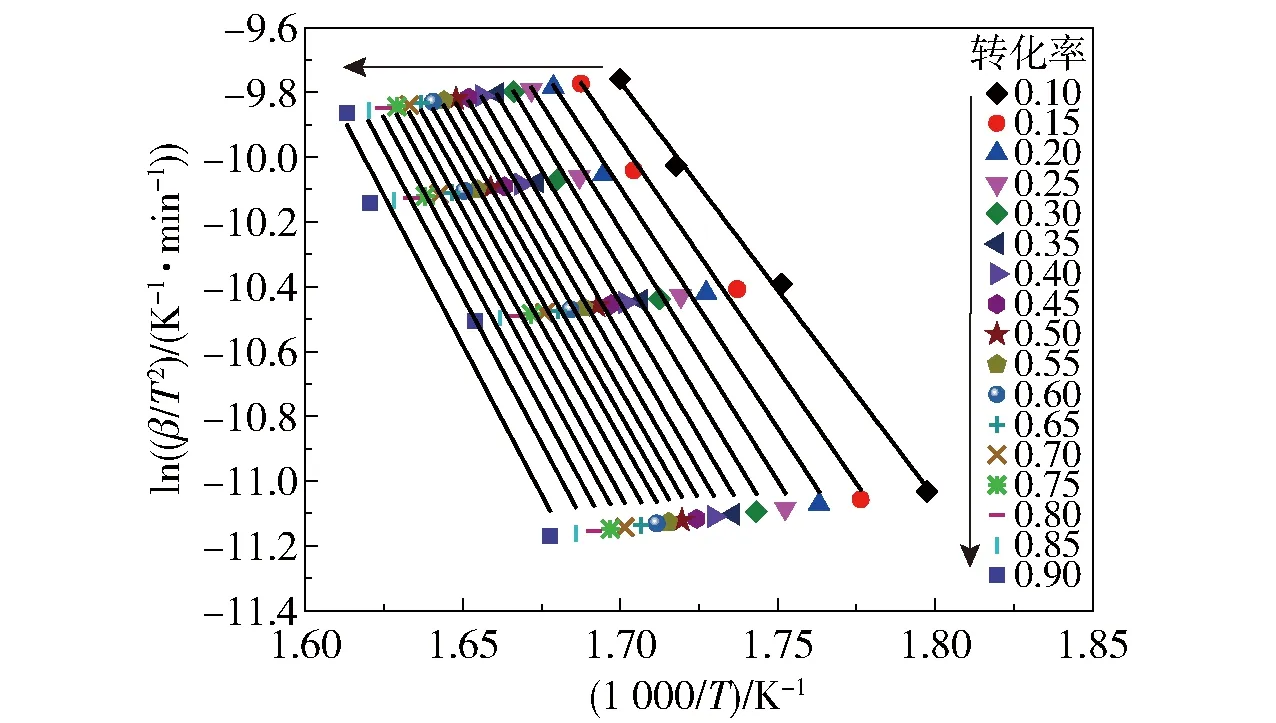
图3 不同转化率下KAS法的拟合曲线Fig.3 Fitting curves of the KAS method for different conversion rates
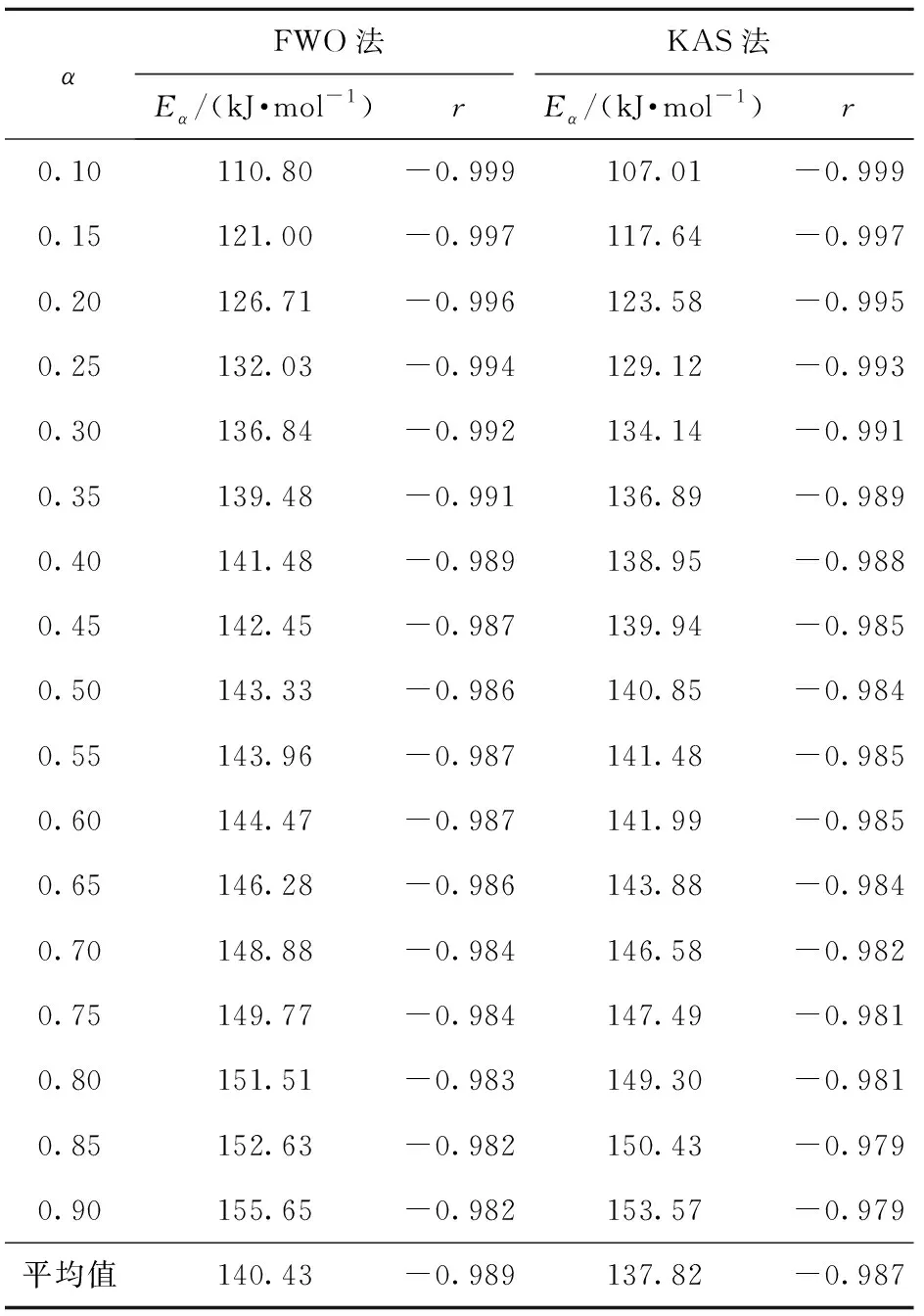
表2 不同转化率α下FWO和KAS法的拟合参数Table 2 Fitting parameters of FWO and KAS methods for different conversion rates
由FWO和KAS法求得的表观活化能均小于180 kJ/mol,根据固体物质活化能指标自燃倾向性分级标准[10-11],硝酸胍的自燃倾向等级为Ⅰ级,自燃倾向性大,热危险性大。
图4为FWO和KAS法中转化率α与表观活化能Eα的关系曲线。由图中可以看出,FWO和KAS法中转化率与表观活化能的拟合曲线近似平行,规律呈现一致性。FWO和KAS法曲线拟合的关系式可分别表示为式(8)和式(9),决定系数(R2)均为0.993。
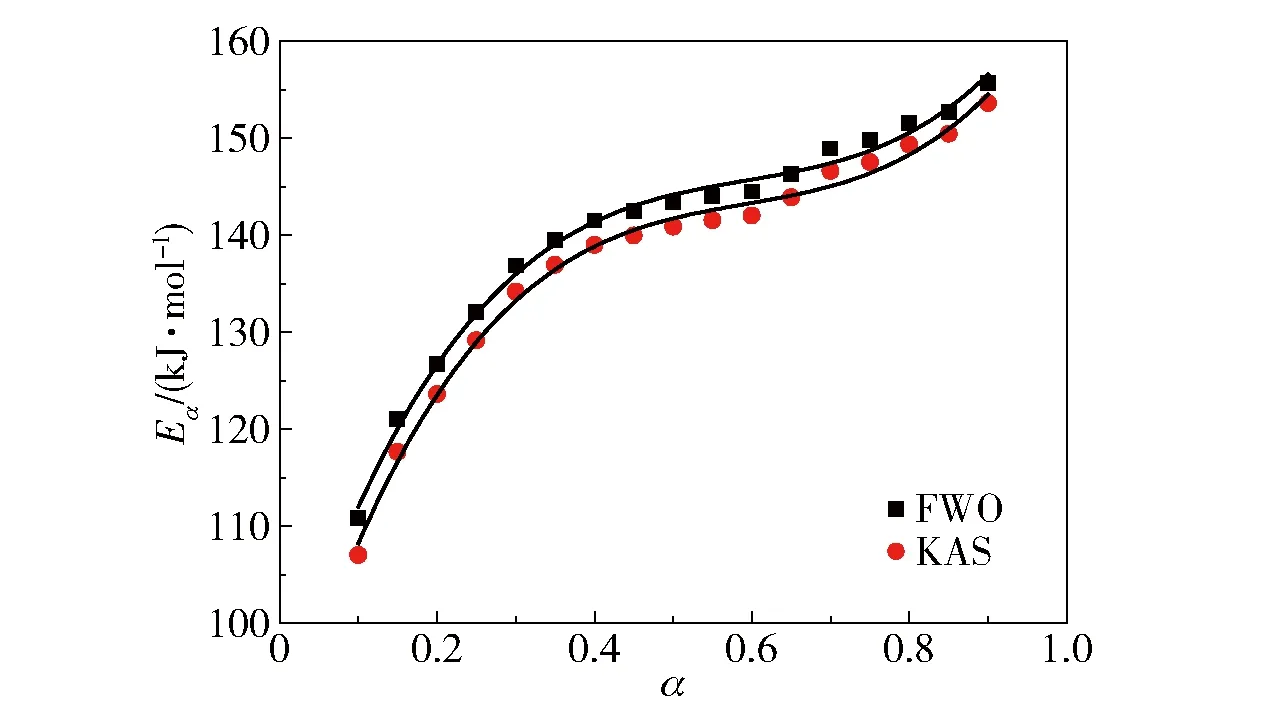
图4 FWO和KAS法中转化率与表观活化能的关系曲线Fig.4 Relation between conversion rate and apparent activation energy in the FWO and KAS methods
Eα=90.68+250.68α-400.33α2+225.63α3
(8)
Eα=86.03+261.45α-418.05α2+235.59α3
(9)
2.2.2模型拟合法
模型拟合法涉及反应机理函数,因此可同时求算活化能与指前因子[12]。本文选取20 K/min升温速率下的热分解曲线,采用CR法进行拟合,其热动力学方程可表示为[7]
(10)
表3为常见的13种固体热解反应机理[7],通过CR法求得其表观活化能,探究硝酸胍的最适机理函数,拟合曲线见图5,计算结果见表4。由表4可以看出,由Avrami- Erofeev(A2)得出的表观活化能为140.55 kJ/mol,最接近由FWO和KAS法计算的平均表观活化能140.43 kJ/mol和137.82 kJ/mol,表明Avrami- Erofeev(A2),即二维随机成核及增长模型最能反映硝酸胍的分解机理,其反应机理函数可表示为
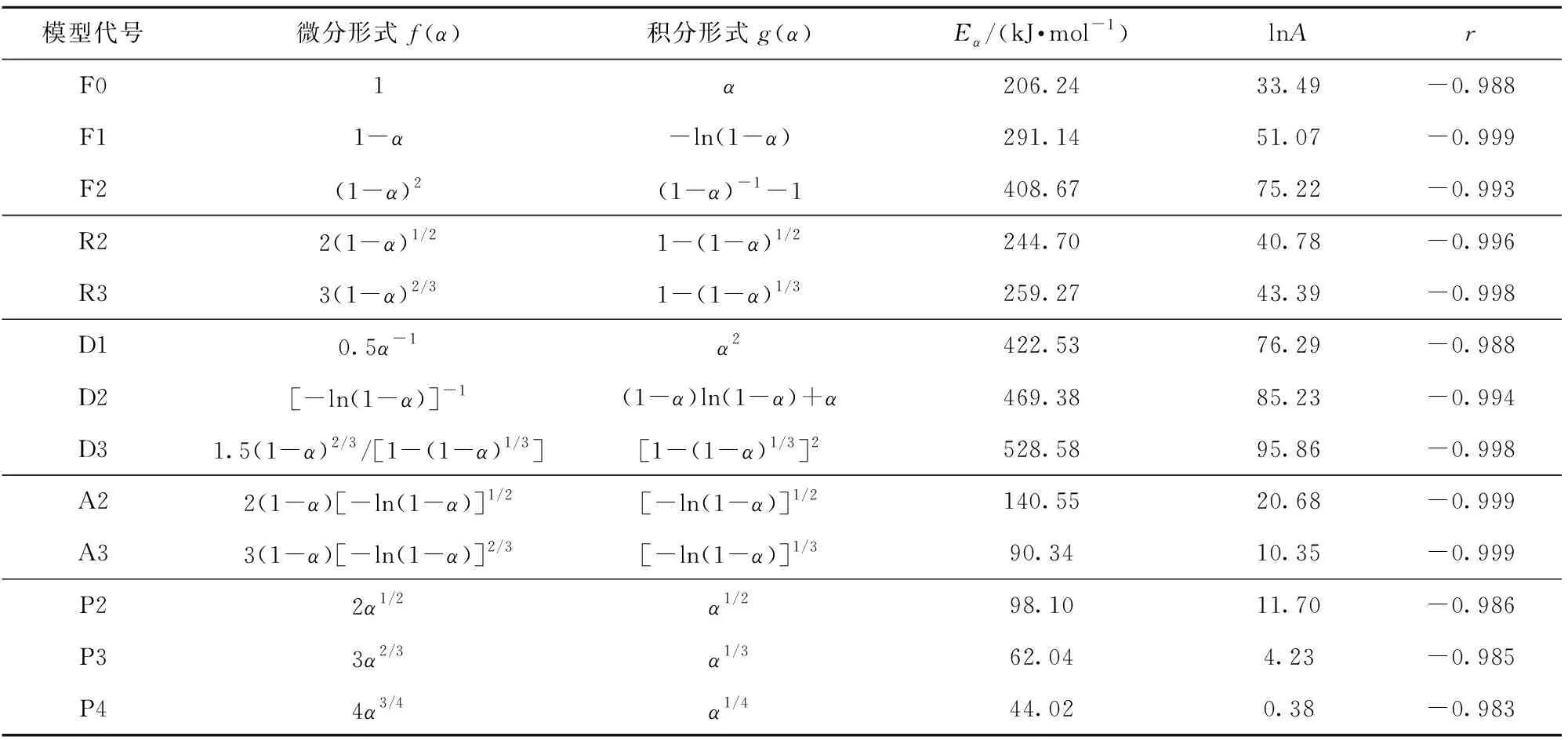
表4 CR法估算表观活化能Table 4 Apparent activation energies obtained using the CR method
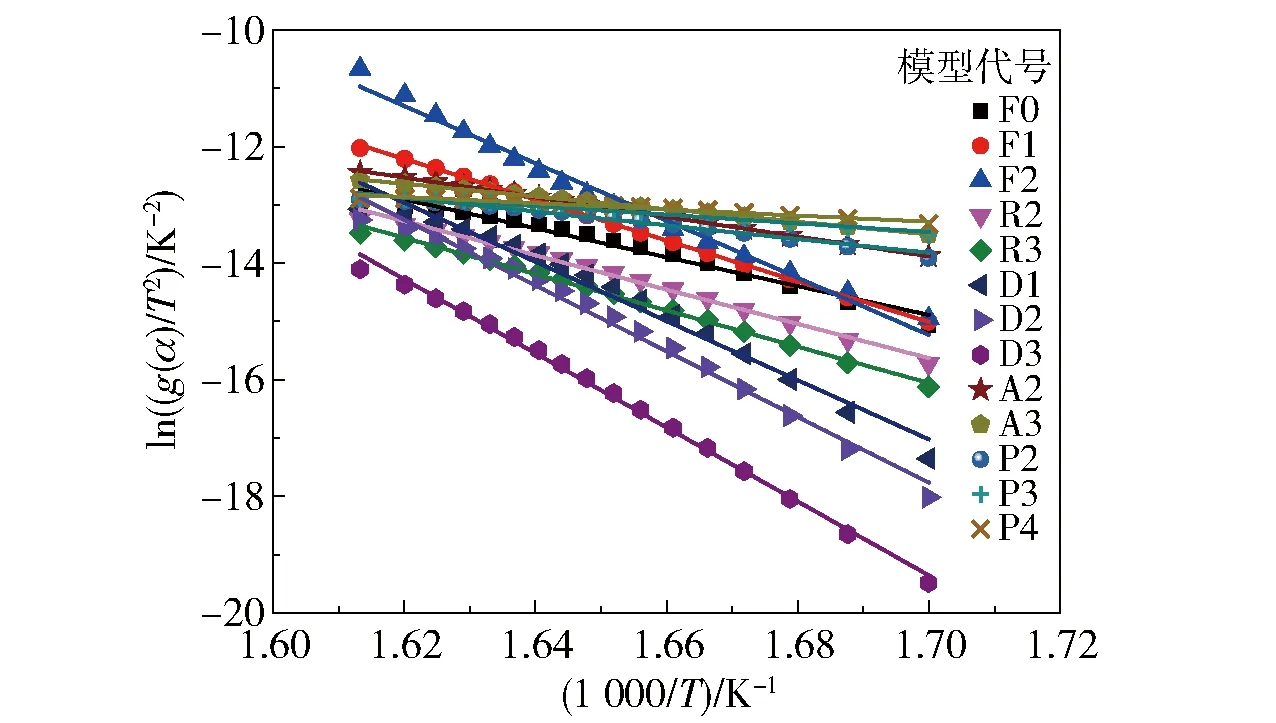
图5 CR法中反应机理函数拟合曲线Fig.5 Fitting curves of the reaction mechanism function by the CR method
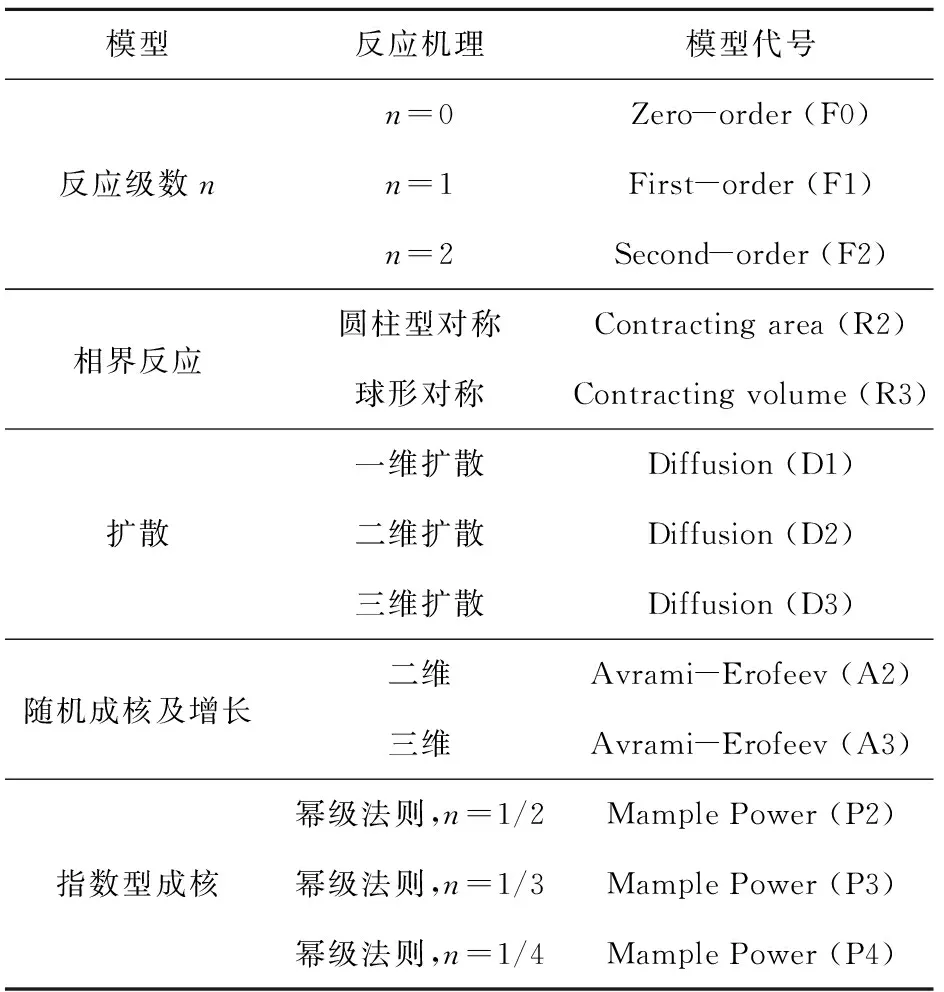
表3 常见的13种固体热解反应机理[7]Table 3 Thirteen common solid pyrolysis reactionmechanisms[7]
(11)
2.3 热安全性参数
2.3.1比热容
采用蓝宝石法,以等温- 动态- 等温的模式,分别对空坩埚、蓝宝石和样品坩埚进行DSC信号测试,结果见图6。通过公式(12)得到不同温度下硝酸胍的比热容[13],结果如表5所示。
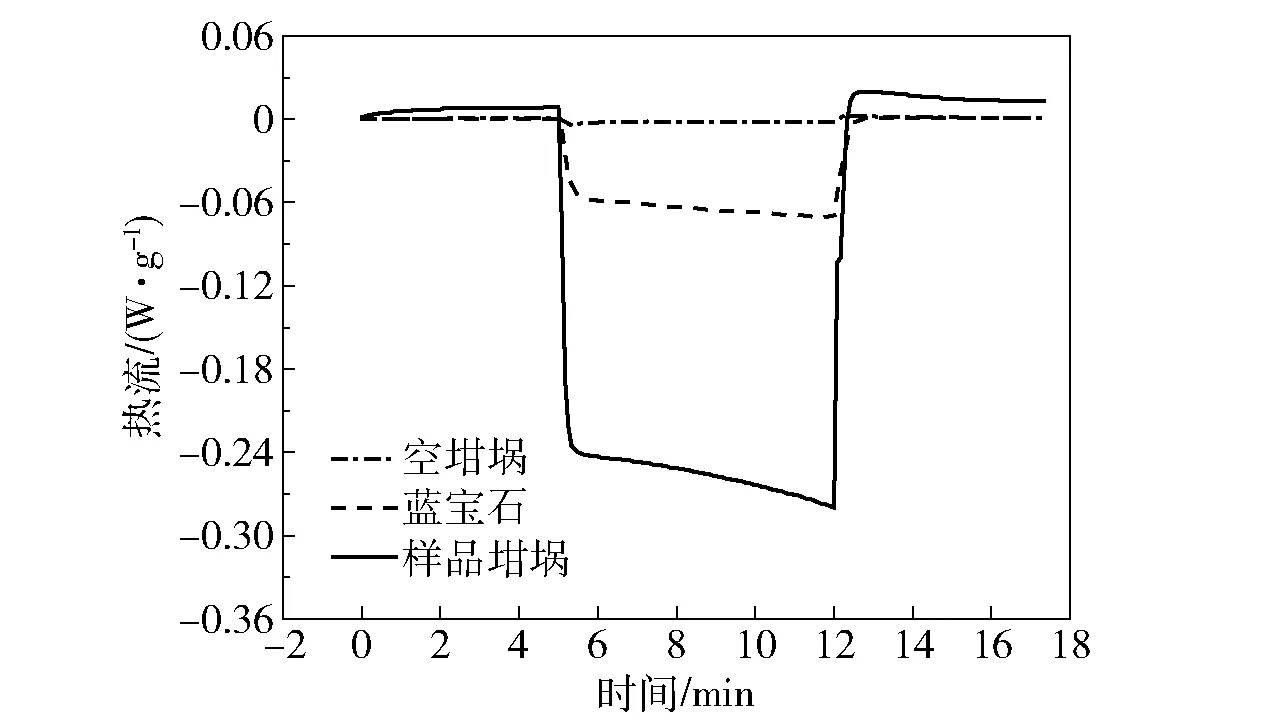
图6 空坩埚、蓝宝石和样品坩埚的DSC信号曲线Fig.6 DSC signal curves of the empty crucible, sapphire and sample crucible
(12)
式中,cp为样品的比热容,J/(g·K);Φmeas为样品的DSC信号,mW;Φsap为蓝宝石的DSC信号,mW;Φbl为空坩埚的DSC信号,mW;msap为蓝宝石的质量,g;mmeas为样品的质量,g;cp(sap)为蓝宝石的比热容,J/(g·K)。
由表5可知,在310~370 K的温度范围内,硝酸胍的比热容随温度的升高而逐渐增大,平均值为3.148 J/(g·K)。
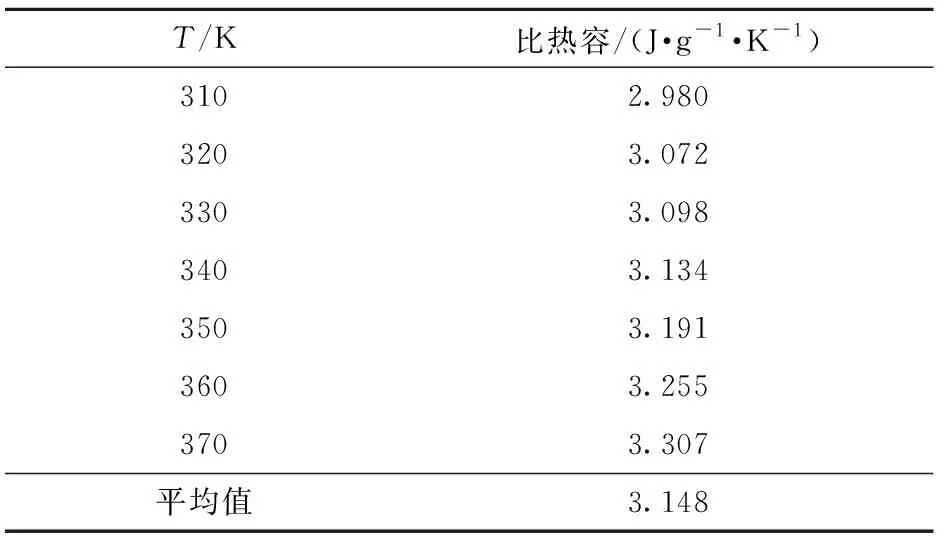
表5 不同温度下硝酸胍的比热容Table 5 Specific heat capacities of guanidine nitrate at different temperatures
2.3.2自加速分解温度
自发火温度(Tbe0)是指物质自加热着火的最低环境温度,是物质热安全性的参数之一。自加速分解温度(TSADT)是指反应性化学物质在7日内发生自加速分解的最低环境温度[14],是评价物质热危险性的重要指标。
根据 GJB 772A—1997[15],由不同升温速率下DTG的外推起始温度Te,按式(13)进行线性回归计算,可得升温速率β趋于0时的外推起始温度(Te0),由Te0=TSADT,可得硝酸胍的自加速分解温度[16-17]。由热力学关系式(14),代入Te0,可得到Tbe0。
(13)
(14)
式中,Tei为升温速率βi时的外推起始温度,K;b、c、d为方程的系数;Eα取FWO和KAS法的平均值[18-19]。
经计算,硝酸胍的自加速分解温度为530.15 K,自发火温度为548.10 K。通过实验研究和理论计算可知,硝酸胍在生产、储运及使用过程中,应严格控制周围环境温度,不得高于530.15 K,以避免热量累积及热失控事件的发生。
2.3.3活化参数
活化熵(ΔS≠)、活化焓(ΔH≠)和活化自由能(ΔG≠)是评价物质热安全性的重要参数,其中,ΔS≠表示体系的混乱程度,熵值越小,体系越有序;ΔH≠表示反应的总能耗,焓值越小,越有利于形成活化络合物;ΔG≠表示形成活化络合物系统的总能量的增加量[20-21]。根据过渡态理论,结合公式(15)~(17),分别计算Te和Tp下的活化参数,结果见表6。
(15)
ΔH≠=Eα-RT
(16)
ΔG≠=ΔH≠-TΔS≠
(17)
式中,KB为玻耳兹曼常量,1.380 7×10-23J/K;h为普朗克常数,6.626×10-34J/s。
由表6可知,ΔS≠和ΔH≠随升温速率的增大而减小,表明升温速率增大,体系的有序性增加,且有利于活化络合物的形成;ΔG≠和k(T)随升温速率的增大而增大,其中,ΔG≠正值较高,表明活化络合物很不稳定,在外界作用下易向正反应方向进行[22-23],k(T)的增加,表明反应速率加快,这与图1的DTG曲线趋势相一致。
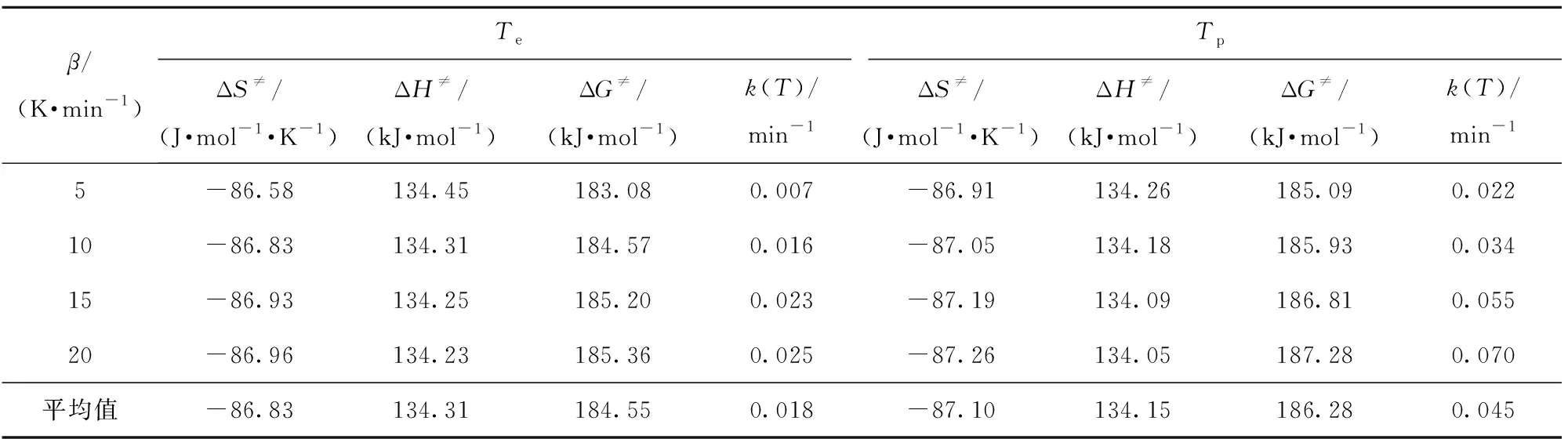
表6 硝酸胍的活化参数Table 6 Activation parameters of guanidine nitrate
3 结论
(1)硝酸胍在5、10、15、20 K/min的升温速率下,在450~700 K的温度范围内呈一步失重,热重法的平均外推起始温度为580.28 K,700 K时平均质量残留率为18.74%。不同升温速率并未改变硝酸胍的热分解过程,但随着升温速率的增大,硝酸胍的分解存在滞后效应。
(2)采用FWO和KAS法对转化率在0.1~0.9内的曲线数据进行线性拟合,得到表观活化能的平均值分别为140.43 kJ/mol和137.82 kJ/mol,自燃倾向等级为Ⅰ级。表观活化能随转化率的升高而增大,说明反应难度随反应程度的加大而增加。通过CR法可知,Avrami- Erofeev(A2)模型最能反映硝酸胍的分解机理。
(3)在310~370 K的温度范围内,硝酸胍的比热容随温度的升高而逐渐增大,比热容的平均值为3.148 J/(g·K)。自加速分解温度(TSADT)和自发火温度(Tbe0)分别为530.15 K和548.10 K。活化熵和活化焓随升温速率的增大而减小,活化自由能和反应速率常数随升温速率的增大而增大。
