GP、AAR及FIB-4对自身免疫性肝病所致肝硬化的诊断价值比较
2021-06-23孙诗玉孙长峰盛云建邓存良
孙诗玉 孙长峰 盛云建 杨 晴 邓存良
自身免疫性肝病(autoimmune liver diseases,AILD)是一组由自身免疫反应介导的慢性肝脏疾病,好发于女性,其发病机制尚不明确,可能与遗传、免疫、环境等多种因素有关[1]。AILD包括自身免疫性肝炎(autoimmune hepatitis,AIH)、原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)、原发性胆汁性胆管炎(primary biliary cholangitis,PBC)及重叠综合征(overlap syndrome, OS)。AILD起病隐匿,临床症状不典型,早期可能容易误诊或漏诊,随着病情进展,逐渐发展为肝纤维化,最终导致肝硬化、肝衰竭。肝脏活检(liver biopsy,LB)仍然是临床诊断肝硬化的“金标准”,但使用受到费用高、并发症风险、患者依从性差、取样误差及医生主观判断的偏倚等限制[2]。甚至有报道,肝穿后导致的病死率约为0.0088%~0.3%[3]。因此,开发能够评估肝纤维化的无创指标及模型非常有必要,联合使用多项血清学指标和临床指标建立无创诊断模型以判断纤维化程度已然成为一种趋势。
近年来,一些无创诊断模型已被证实对诊断肝纤维化有一定价值,如球蛋白-血小板模型(globulin-platelet, GP)、门冬氨酸氨基转移酶-血小板比值指数(aspartate aminotransferase to platelet ratio index,APRI)、基于4因子的纤维化指数(fibrosis index based on the four factors,FIB-4)、门冬氨酸氨基转移酶-丙氨酸氨基转移酶(aspartate aminotransferase to alanine aminotransferase ratio,AAR)、γ-谷酰胺转肽酶-血小板比值(γ-glutamyl transpeptidase to platelet ratio,GPR)、红细胞宽度与血小板比率(red cell distribution width to platelet ratio, RPR)等。APRI及FIB-4已被纳入乙肝和丙肝指南用于肝纤维化及肝硬化的评估[4, 5]。另外,据文献报道,红细胞分布宽度(RDW)和平均血小板体积(MPV)对预测AIH相关肝硬化有一定参考价值[6]。但是,无创指标在诊断AILD所致肝硬化的研究尚少,同时由于临床工作中对AILD的诊断、分类尚有一定困难,需要一些能够评估AILD所致肝硬化的无创指标。因此,本研究探讨了GP、FIB-4及AAR等模型单独及联合诊断AILD所致肝硬化的效能,拟为临床工作中对诊断AILD所致肝硬化提供依据。
对象与方法
1.研究对象:选取2013年10月~2018年8月于西南医科大学附属医院感染科就诊的自身免疫性肝病患者,纳入标准:AIH诊断符合2008年IAIHG提出的诊断积分系统[7],PBC和PSC诊断符合《原发性胆汁性胆管炎诊断和治疗共识(2015)》[8]和《原发性硬化性胆管炎诊断和治疗专家共识》[9],AIH-PBC符合巴黎标准[10],AIH-PSC表现为明确诊断为PSC的基础上同时存在AIH[11],肝硬化诊断符合中华医学会肝病学分会制定的《肝硬化诊治指南》标准[12],代偿期肝硬化诊断依据符合以下4条之一:①组织学符合肝硬化诊断;②内镜显示食管胃静脉曲张或消化道异位静脉曲张,除外非肝硬化性门脉高压;③B超、LSM或CT等影像学检査提示肝硬化或门脉高压特征;④无组织学、内镜或影像学检查,以下检查指标异常提示存在肝硬化(需符合3条中两条):①PLT<100×109/L,且无其他原因解释;②血清ALB<35g/L,排除营养不良或肾脏疾病等其他原因;③INR>1.3或PT延长(停用溶栓或抗凝药7天以上);出现门脉高压相关并发症,如腹腔积液、食管胃静脉曲张破裂出血、脓毒症、肝性脑病、肝肾综合征等为肝硬化失代偿期。有详实完整的临床、影像及实验室检查资料。排除标准:合并其他肝脏疾病,如病毒性肝炎、酒精性脂肪肝、非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD),肝癌(hepatocellular carcinoma,HCC)、药物性肝损害等;合并严重的心血管系统、血液系统、免疫系统、消化系统或内分泌系统异常;人类免疫缺陷病毒合并感染;遗传代谢性肝病如Wilson′s 病、血色病及 α1抗胰蛋白酶缺乏症;长期酗酒史;妊娠及哺乳期女性。
2.仪器与方法:患者的年龄、性别、血常规、肝功能、凝血等一般信息及临床指标通过西南医科大学附属医院电子病历系统查询。血常规通过Mind6800自动血液分析仪检测,MindrayBS200生化分析仪检测肝功,CS-5100全自动凝血分析仪检测凝血指标。
3.各无创模型的计算根据相关文献报道,APRI、FIB-4、AAR和GP 计算公式分别为:①APRI=[(AST/ULN)×100]/PLT(×109/L)[13];②FIB-4=年龄(岁)×AST(U/L)/PLT(×109/L)×ALT(U/L)1/2[13];③AAR=AST(U/L)/ALT(U/L)[13];④GP=GLOB(g/L)×10/PLT(×109/L)[14]。

结 果
1.一般资料分析:共纳入103例自身免疫性肝病的患者,其中女性92例,男性11例,患者平均年龄为52.51±12.40岁。肝硬化组40例[AIH 16例,PBC 21例,AIH-PBC 2例,AIH-PSC 1例,患者年龄60(50,65)岁,男性2例,女性38例],非肝硬化组63例[AIH 34例,PBC 19例,AIH-PBC 9例,PSC 1例,年龄50(42,60)岁,男性54例,女性9例]。肝硬化组与非肝硬化组之间年龄、ALT、AST、白蛋白、血红蛋白、血小板计数、凝血酶原活动度等一般指标及GP、FIB-4、AAR比较,差异有统计学意义(P<0.05)。两组性别、ALP、球蛋白、GGT、总胆红素、APRI比较,差异无统计学意义(P>0.05),详见表1。

表1 两组间一般资料的比较
2.GP、FIB-4及AAR同AILD所致肝硬化的相关性分析:Spearman相关性分析显示,GP、FIB-4、AAR等无创模型均与肝硬化呈正相关(P=0.000),且以GP同AILD所致肝硬化的相关性最佳(r=0.682),详见图1。
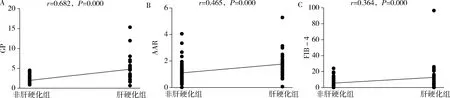
图1 GP、AAR及FIB-4同AILD肝硬化的相关性分析
3.各参数模型诊断AILD所致肝硬化的ROC曲线及比较:AAR、FIB-4及GP对AILD所致肝硬化均有一定诊断价值(P=0.000),以GP的曲线下面积最大(AUC=0.904)。比较3种模型的AUC差异,AAR与FIB-4之间AUC比较差异无统计学意义(Z=1.274,P=0.20),GP与AAR、FIB-4之间的AUC比较差异有统计学意义(Z值分别为2.509和4.161,P<0.05),GP诊断效能优于AAR、FIB-4(P<0.05)。
将AAR、GP和FIB-4引入二元Logistic回归分析(P<0.05进入,P>0.10剔除),GP与FIB-4为诊断AILD所致肝硬化的独立预测因子(P<0.05),构建联合诊断模型并绘制ROC曲线。GP+FIB-4联合模型AUC最大,与AAR、FIB-4比较差异有统计学意义(P<0.05),但同GP之间比较差异无统计学意义(P>0.05),详见表2、表3,图2。
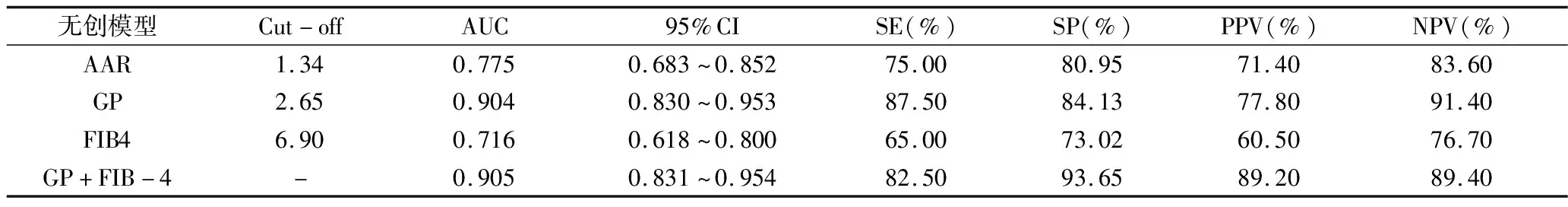
表2 AAR、GP、FIB-4对AILD所致肝硬化的诊断效能

表3 各无创模型对诊断AILD所致肝硬化的AUC比较
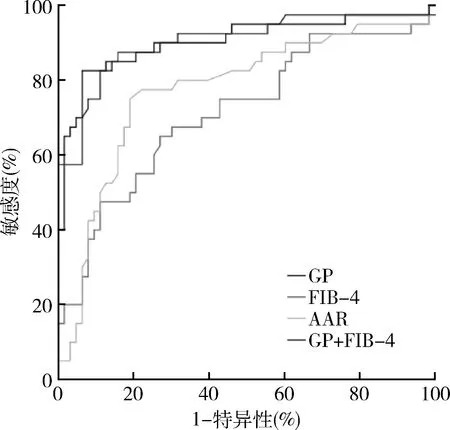
图2 GP、FIB-4、AAR诊断AILD肝硬化的ROC曲线
讨 论
自身免疫性肝病(AILD)是一组以针对肝细胞或胆管的异常免疫反应为特征的疾病,伴有血清自身抗体的存在,并有发展为肝硬化的潜在趋势,常合并有其他自身免疫性疾病,如类风湿性关节炎、系统性红斑狼疮、干燥综合征等[15]。AILD若不及时干预治疗,长期炎症引起肝纤维化,可逐渐发展为肝硬化。诊断肝硬化的“金标准”仍为肝穿刺活检,但常因受限于各种因素而不能普及,因此无创性指标评价肝纤维化程度具有较大的现实意义。近年来,预测肝脏纤维化的模型研究已取得许多进展,很多无创指标及技术已被证实具备较好的诊断肝硬化的效能,Zeng等[15]将2D-SWE(一种新型的剪切波速度成像技术)用于评估AILD导致的肝硬化,其诊断肝硬化的AUC及临界值分别为0.86和16.30kPa,并具有较高的敏感度和特异性。
GP模型是由Liu等[14]开发用于评估HBV肝硬化的一种新型无创模型,仅由两个常见的参数构成,简便易获得,具有较高的准确性。研究显示,GP模型诊断乙肝肝硬化的AUC为0.781(95% CI: 0.638~0.924),临界值为2.53,阴性预测值为96.7%,说明GP模型能排除绝大部分无肝硬化者[14]。Li等[16]通过研究得出GP诊断乙肝肝硬化的AUC为0.91(95% CI: 0.87~0.94),以2.6为临界值,诊断效能优于FIB-4和APRI。本研究中,GP诊断AILD导致的肝硬化的AUC为0.904,以2.65为临界值,敏感度、特异性、PPV和NPV分别为87.50%、84.13%、77.80%和91.40%,与Li等[16]研究GP诊断HBV肝硬化结果相近。FIB-4最初是在丙型肝炎病毒感染基础上建立的,但国内外对FIB-4诊断AILD肝硬化价值的研究结果不一[17]。在两项研究中,FIB-4预测AIH肝硬化的AUC分别为0.766和0.881,在另一项排除了重叠综合征的AILD研究中显示FIB-4预测AILD所致肝硬化的AUC为0.680[18~20]。本研究FIB-4预测AILD的AUC为0.716,与Park等[20]的研究结果接近。AAR是一种简单而可靠的评估肝纤维化的指标,可预测PBC患者的肝纤维化和AIH肝硬化的程度[19,21]。根据Yuan等[19]研究结果表明AAR诊断AIH肝硬化的AUC为0.528。本研究发现,AAR诊断AILD导致的肝硬化的AUC为0.775,敏感度、特异性、PPV和NPV分别为75.00%、80.95%、71.40%和83.60%,结果差异可能来源于疾病分类不同、肝脏炎症程度、肝酶易变性和检测误差等。FIB-4和AAR包含AST和ALT两个参数,易受AST、ALT改变和肝脏炎症程度的影响,因此稳定性欠佳。
APRI模型较早被认为是评估肝纤维化/肝硬化比较可靠的指标,在病毒性肝炎、自身免疫性肝病等方面均有研究[16,19,20]。APRI诊断AILD所致肝硬化的AUC为0.58,另外一个研究认为APRI诊断AIH肝硬化的AUC为0.798[19,20]。然而本研究中,两组间APRI比较差异无统计学意义,可能是由于本研究未对AILD进一步分类。也有研究者认为,APRI 预测肝脏纤维化程度有限,预测肝纤维化程度的有效性可能是其预测肝脏炎症坏死程度而不是硬度的关联效应[22]。
综上所述,本研究发现AAR、FIB-4及GP血清无创模型对AILD所致肝硬化的诊断有较好的效能,Spearman分析显示三者均与AILD所致肝硬化呈正相关,其中以GP模型的相关性最高(r=0.682);进一步绘制受试者工作特征(ROC)曲线,GP、FIB-4和AAR诊断AILD所致肝硬化的AUC分别为0.904、0.716和0.775,与AAR、FIB-4诊断AILD所致肝硬化的AUC比较,差异有统计学意义(Z值分别为2.509和4.161,P<0.05),表明仍以GP模型的诊断效能最佳,且具有较高的敏感度、特异性、阳性预测值及阴性预测值。但本研究存在一定局限性,本研究为单中心回顾性研究,样本量有限,AIH、PBC、PSC患者未单独分析,没有进行肝穿刺活检及肝纤维化分期,这些无创模型对肝硬化的预测价值需进一步研究,后期需扩大样本量并进行多中心研究,予以进一步验证。
