东方百合‘索邦’几丁质酶基因的克隆与表达分析
2021-06-22汪莲娟韩蕊莲
崔 祺,吴 凡,詹 鹏,汪莲娟,韩蕊莲, 3,吴 昀*
(1 浙江理工大学 建筑工程学院,杭州310018;2 花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,教育部林木花卉育种实验室,北京林业大学 园林学院,北京100083;3 西北农林科技大学 草业与草原学院,陕西杨陵 712100)
百合属于百合科(Liliaceae)百合属(Lilium)多年生具有地下鳞茎的单子叶草本植物,是重要的商品花卉和园林绿化植物。近年来,随着从国外引进种球数量的不断增加,中国百合栽培面积也在不断扩大。然而,各种病害的发生对百合生产的危害不容小觑,其中由灰霉菌(Botrytiselliptica)引起的灰霉病是最为普遍发生的病害。B.elliptica专性侵染百合的茎、叶及花器官,病害发生后常常出现叶片焦枯、茎秆软腐、花苞畸形、花瓣萎蔫等症状,严重时可造成种植区内百合成片死亡,是切花栽培和种球繁育的重要障碍[1]。生产实践证明,应用抗病品种是最经济有效又符合环保要求的病害防治措施。
前人对百合种质资源进行了灰霉病的抗性评价,发现部分野生百合,如岷江百合(L.regale)、宜昌百合(L.leucanthum)、大理百合(L.taliense)和湖北百合(L.henryi)[2],以及栽培品种中的东方百合和OT(Oriental × Trumpet)百合杂种系对灰霉病的抗性较强,亚洲百合和喇叭百合系列品种则较为感病[3]。目前少数百合对灰霉病表现出一定的抗性,并不存在完全免疫的种或品种。通过挖掘高抗种质材料中参与抗灰霉病反应的关键基因,并利用植物基因工程将其转入百合中,培育抗病新品种,已成为防治百合病虫害,促进百合产业健康发展的重要方向之一。
植物几丁质酶(chitinase)是一类由多基因家族编码的糖苷水解酶(glucoside hydrolase),各类同功酶的酶活性、氨基酸序列、保守结构域、蛋白等电点、功能位点、亚细胞定位等存在一定差异[4]。前人根据氨基酸的序列特性,将其分为糖苷水解酶18家族(GH-18)和糖苷水解酶19家族(GH-19),这两大家族又进一步分为5类(Ⅰ-Ⅴ),其中Ⅰ类、Ⅱ类和Ⅳ类属于GH-19家族,Ⅲ类和Ⅴ类属于GH-18家族[5]。正常状况下,几丁质酶表达量很低或者不表达,但在受到病原菌或昆虫感染时,其含量迅速升高,通过水解病原菌细胞壁或昆虫外骨骼的几丁质达到抑制其生长与增殖的目的[6]。目前已从拟南芥(Arabidopsisthaliana)[7]、水稻(Oryzasativa)[8]、水仙(Narcissustazetta)[9]和菊花(Chrysanthemummorifolium)[10]等多种植物中分离获得几丁质酶基因。玉米(Zeamays)[11]、番茄(Solanumlycopersicum)[12]、芥菜(Brassicajuncea)[13]和马铃薯(Solanumtuberosum)[14]等植物的几丁质酶家族成员已经在全基因组范围内得到了鉴定。
前人研究发现灰霉菌侵染能有效诱导辣椒(Capsicumannuum)[15]、草莓(Fragaria×ananassa)[16]和葡萄(Vitisvinifera)[17]中几丁质酶基因的表达。几丁质酶基因也可由非生物胁迫如盐碱[18]、寒冷[19]和干旱[20],以及植物激素茉莉酸(jasmonic acid, JA)和水杨酸(salicylic acid, SA)诱导表达[14]。将几丁质酶基因转入柠檬(Citruslimon)[21]、矮牵牛(Petuniahybrida)[22]和番茄[23]中可增强转基因植物对灰霉病的抗性。此外,转化了几丁质酶基因的植物对其他病害的抗性也得到了增强,如茶树(Camelliasinensis)对茶饼病的抗性[24]、花生(Arachishypogaea)对黑斑病的抗性[25]、大豆(Glycinemax)对菌核病的抗性[26]以及苹果(Malus×domestica)对炭疽病和褐斑病的抗性[27]。这些研究说明几丁质酶基因在植物抗病反应过程中发挥着重要作用。
通过检索NCBI数据库,百合属中只有岷江百合与麝香百合(L.longiflorum)登录了几丁质酶基因的全长cDNA序列,同其他植物相比较,有关百合几丁质酶基因生物学功能的研究鲜有报道。本课题组前期通过分析灰霉菌侵染后的百合叶片转录组数据,发现了2个差异表达的几丁质酶基因家族成员,分别为Ⅲ类和Ⅴ类成员。对Ⅴ类成员进行qRT-PCR分析发现:接种灰霉菌12和24 h后,该基因在抗病百合中的表达水平分别为感病百合的8和4倍,推测其可能参与到百合的抗病反应中[28]。鉴于几丁质酶基因在植物抗病反应中的关键作用,进一步开展百合几丁质酶基因家族其他成员的研究,具有潜在的理论与现实意义。因此,本研究以高抗品种东方百合‘索邦’(L.oriental hybrid ‘Sorbonne’)接种灰霉菌12 h后的叶片为材料,利用RT-PCR技术克隆到了上述差异表达的Ⅲ类几丁质酶基因成员,命名为LoChi2,通过生物信息学手段预测分析了目标基因推导的编码蛋白的结构和功能,同时借助qRT-PCR的方法,对灰霉菌侵染以及SA/JA处理条件下LoChi2基因在百合中的表达模式进行了研究,以期为百合几丁质酶基因的抗病功能研究奠定基础。
1 材料和方法
1.1 实验材料及处理
本研究选取的植物材料为课题组收集的东方百合‘索邦’、新铁炮百合‘雷山3号’以及亚洲百合‘穿梭’,它们分别对灰霉病的抗性水平为高抗、中感和高感[3],将其种植于浙江理工大学人工气候室中,栽培期间为长日照条件(光照/黑暗:16 h/8 h),昼/夜温为 25 ℃/18 ℃,通风良好,定期浇水。灰霉菌(B.elliptica, 菌株编号为ACCC36423)由百合叶片上分离纯化获得,购买于中国农业微生物菌种保藏管理中心。菌株接种在马铃薯葡萄糖琼脂培养基上,并将培养基置于25 ℃的恒温培养箱中黑暗培养,10 d后用于百合叶片的接种试验。
在百合现蕾期,分别选取上述3个品种健康完整无病害的叶片进行菌块接种。首先将叶片放入底面铺有2层湿润纱布的培养皿中,用无菌打孔器从培养基中切取大小一致的菌块(菌丝面朝下)接种于叶片背面,对照接种大小一致、不含灰霉菌的培养基,将接种后的叶片置于塑料托盘中,喷洒少量无菌水后使用保鲜膜密封保湿,于25 ℃条件下的培养箱中黑暗培养。依据前期研究结果[29],分别于未接种(0 h),接种6、12、24、48和72 h后收集叶片。为探究LoChi2基因能否对外源激素做出响应,使用0.1 mmol/L SA和0.1 mmol/L JA溶液分别喷洒‘索邦’百合叶片,对照喷洒无菌水,采样时间同上述灰霉菌处理一致[30]。所有处理在同一时间点均收集3片叶子,各时间点重复3次,液氮速冻后将样品保存在-80 ℃冰箱中以备提取RNA进行后续试验。
1.2 方 法
1.2.1 RNA的提取与cDNA的合成使用RNA快速提取试剂盒(RN38,艾德莱生物,北京)提取百合叶片中的总RNA,操作流程参照试剂盒说明书。RNA浓度与纯度通过NanoDrop 2000分光度计(Thermo Fisher Scientific,美国)与1%琼脂糖凝胶电泳确认,检测合格的RNA进行cDNA合成,操作方法参见反转录试剂盒(FSQ-301,Toyobo,日本)说明书。
1.2.2LoChi2基因编码序列的克隆根据转录组测序获得的LoChi2基因序列,设计克隆引物F1/R1(表1),进行PCR扩增。扩增反应体系为50 μL,包含1 μL cDNA模板、5 μL dNTP(2 mmol/L)、3 μL MgCl2(25 mmol/L)、5 μL PCR 缓冲液(10×)、1 μL高保真PCR酶(1 U/μL)(KOD-401,Toyobo,日本)、32 μL ddH2O以及上下游引物(10 μmol/L)各1.5 μL。扩增程序为:94 ℃预变性2 min, 之后98 ℃ 10 s、68 ℃ 1 min进行45个循环反应,最后68 ℃延伸10 min。割胶回收PCR产物,将回收的cDNA依据试剂盒说明书(VT205,天根生化,北京)连接到pLB载体上。随后将重组质粒转入大肠杆菌感受态,菌液PCR鉴定出阳性克隆,委托北京睿博兴科生物技术有限公司测序,获得编码序列。
1.2.3LoChi2基因系统进化分析基于几丁质酶的氨基酸序列,采用MEGA6.0最大似然法的方式构建系统进化树(Bootstrap = 1 000),以NCBI数据库下载的17条拟南芥几丁质酶序列(本研究将其编号为AtChi1-AtChi17,表2)为参考标准,对百合LoChi2及其同源基因进行分类。
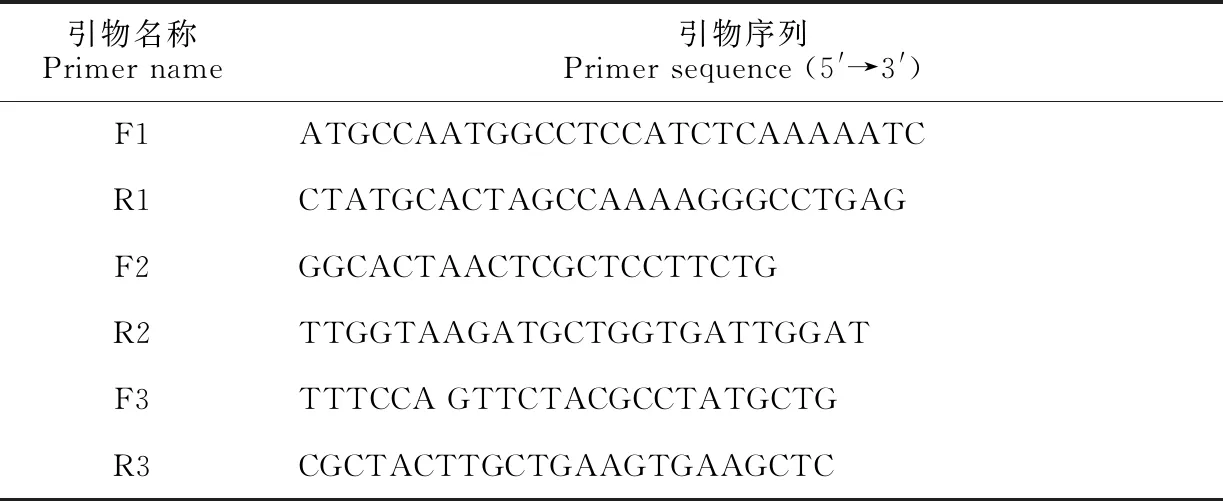
表1 引物序列表

表2 拟南芥不同类别几丁质酶信息
1.2.4 LoChi2蛋白的生物信息学分析利用在线网站(https://web.expasy.org/cgi-bin/protparam/protparam)预测LoChi2蛋白的理化性质。利用SignalP(http://www.cbs.dtu. dk/services/SignalP/)、NetPhos(http://www.cbs. dtu.dk/services/NetPhos/)和NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)分别预测蛋白的信号肽、磷酸化和糖基化位点。利用TMPRED(https://embnet.vital-it.ch/software/TMPRED_form.html)预测蛋白的跨膜结构域。利用在线网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和(https://swissmodel. expasy.org/interactive)分别预测蛋白的二级和三级结构。利用TargetP(http://www.cbs.dtu. dk/services/TargetP-1.1/index.php)进行亚细胞定位的预测。
1.2.5LoChi2基因的表达分析以百合真核延伸因子基因EF1(Eukaryotic elongation factor 1, NCBI登录号KJ543461)为内参,分别设计LoEF1和LoChi2的荧光定量引物F2/R2和F3/R3(表1),以灰霉菌或SA/JA处理后的叶片组织cDNA为模板,参照SYBR Premix ExTaqTMⅡ(TaKaRa, 宝生生物,大连)说明书,配制qRT-PCR反应液,使用CFX Connect Real-Time PCR Detection System(Bio-Rad,美国)进行扩增反应,反应程序为:95 ℃预变性3 min, 随后95 ℃变性10 s、60 ℃(LoChi2)/55.0 ℃(LoEF1)值条件下反应30 s,72 ℃延伸30 s,共进行40个循环反应,之后以每5 s升温0.5 ℃的速度从65 ℃升至95 ℃,获得扩增产物的熔解曲线。每份样品进行3次技术重复,利用2-ΔΔCt计算LoChi2基因的相对表达量,数据以平均值±标准差(SD)的形式表示,在SPSS17.0中通过单变量方差分析(One-way ANOVA)计算不同处理与对照之间基因表达水平的显著性差异。
2 结果与分析
2.1 LoChi2基因的克隆、氨基酸序列比对与系统进化分析
采用RT-PCR的方法,以‘索邦’百合叶片cDNA为模板,获得了一条清晰的扩增条带,片段大小与预期相一致,经纯化回收、连接转化和测序,成功得到‘索邦’几丁质酶基因完整的编码区序列,长度为915 bp,编码304个氨基酸。将其氨基酸序列提交至NCBI在线Blastn检索,下载同源性较高的候选序列,使用DNAMAN 9.0软件进行序列的多重比对。如图1所示,‘索邦’几丁质酶基因编码的氨基酸序列与同属植物麝香百合LlChi2的氨基酸序列同源性最高,其次是菠萝(Ananascomosus)AcChi2、梅花(Prunusmume)PmChi2和烟草(Nicotianatabacum)NtChi2,序列相似度分别为90%、64%、63%和62%,因此将其命名为‘索邦’LoChi2,NCBI登录号为MW310626。通过分析LoChi2与其同源基因编码氨基酸序列的保守结构域,发现他们无几丁质酶结合结构域,无C-端延伸区,但具有GH-18家族典型的结构特征:存在1个GH-18 narbonin催化结构域及8个糖类物质结合位点(图1)。
为进一步明确LoChi2在几丁质酶家族中所属类别,本研究构建了几丁质酶氨基酸序列的系统发育树(图2),该系统进化树包含了拟南芥几丁质酶GH-18和GH-19家族共5类(Ⅰ~Ⅴ)成员,依据拟南芥中的分类情况,百合LoChi2及其同源基因AcChi2和PmChi2与拟南芥GH-18家族第Ⅲ类成员AtChi1、AtChi8和AtChi9亲缘关系较近,聚为一簇,与其他结构类型的几丁质酶关系较远,表明LoChi2属于GH-18家族Ⅲ类几丁质酶成员。
2.2 LoChi2蛋白结构特征与亚细胞定位分析
蛋白质的理化性质分析表明LoChi2蛋白的分子量为32.52 kD,原子组成为C1480H2204N358O461S4,理论等电点为4.16,不稳定系数为27.43,平均亲水性为0.10,预测LoChi2是一个稳定的疏水蛋白。功能位点预测发现LoChi2存在1个潜在的信号肽断裂位点,1个糖基化位点以及多个磷酸化位点。跨膜结构域预测显示LoChi2蛋白共有10个跨膜区域,其中有7个由内到外的蛋白跨膜区域和3个由外到内的跨膜区域,推断LoChi2属于跨膜蛋白(图3,A)。另外,二级结构预测表明LoChi2含有38.82%的α-螺旋,18.09%的β-折叠,17.76%的延伸链,36.84%的不规则卷曲;进一步分析其三维结构,发现LoChi2的立体结构外形类似椭圆状(图3,B),与目标模板(SMTL ID: 4rl3.1)结构的相似度为60.53%,主要结构元件为α-螺旋和不规则卷曲,与二级结构预测结果一致。同时对LoChi2进行亚细胞定位分析,结果显示该蛋白作为分泌蛋白分泌于细胞外的可能性最大,概率高达99%,推测LoChi2可能定位于细胞外。
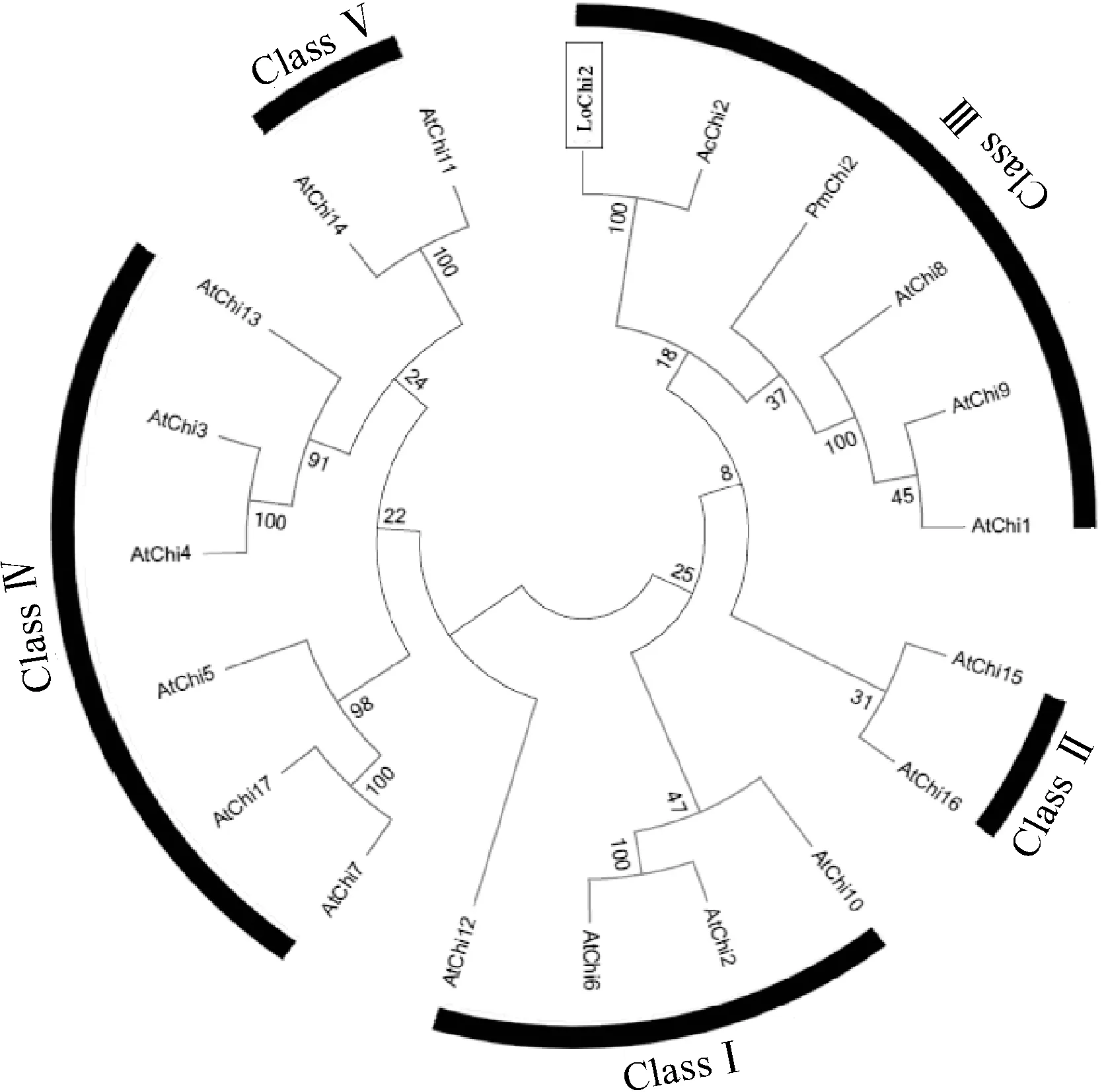
图2 百合与其他植物几丁质酶基因编码氨基酸 序列的系统进化树Fig.2 Phylogenetic tree based on the amino acid sequences of chitinase genes from lily and other plants
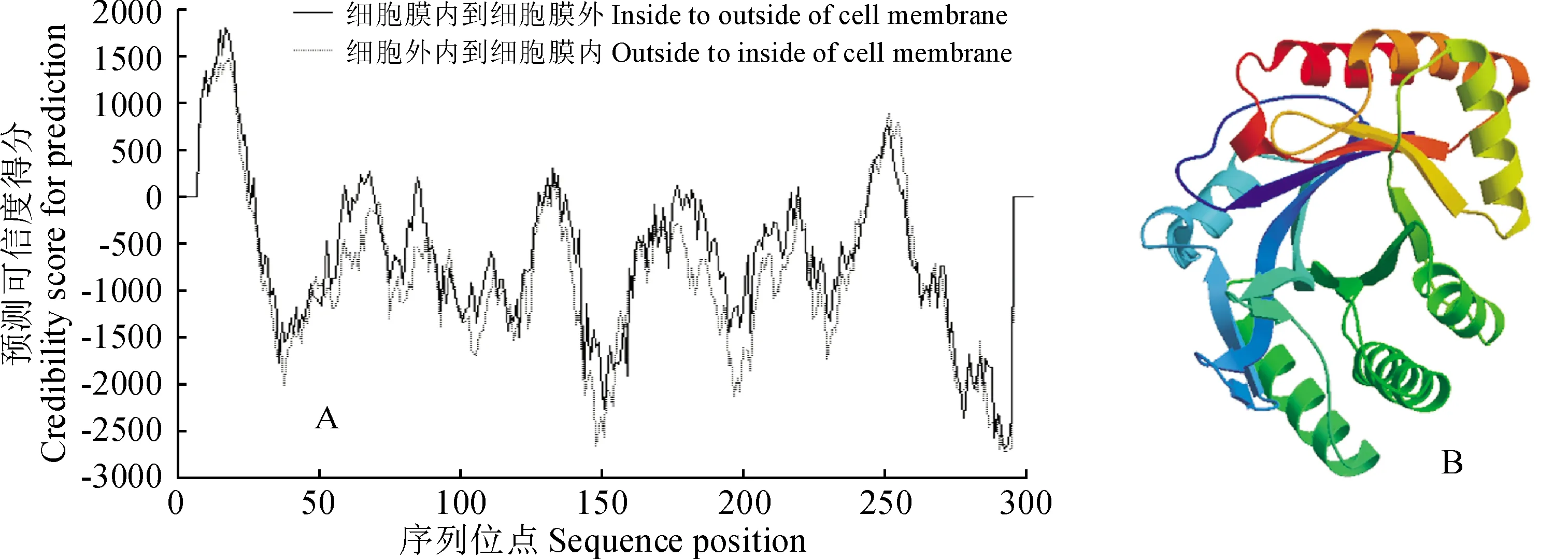
图3 LoChi2蛋白质跨膜区(A)及其三级结构(B)的预测Fig.3 Transmembrane (A) and tertiary structure (B) predictions of LoChi2 protein
2.3 不同抗性百合接种灰霉菌后LoChi2基因的表达分析
为比较不同抗性百合‘索邦’、‘雷山3号’和‘穿梭’中LoChi2基因在转录水平上响应灰霉菌侵染的差异,本研究对这3种百合进行了qRT-PCR分析。结果表明:接种灰霉菌后,LoChi2基因在3种百合中均能被诱导,表达量各有不同程度的增加(图4)。在高感百合品种‘穿梭’中,接种6 h后LoChi2的表达量微微上调,24 h后达到峰值,表达量与对照相比增加了2.6倍,在这之后表达量显著降低,差不多降至初始水平。而在中感和高抗百合中,表达量在接种6 h后显著增加,并在之后维持着较高的水平。其中,中感百合‘雷山3号’在整个接种期呈现先增加后降低的表达趋势,接种48 h后表达量最大,约为对照的15倍;高抗百合‘索邦’在整个接种期内表达量较为多变,呈现先增加后降低,再增加又降低的折线变化趋势,于接种12 和48 h后出现峰值,分别为对照的25 和23倍。整体来看,接种灰霉菌12、24、48和72 h后,‘索邦’中LoChi2基因表达量的增加幅度要明显高于‘雷山3号’和‘穿梭’,分别为‘雷山3号’的4.5、1.3、1.5和1.5倍,‘穿梭’的25.0、3.7、20.9和10.3倍。
2.4 SA/JA处理条件下LoChi2基因在百合中的表达分析
许多几丁质酶家族成员通过植物激素信号转导途径参与植物抗病反应,因此进一步分析了LoChi2基因对外源激素JA和SA的响应情况。结果表明:LoChi2基因在SA和JA分别处理后的‘索邦’叶片中均有不同程度的上调表达(图5)。JA处理6 h后,LoChi2的表达量显著增加,在12 h处微微下调,之后又迅速增加,48 h达到峰值,约为对照的7.9倍。相比而言,LoChi2对SA的响应要迟缓,SA处理6 和12 h后,LoChi2的表达量变化较小,直至24 h后开始明显增加,78 h表达量增至最高,约为对照的8.1倍。

星号代表处理与对照之间基因表达水平存在显著性差异 (*. 0.01 < P < 0.05, **. P < 0.01)。下同图4 不同抗性百合接种灰霉菌后叶片中 LoChi2基因的表达分析Asterisks indicate significant differences of gene expression levels between treatments and CK (*. 0.01 < P < 0.05, **. P < 0.01). The same as belowFig.4 Expression analysis of LoChi2 gene observed from lily leaves with different levels of resistance after inoculation with B. elliptica.

图5 JA/SA处理下LoChi2基因的表达分析Fig.5 Expression analysis of LoChi2 gene in response to JA/SA treatments
3 讨 论
植物受病原菌侵染后,诱导表达的几丁质酶蛋白能够直接与病原体的侵染结构接触,抑制、干扰病菌的生长进程,激发植物产生系统获得性抗性,发挥广谱抗病作用。植物中不同类型的几丁质酶在结构上存在较大差异,Ⅰ类几丁质酶成员在N末端存在几丁质结合结构域和C末端催化结构域,这两个结构域中间包含一段链接区域。Ⅱ类成员的催化域同Ⅰ类具有较高同源性,但缺乏几丁质结合域和链接区域。Ⅲ类和Ⅴ类成员与其他类成员序列相似度较低,但均具有GH18 narbonin催化结构域。Ⅳ类与Ⅰ类较为相似,但几丁质结合结构域和催化结构域的长度均小于Ⅰ类[6]。本研究从东方百合‘索邦’中分离到了1个几丁质酶基因LoChi2(MW310626)完整的编码区序列,大小为915bp,编码304个氨基酸残基。蛋白保守结构域和系统进化分析发现LoChi2属于GH-18家族的Ⅲ类几丁质酶成员,存在保守的GH18 narbonin催化结构域、跨膜结构域以及信号肽、糖基化、磷酸化位点,预测为疏水的分泌蛋白,且定位于细胞外。这一结果与杨郁文等[31]研究类似,他们发现棉花(Gossypiumhirsutum)Ⅲ类几丁质酶成员也为分泌蛋白,且具有信号肽位点,定位于细胞外。周洁等[32]在柳树(SalixJiangsuensis2345)中获得了1个Ⅲ类几丁质酶基因的全长cDNA 序列,该序列编码的蛋白为疏水蛋白,具有GH-18家族特征性催化结构域,进一步证明了不同植物中Ⅲ类几丁质酶的保守性。此外,朱晨等[20]发现茶树Ⅰ类几丁质酶成员也具有多个磷酸化位点,由此推测不同类型几丁质酶成员在蛋白翻译中可能发生过多次磷酸化修饰。
病原菌侵染后,多数情况下抗病品种中几丁质酶的表达量要高于感病品种。例如,Ebrahim等[33]发现接种镰刀菌后,抗病芒果(Mangiferaindica)品种中几丁质酶活性要远远高于感病品种,因此认为几丁质酶活性可作为筛选抗病和感病品种的标记,在抗病和感病荔枝(Litchichinensis)品种中也存在同样的现象[34]。基因表达方面,Vasanthaiah等[35]发现,葡萄几丁质酶基因在抗病品种中的高效表达是其产生高抗性,抵御炭疽病的重要原因之一。同样,棉花[31]和甘蔗[36](Saccharumofficinarum)几丁质酶基因在抗性品种中表达水平也要高于感病品种。本研究发现,在高抗品种‘索邦’和中感品种‘雷山3号’叶片接种灰霉菌6、12、24、48和72 h后,LoChi2基因的相对表达量大幅度增加,且‘索邦’明显高于‘雷山3号’,而高感品种‘穿梭’仅在接种6、24和72 h处有明显增加,增加幅度较为平稳。百合中LoChi2基因的转录水平与品种间抗病性呈现出正相关,说明LoChi2是参与灰霉菌防御反应的关键抗病基因。
几丁质酶的表达受抗病相关激素JA和SA的调节,异源表达某些几丁质酶基因会导致转基因植物激素信号通路的改变,从而影响其对病原菌的抵御能力。前人通过对马铃薯喷施JA和SA发现有3个几丁质酶基因的表达量在处理24 h以内显著增加[14],外源喷施SA和JA还可诱导茶树[37]、花生[38]和小麦[39](Triticumaestivum)中几丁质酶基因的表达,增强植株抵御病虫害的能力。在拟南芥中过表达草莓几丁质酶基因Chit2可通过激活SA通路关键防御基因PR1(Pathogenesis-related protein 1)以及JA通路关键基因PDF1.2(Plant defensin 1.2)的表达来提高转基因植株对炭疽病的抗性[40]。本研究中,LoChi2基因表达量在JA和SA处理后的‘索邦’百合叶片中均有不同程度的增加,暗示了该基因可能在这两条抗病信号通路中扮演着重要角色。
灰霉菌与植物的互作非常复杂,它是很多基因相互作用的过程[28],几丁质酶作为一类重要的病程相关蛋白,在植物抗灰霉病转基因育种中具有潜在的优势。郭林霞等[23]发现转杜仲(Eucommiaulmoides)几丁质酶基因EuChit1番茄提高对灰霉病的抗性,与抗氧化酶SOD、POD和CAT活性提高以及病程相关基因PR1、PR2和PR5表达量上调密切相关。Núez deGonzlez等[41]将水稻几丁质酶基因RCH10成功转入了百合品种‘Star gazer’中,对9个转基因株系的叶片接种灰霉菌后测定孢子数量,发现所有株系均极显著低于野生型,各株系对灰霉病的抗性水平与RCH10基因的表达量呈正相关,并且在营养生长和生殖生长阶段植株的表型性状,包括株高、茎粗、叶片和种球大小以及花色、花量和花期并未发生明显改变。类似研究在矮牵牛中也获得了成功,转几丁质酶基因的矮牵牛对灰霉病抗性显著强于野生型, 且叶片中蛋白提取液能够有效抑制灰霉菌菌丝生长[22]。由此推测LoChi2基因在百合抗灰霉病育种方面具有广阔的应用前景。
综上所述,高抗百合品种‘索邦’中的几丁质酶基因LoChi2具有植物GH-18家族Ⅲ类成员典型的结构特征。灰霉菌侵染后,LoChi2在抗病百合品种中的表达量显著高于感病品种,且受外源激素JA/SA诱导表达。根据试验结果推测LoChi2是参与百合灰霉病防御反应的关键抗病基因,随着百合基因工程技术的不断发展,LoChi2将成为百合抗灰霉病转基因育种中新的候选基因。
