转HSSP基因大豆的分子检测和遗传稳定性分析
2021-06-22郭丹丹周静文马晓飞王思楠
郭丹丹,周静文,刘 洋,马晓飞,王思楠,樊 荣,柏 锡
(东北农业大学 生命科学学院, 哈尔滨 150030)
大豆(Glycinemax)富含蛋白质和脂肪,是重要的粮食和油料作物。全世界约75%的大豆主要用于动物饲料[1],是人类和动物主要的蛋白质来源。大豆氨基酸组成中含硫氨基酸(蛋氨酸、半胱氨酸)相对不足,不利于单胃动物的生长和发育[2]。同时还可能降低动物对疾病的抵抗力。有研究表明,含硫氨基酸缺乏可能阻碍儿童的身心发育[3-4]。
富含硫的异源种子贮藏蛋白在转基因大豆中的表达可以改善大豆营养品质[5]。Kim等[6]将种子特异性菜豆β-菜豆蛋白启动子驱动的18 kD玉米醇溶蛋白基因转入大豆中,使大豆种子中蛋氨酸和半胱氨酸含量增加12%~20%。Li等[7]将27 kD γ-玉米醇溶蛋白基因导入大豆,使种子中的半胱氨酸含量从26.97%增加到29.33%,蛋氨酸含量从15.49%增加到18.57%。另外,将CGS基因转入拟南芥,使得种子游离蛋氨酸含量增加8~20倍[8-9]。10 kD玉米醇溶蛋白富含含硫氨基酸,将其转入枯草芽胞杆菌益生菌中,能使菌体蛋氨酸含量提高20.51%[10]。
培育的转基因作物新品种在商品化之前,对目的基因的整合和表达情况的检测是必不可少的。外源基因的旁侧序列是针对不同转化事件的唯一性标识,对研究转基因作物的遗传稳定性和转基因作物的产权保护、检测和监管均具有重要价值[11]。在已知旁侧序列位置的基础上建立事件特异性检测方法是区分不同转化事件的高效准确检测方法。Fan等建立了针对旁侧序列和转基因的事件特异性方法,用于鉴定一个特定的转基因番木瓜株系。
韩庆梅等[12]研究了高蛋氨酸转AtD-CGS基因大豆后代植株的遗传稳定性。胡英迎等[13]对转精氨酸酶基因玉米进行遗传特性分析。Liu等[14]研究Bt融合蛋白Cry1Ab/Cry2Aj基因在转基因玉米事件ZD12-6中可在不同世代下稳定表达。
实验室前期将10 kD玉米醇溶蛋白进行密码子改造,并融合大豆球蛋白2基因启动子,筛选标记基因为Bar,采用农杆菌介导法转入到受体品种‘东农50’中,获得大量转基因材料。本研究以筛选得到的单拷贝转基因材料GSDH5为试材,基于目的基因的旁侧序列确定其插入位置,并在基因水平、转录水平、翻译水平和性状表现等方面评价转基因大豆材料的遗传稳定性和性状表现,建立GSDH5的特异性检测方法,为培育高含硫氨基酸转基因大豆新品种奠定基础。
1 材料和方法
1.1 材 料
转基因大豆材料GSDH5由本实验室扩繁保存,受体品种‘东农50’由东北农业大学大豆研究所提供。
1.2 实验方法
田间试验分别于2018-2019年在东北农业大学转基因试验基地进行。对T3、T4代GSDH5及‘东农50’采取正常密度人工点播,行距0.5 m,行长18 m,每4垄为一个小区,转基因田间栽培管理按照《农业转基因生物安全评价管理办法》的要求进行。
1.2.1 PCR检测提取基因组DNA参考黄宣等[16]优化的CTAB法,根据HSSP基因序列设计正反向引物(5′-CAGGGTCTCGCTTCAC-3′和5′-GTCATAGCCATAGGGTTG-3′),Bar基因序列设计正反向引物(5′-TGCCAGTTCCCGTGCTTGAA-3′和5′-CTGCACCATCGTCAACCACTA-3′)进行基因组DNA分子检测。反应条件:94 ℃预变性10 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,30 个循环;72 ℃延伸10 min。
1.2.2 Southern blot分析使用DIG DNA Labeling and Detection Kit (Roche)试剂盒,按照试剂盒说明书进行,验证目的基因HSSP在转基因植株基因组中的整合情况。
1.2.3 RT-PCR检测采用康为世纪RNA提取试剂盒提取大豆的总RNA(方法参照说明书进行),反转录采用反转录试剂盒进行,HSSP基因引物同1.2.1,GmTUA5为内参基因,引物序列(5′- ACCACCAGGAACAACAGAAGG-3′和5′-TGCCACCATCAAGACTAAGAGG-3′),反应条件同1.2.1。
1.2.4 Real-time PCR检测按照TransStart Top Green qPCR Super Mix Kit(全式金生物)试剂盒说明书进行,HSSP基因引物同1.2.1,内参基因引物同1.2.3,反应条件:95 ℃预变性30 s;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸15 s,40 个循环;95 ℃变性30 s;60 ℃退火30 s。以2-ΔΔCT算法计算HSSP基因的相对表达量。
1.2.5 基因组插入位点分析使用限制性内切酶DraⅠ对基因组DNA进行完全酶切,连接Adpator接头,建立基因组DNA文库。以AP1/L1405为引物(GTAATACGACTCACTATAGGGC和CTGCACCATCGTCAACCACTACAT),进行文库第一轮扩增。以第一轮PCR扩增产物为模板,AP2/L997为引物(ACTATAGGGCACGCGTGGTC和CTGGCATGACGTGGGTTTCT),进行第二轮扩增,直到得到单一条带,测序结果在NCBI网站(http://www.ncbi.nlm.nih.gov)上进行Blast比对。反应条件:94 ℃ 25 s,72 ℃ 3 min,7 个循环;94 ℃ 25 s,67 ℃ 3 min,32 个循环;67 ℃ 7 min。
根据测序获得的旁侧序列,在大豆基因组和外源T-DNA插入位点之间设计特异性检测引物GSDH5-F(TCGTTTCCCGCCTTCAGTTT)和GSDH5-R(GACAGCACAAAGAACGCAGC),在插入T-DNA区前的大豆基因组序列上设计‘东农50’对照检测引物DN50-F(AGCACTGACCGACCAAATGT)和DN50-R(AACTGACTAACCCTTCCGCA),对GSDH5转化事件、其他转化事件及非转化事件进行PCR扩增。 反应条件:94 ℃预变性10 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃延伸10 min。
1.2.6 Western blot检测大豆籽粒研磨成粉末取0.1 g于2 mL EP管中,加入60%乙二醇,震荡混匀5 min,水浴锅50 ℃孵育1 h提取种子醇溶蛋白,6 000 r/min离心10 min,取上清液加入SDS上样缓冲液,煮沸变性5 min。取上清液15 μL于15% SDS-PAGE进行电泳,转至PVDF膜,进行Western blot检测,一抗为HSSP抗血清(1∶500),二抗为山羊抗兔IgG/HRP(1∶2000),滴加ECL化学发光液,化学发光仪显影0.1~10 s,拍照。
1.2.7 粗蛋白含量测定大豆籽粒粉碎后,委托中国农业科学院饲料研究所测定粗蛋白含量。
1.2.8 含硫氨基酸含量测定大豆籽粒粉碎后,委托中国农业科学院饲料研究所测定含硫氨基酸含量,根据公式计算占种子干样及蛋白的比例。蛋氨酸/胱氨酸占种子干样/蛋白计算公式:
粗蛋白在干样中含量(Z):Z=Y/(1-X/100)
蛋氨酸/胱氨酸占干样比例(B):B=A/(1-X/100)
蛋氨酸/胱氨酸占蛋白比例(C):C=B/(Z/100)
其中,A为蛋氨酸/胱氨酸占鲜样比例, Y为粗蛋白含量, X为含水量。
1.2.9 农艺性状调查大豆成熟、收获后对转基因株系GSDH5和受体品种‘东农50’进行考种,调查主要的农艺性状。
1.3 数据分析
采用 Origin 2018软件进行数据的处理与分析。
2 结果与分析
2.1 转基因大豆GSDH5的分子检测
2.1.1 PCR检测对T1代的GSDH5株系及受体品种‘东农50’涂抹靶标除草剂草铵膦进行初步抗性筛选,对筛选后呈阳性的转基因大豆株系及受体品种‘东农50’提取DNA进行PCR检测,阳性对照及转基因大豆均可扩增出263 bp的目的基因部分片段(图1,A)和414 bp的标记基因部分片段(图1,B),受体品种‘东农50’未能扩增出任何条带。结果表明,外源基因HSSP和筛选标记基因Bar成功整合到大豆基因组中。

A、B.T1代植株DNA检测(M.DL2000):+.阳性质粒;—.东农50;A.HSSP基因检测(1-8.转基因植株); B.Bar基因检测(1-10.转基因植株);C、D.T1代植株Southern blot检测(M′.DL15000);C:1-2.东农50;3.Xba Ⅰ酶切产物; 4.Hind Ⅲ 酶切产物;D:1.Xba Ⅰ酶切产物;2.Hind Ⅲ 酶切产物;3.东农50;E.转基因大豆GSDH5的T-DNA区图谱图1 转HSSP基因材料的分子检测A and B. DNA detection of T1 generation plants (M. DL2000): +. Positive plasmid; —. Dongnong 50; A. HSSP gene detection: (1-8. Transgenic plants); B. Bar gene detection (1-10 transgenic plants); C and D. Southern blot detection of T1 generation plants (M′. DL15000). C: 1-2. Dongnong 50; 3. Xba Ⅰ digestion product; 4. Hind Ⅲ digestion product. D: 1.Xba Ⅰ digestion product; 2. Hind Ⅲ digestion product; 3. Dongnong 50. E. T-DNA map of transgenic soybean GSDH5Fig.1 Molecular detection of transgenic HSSP materials
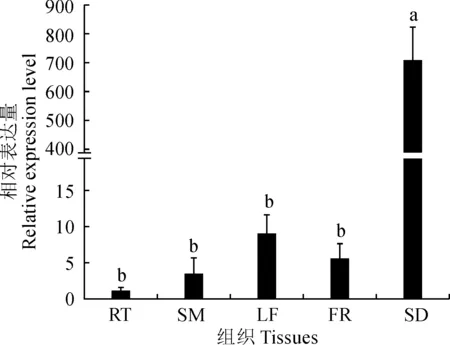
RT.根;SM.茎;LF.叶;FR.花;SD.种子。不同小写字母表示 基因表达量在不同组织中有显著差异(P<0.05)图2 HSSP基因在转基因大豆不同组织中的表达量RT. Root; SM. Stem; LF. Leaf; FR. Flower; SD. Seed. Different normal letters indicate that there are significant differences of gene expression levels among different tissues (P< 0.05)Fig.2 Expression of HSSP gene in different tissues of transgenic soybean
2.1.2 Southern blot检测为了进一步证明外源基因在大豆中的整合情况,确定外源基因的拷贝数,根据转基因大豆GSDH5的T-DNA区图谱(图1,E),选取HindⅢ和XbaⅠ两种限制性内切酶,Bar基因和HSSP基因两种探针,进行Southern blot检测。结果显示,经过酶切的转基因大豆基因组DNA和阳性对照与Bar基因探针/HSSP基因探针杂交后均出现了单一条带,而受体品种‘东农50’无杂交条带形成(图1,C、D)。证明外源基因HSSP以单拷贝的形式整合到大豆基因组中。
2.1.3HSSP基因种子特异性表达分析提取转基因大豆不同组织部位根、茎、叶、花、种子的RNA,利用Real-time PCR检测外源基因HSSP的表达量,结果(图2)表明,在种子中HSSP基因表达量显著高于根、茎、叶、花,证明外源基因HSSP在转基因大豆种子中特异性表达。
2.1.4HSSP基因插入位点分析提取GSDH5的基因组DNA,用DraⅠ进行完全酶切,连接Adpator构建GSDH5基因组DNA文库。以AP1/L1405 为引物,进行文库第一轮扩增(图3,A)。以第一轮PCR扩增产物为模板,AP2/L997为引物,进行第二轮扩增,得到大约963 bp单一条带(图3,B)。第二轮PCR产物回收进行测序。将载体序列去掉后,结果提交NCBI数据库,在GlycinemaxWm82.a2.v1 基因组数据中进行BLASTN搜索(图3,C)。结果表明,该序列与1号染色体52 873 248~52 873 883 bp匹配,并且落到了非编码区域,确定了T-DNA区插入到大豆1号染色体基因组的52 873 883 bp处。
2.2 转基因大豆GSDH5遗传稳定性分析
2.2.1 特异性PCR检测特异性引物设计在转基因大豆GSDH5的外源T-DNA序列和大豆基因组之间,其他转基因材料和受体‘东农50’不会扩增出特异性条带,只有GSDH5能扩增出预期大小约395 bp的片段。而对照引物设计在插入T-DNA区前的大豆基因组序列上,仅有受体‘东农50’能扩增出728 bp的片段,转基因材料无法扩增出产物。证明引物对GSDH5-F/GSDH5-R可以特异性识别转基因大豆GSDH5(图4,A)。
2.2.2 RT-PCR检测采用RT-PCR检测T2、T3和T4代转基因大豆中外源基因HSSP和内参基因TUA5的表达量。结果(图4,B)显示,在大豆籽粒中,外源基因HSSP在转录水平上稳定表达,且在T2、T3和T4稳定遗传。
2.2.3 Western blot检测为检测外源基因在翻译水平上的表达情况,从T3、T4代转基因大豆GSDH5的成熟籽粒中提取蛋白进行Western blot检测(图4,C),GSDH5在10 kD左右出现杂交条带,而非转基因大豆没有出现杂交条带,表明外源基因HSSP在翻译水平上稳定表达。
综合上述结果表明,外源基因HSSP在转基因大豆中稳定表达,并且在T2、T3和T4中稳定遗传。
2.3 转基因大豆GSDH5性状表现
2.3.1 转基因株系GSDH5的粗蛋白含量测定T3、T4代转基因大豆GSDH5和受体品种‘东农50’的粗蛋白含量。结果(表1)显示。在T3代中,测得‘东农50’粗蛋白含量为43.32%,GSDH5粗蛋白含量为43.03%,变幅0.6%。T4代中,‘东农50’粗蛋白含量为41.53%,GSDH5粗蛋白含量为40.18%,变幅3%。由于不同植株间粗蛋白含量不同,而蛋白积累也和当年的栽培条件、环境条件直接相关。本研究中粗蛋白含量并没有极大改变,没有达到影响其品质的结果,而对于这一性状的微量改变原因,也需要对其后代进行重复试验验证。
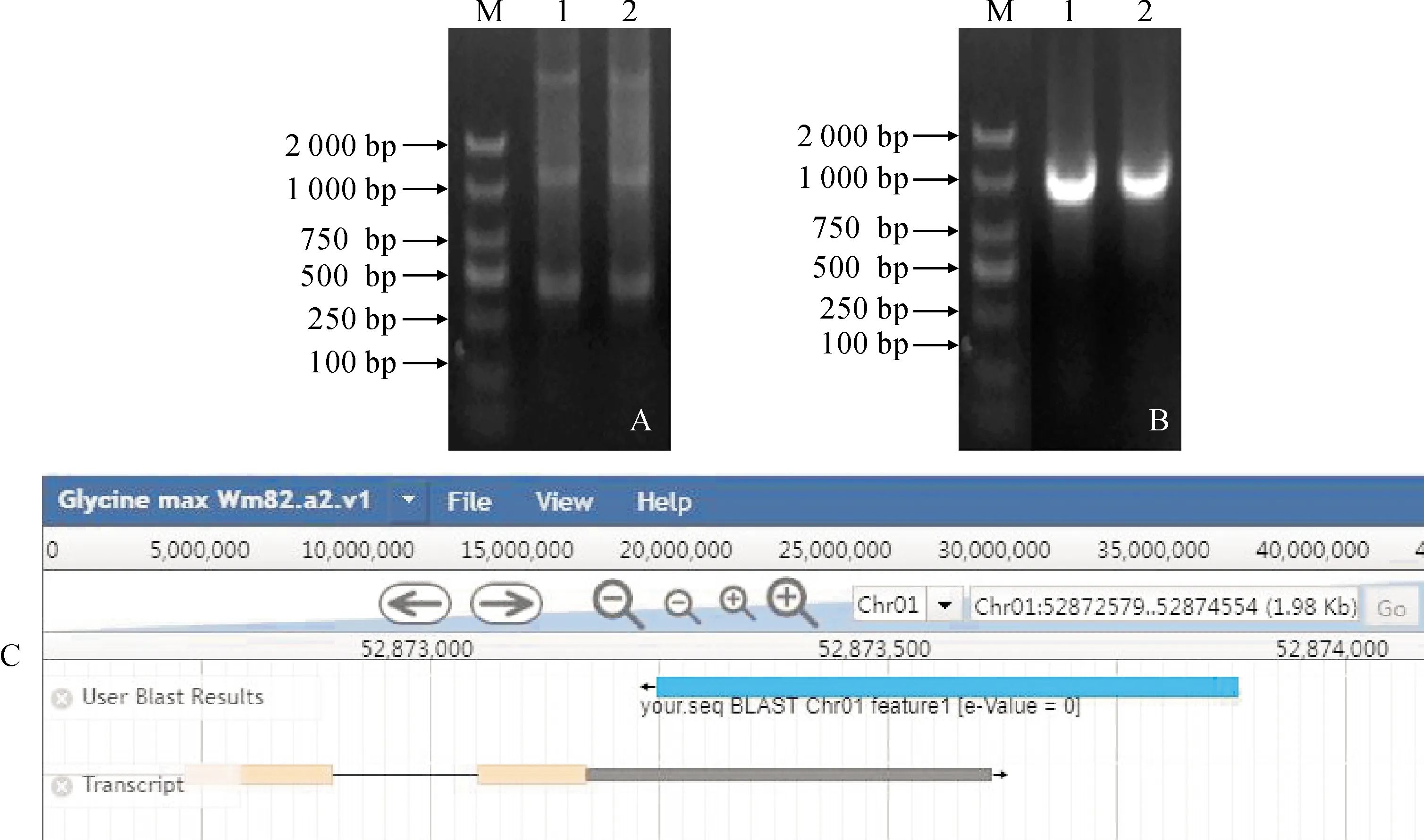
A、B.GSDH5基因组文库巢式PCR结果。M. DL2000;A.一轮PCR,引物对AP1/L1405;B. 二轮PCR, 引物对AP2/L997;C. 测序结果Blast 分析图3 HSSP基因插入大豆基因组旁侧序列分析A and B. Nested PCR results of GSDH5 genome library. M.DL2000; A. The first round of PCR, primer pair AP1/L1405; B. The second round of PCR, primer pair AP2/L997; C. Blast analysis of sequencing resultsFig.3 Analysis of the flanking sequence of HSSP gene inserted into soybean genome
2.3.2 转基因株系GSDH5的含硫氨基酸含量测定T4代转基因大豆GSDH5和受体品种‘东农50’的含硫氨基酸(蛋氨酸、胱氨酸)占种子干样/蛋白的比例。结果(表2)显示,转基因大豆GSDH5中胱氨酸占种子干样的比例为0.65%,甲硫氨酸占种子干样的比例为0.70%,与受体品种‘东农50’相比占比显著升高,其中胱氨酸增长了5%,甲硫氨酸增长了9%。胱氨酸占种子蛋白的比例为1.52%,甲硫氨酸占种子蛋白的比例为1.62%,与受体品种‘东农50’相比显著升高,其中胱氨酸增长了10%,蛋氨酸增长了25%。证明HSSP基因的导入增加了大豆中含硫氨基酸的含量。
2.3.3 主要农艺性状分析为了分析外源基因HSSP的导入是否会影响转基因大豆的株高、产量等性状,调查了T3、T4代转基因大豆GSDH5及受体品种‘东农50’的主要农艺性状。结果(表3)显示,转基因大豆的结荚习性为亚有限性,花色为白色,叶形为长叶,与受体品种‘东农50’表现一致。转基因大豆的生育期在121~125 d,株高略低于受体品种,而单株荚数高于受体品种,分枝数和百粒重均与受体品种相近。虽然在株高、单株荚数方面与受体品种略有差异,但都不存在显著性。说明外源基因的导入对大豆植株的生长发育无不良影响。
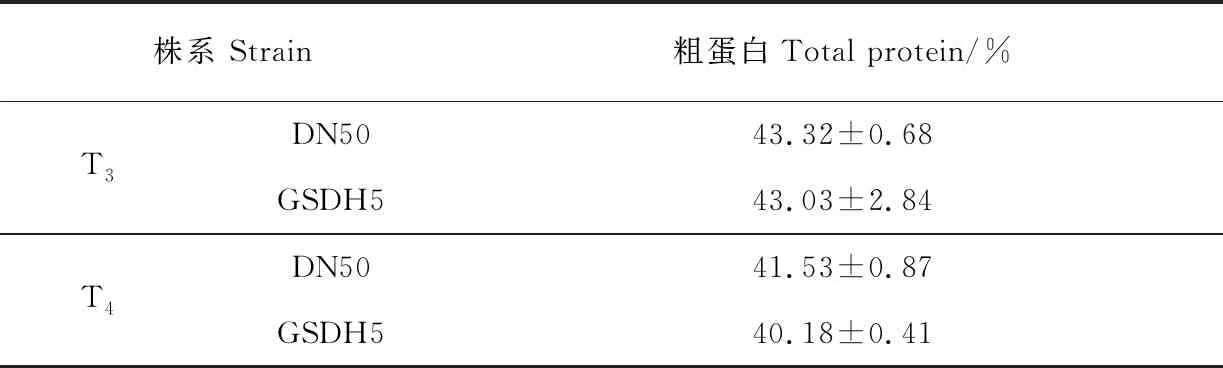
表1 GSDH5株系粗蛋白含量

A.T2、T3、T4代植株特异性PCR检测:M. DL2000;WT.东农50/其他转基因事件;1.转基因植株;2.东农50; B.T2、T3、T4代植株RT-PCR检测:WT.东农50;C. T3、T4代植株Western blot检测图4 转HSSP基因材料遗传稳定性检测A. Detection of plant specific PCR in T2, T3 and T4 generations: M. DL2000; WT. Dongnong 50/other transgenic events; 1. Transgenic plants; 2. Dongnong50; B. Detection of RT-PCR in T2, T3 and T4 generations: WT. Dongnong 50; C. Western blot detection of T3 and T4 generation plantsFig.4 Genetic stability test of HSSP transgenic materials
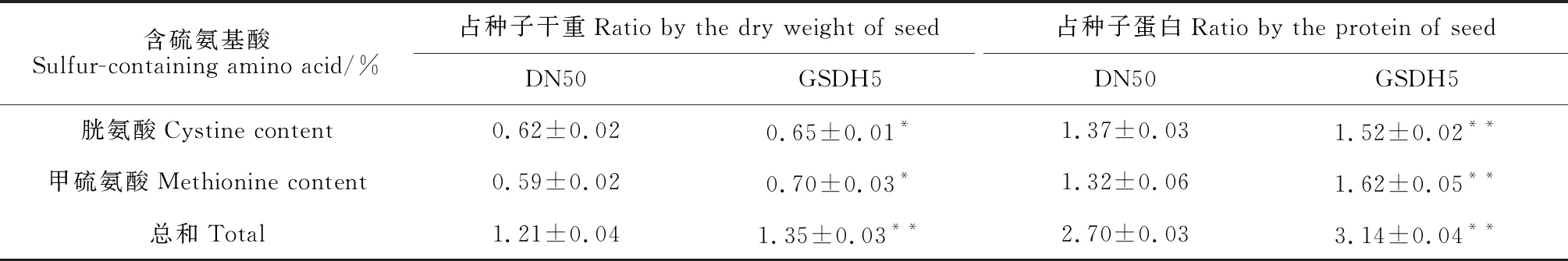
表2 GSDH5株系含硫氨基酸含量

表3 不同世代转基因株系GSDH5农艺性状调查结果
3 讨 论
商业化的植物转化体均具有良好的遗传稳定性的生物学特征。目前,已商业化的转基因植物一般具有抗虫、抗病的特性[17-18]。而对于提高含硫氨基酸的这种营养型转基因大豆多数研究仅停留在得到转基因植株,对其产业化应用价值未见报道。本研究以转HSSP基因大豆GSDH5为材料,测得转基因株系中含硫氨基酸占种子干样/蛋白的比例均显著升高,证明了通过异源表达高含硫氨基酸贮藏蛋白基因来提高大豆中含硫氨基酸含量是可行的。
外源基因整合在受体基因组中的位置、拷贝数是影响外源基因稳定遗传和表达的重要因素,在不同世代中,外源基因的遗传和表达的变化将影响转基因植株的使用价值[19]。韩庆梅等[12]对两个世代的高蛋氨酸转基因大豆的目的基因整合情况进行分析,证明AtD-CGS基因可在不同的遗传背景下稳定遗传与表达。张立坚等[20]研究了TaNAC14转基因小麦的遗传稳定性。本研究对转基因株系GSDH5进行PCR、Southern blot检测,证明外源基因是以单拷贝的形式成功整合到受体品种大豆基因组中。通过旁侧序列的分析,建立了转基因大豆GSDH5特异性检测方法。转化体特异性PCR不仅简单快捷,而且具有针对性,常用于鉴定外源基因在转基因株系后代中的遗传稳定性。RT-PCR和Western blot检测结果表明,外源基因在转录和翻译水平上稳定遗传和表达。在育种方面改变自然规律而产生毒害作用的报道出现很多,例如在提高含硫氨基酸含量后导致大豆品系产量低、品质性状下降的现象[21-22]。本研究中转基因大豆在含硫氨基酸提高的基础上,蛋白含量与受体品种相比有所下降,但是变化极小,没有达到影响其品质的结果。Hari B. Krishnan等[23]研究表明,使OASS过表达能够增加含硫氨基酸含量,但是会对植物生长产生负面影响。本研究对植物的农艺性状进行调查分析,在单株荚数、百粒重、株高、结荚习性、花色、叶形等方面均未发生较大改变,证明HSSP基因的插入没有导致不良性状出现。本研究对生产具有高甲硫氨酸含量并对其种子活力,植物生长和生产力造成最小干扰的转基因种子提供理论依据,为营养型转基因大豆产业的发展提供了基础材料。
