枸杞多糖对脂多糖诱导人视网膜色素上皮细胞凋亡的影响
2021-06-22马雅玲
闫 梅 , 马 倩 , 马雅玲 ,, 刘 媛 , 蒋 璐
(1.宁夏医科大学,银川 750004; 2.宁夏医科大学总医院眼科,银川 750004)
年龄相关性黄斑变性(age-related macular degeneration,AMD)是累及视网膜神经上皮层、色素上皮层、Bruch 膜及脉络膜毛细血管层的退行性病变,涉及氧化应激、光损伤、炎症、遗传基因等多种致病因素[1]。视网膜色素上皮(retinal pigment epithelium,RPE)位于神经视网膜与脉络膜之间,功能包括参与构成血-视网膜屏障、调节代谢物质的转运、吞噬感光细胞外节段、调节局部炎性反应、参与黄斑的免疫防御、保护视网膜免受过度光照等[2]。炎症、氧化应激等刺激可造成RPE 炎性反应损伤,导致RPE 吞噬功能下降,未消化的碎片持续存于胞浆,久之溢出并沉积于Bruch 膜和基底膜之间形成玻璃膜疣,导致萎缩性AMD,再进展造成Bruch 膜破坏,新生血管出现,形成渗出性 AMD[1,3]。有学者[4-7]研究发现,许多中药及药物存在抗炎的功效,例如姜黄素、七叶皂苷、汉黄苓素,血管紧张素转换酶激动剂等,并均采用脂多糖(lipopolysaccharide,LPS)诱导建立AMD 的细胞炎性反应模型 。
枸杞多糖(lycium barbarum polysaccharide,LBP)具有明确的抗炎、抗凋亡的作用,它可通过核因子-kB(nuclear factor-kB,NF-kB)通路调节炎症及凋亡,也能够通过抗凋亡机制发挥抗肿瘤作用[8-10]。本课题组前期研究[11-13]证实了LBP 对氧化应激造成视网膜神经节细胞的凋亡具有抑制作用。本实验以研究RPE 炎性反应为目标,应用LPS 诱导人视网膜色素上皮细胞-19(adult retinal pigment epithelial cells-19,ARPE-19)建立炎性反应模型,观察LBP 对细胞炎性反应及相关细胞凋亡的影响,探讨RPE 炎性反应机制,以期为AMD 的药物治疗及预防提供新思路。
1 材料与方法
1.1 材料
1.1.1 主要试剂 ARPE-19 细胞株(中科院上海细胞库)、LBP(宁夏沃福百瑞)、LPS(美国 Sigma)、胎牛血清(美国 Gibco)、DMEM-F12 培养基(美国Hyclone)、CCK-8 细胞增殖及毒性检测试剂盒(上海贝博)、Annexin V-FITC 凋亡检测试剂盒(上海贝博)、RT-PCR 逆转录试剂盒(Invitrogen)、SYBR Green qPCR Master Mix (DBI Bioscience)、总 RNA 提取试剂盒(北京天根)、引物(上海生工)、全蛋白提取试剂盒(凯基生物)、BCA 蛋白定量试剂盒(凯基生物)、化学发光高敏检测试剂盒(凯基生物)、人白细胞介素(interleukin,IL)-6、IL-1β 及单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的ELISA试剂盒(酶免,CAT:0049H2、0181H2、0081H2)、兔源多克隆抗体 Bax、Bcl-2(BIOSS,CAT:0127R、0032R)、鼠源单克隆抗体β-Actin(中杉金桥,CAT:TA-09)、羊抗兔 HRP 标记 IgG 抗体(Affinity,CAT:#S0001)、羊抗鼠 HRP 标记 IgG 抗体(索莱宝,CAT:SE131)。
1.1.2 仪器 Infinite M200 Pro 酶标仪(瑞士TECAN)、PowerPac 200 电泳仪、IQ5 RT-PCR 仪及ChemiDocTouch 化学发光成像系统(均购自美国 Bio-Rad)。
1.2 方法
1.2.1 ARPE-19 细胞培养 细胞于 37 ℃、5%CO2条件中培养,待细胞生长约为85%时使用0.25%含乙二胺四乙酸(EDTA)的胰蛋白酶进行消化,1200 r·min-1离心 5 min,1∶3 传代,加入完全培养基(10%胎牛血清,1%青链霉素混合液,89%DMEM-F12 培养基)接种于 T25 培养瓶中,2 d 换液 1 次,稳定传代后取 2~4 代用于实验。同时,细胞密度为85%时进行消化离心,加入冻存液,含10%二甲基亚砜(DMSO)、90%胎牛血清(FBS),重悬,放入-80 ℃冰箱冻存,次日投入液氮长期保存。
1.2.2 实验分组及处理 根据LBP 的不同浓度将细胞随机分为空白组,模型组,0.1、0.5、1 mg·mL-1LBP 组。所有分组加药前均使用不含血清的培养基饥饿24 h。空白组使用完全培养基培养,与其余组同时换液;模型组给予含10 μg·mL-1LPS的完全培养基刺激24 h;LBP 组分别给予含有0.1、0.5、1 mg·mL-1的 LBP 完全培养基培养 24 h后,再以同样造模方式给予10 μg·mL-1LPS 刺激24 h。
1.2.3 CCK-8 观察细胞活力情况 按CCK-8 试剂盒步骤细胞以浓度为5×103/mL-1接种于96 孔板中,培养24 h。设置对照孔、无细胞空白孔及实验孔,给予不同浓度 LBP 及 10 μg·mL-1LPS 后再培养24、48 和72 h。检测时加入10%CCK-8,37 ℃培养箱中避光孵育2 h,酶标仪450 nm 检测OD 值。
1.2.4 流式细胞仪观察细胞凋亡 使用6 孔板培养细胞,待密度至85%时按试剂盒步骤进行处理。使用不含 EDTA 的胰酶消化,300×g,4 ℃离心5 min 收集细胞,再用预冷PBS 洗涤细胞两遍,吸取400 μL Annexin V 结合液重悬细胞,浓度为1×106/mL-1,再重悬加入 5 μL Annexin V-FITC 染色液,混匀后避光条件下,4 ℃孵育15 min。再加入10 μL PI 染色液,4 ℃避光孵育 5 min,1 h 内流式细胞仪进行检测。
1.2.5 RT-PCR 检测细胞内凋亡相关因子的mRNA 表达量 上述各组细胞接受处理并收集后按照天根总RNA 提取试剂盒步骤过柱提取,提取后测定RNA 浓度,每组取等量RNA 参照Invitrogen 逆转录试剂盒步骤,进行逆转录合成为cDNA,-80 ℃保存。使用DBI SYBR Green qPCR Master Mix 试剂盒,按照步骤以cDNA 为模板进行实时荧光定量PCR 扩增。Bcl-2 引物序列:F为 GACTTCGCCGAGATGTCCAG;R 为 GAACTCAAAGAAGGCCACAATC。Bax 引物序列:F 为CGAACTGGACAGTAACATGGAG;R 为 CAGTTTG CTGGCAAAGTAGAAA。GAPDH 引物序列:F 为CAGGAGGCATTGCTGATGAT;R 为 GAAGGCTG GGGCTCATTT。反应体系为20 μL。采用试剂盒中标准三步法进行RT-PCR 扩增,反应条件为:预变性为 95 ℃时 2 min;PCR 反应为 95 ℃时10 s,50~60 ℃时 30~34 s,72 ℃时 30 s,共 40 个循环;熔解曲线为55~98 ℃时84 个循环。得出Ct值,以GAPDH 为内参,使用相对定量法,计算2-△△Ct值。
1.2.6 Western blot 检测相关因子蛋白表达水平 各组细胞接受处理后,根据全蛋白提取试剂盒步骤,冷PBS 洗涤细胞2 次,加入提前配制的裂解液并刮出细胞,收集放置冰上,间隔4 min震荡 1 次,每次持续1 min,循环 5 次,离心机12000 r·min-1,4 ℃离心 20 min 取上清液,依照试剂盒步骤进行蛋白定量。剩余按体积比加入上样缓冲液,放入100 ℃水中变性10 min 备用。配制10%SDS-凝胶,取30 μg 蛋白上样,加入电泳液,连接电泳仪调整电压为60 V 进行电泳,至玻璃板底部后打开切胶进行转膜(PVDF 膜、湿转、220 mA、60 min)。拿出后5%脱脂奶粉封闭4 h,洗膜(0.1%PBST5 min,重复 3 次)后一抗封闭过夜,第二天洗膜后二抗孵育2 h,再洗膜,取出并于表面滴加超敏化学发光液进行曝光。使用Image J 软件进行条带灰度值分析,Bcl-2、Bax 分别与相应β-Actin 比值进行计算。
1.2.7 ELISA 检测细胞上清液炎症因子的表达水平 各组细胞给予处理后,无菌管收集上清液,2500 r·min-1离心 20 min,放入-80 ℃备用。按试剂盒步骤同时设置空白孔、标准品孔、样品孔,标准品孔各加入不同浓度标准品50 μL。各样品稀释5 倍后每孔加入50 μL,空白孔不加样品,再加入酶标试剂100 μL,封板后37 ℃温箱孵育1 h。取出后弃液、甩干、洗涤。每次洗涤30 s,反复5 次,拍干。然后每孔避光加入显色剂A 50 μL、B 50 μL,振荡混匀,37 ℃避光显色 15 min,取出每孔加入终止液50 μL 终止反应,15 min 内放入酶标仪,设置450 nm 波长检测各孔OD 值。通过标准曲线公式计算并乘以稀释倍数得出终浓度。
1.3 统计学方法
采用SPSS 23.0 统计学软件对数据进行分析,GraphPad Prism 7 作图。符合正态性、方差齐性的计量资料以均数±标准差()表示,CCK-8结果分析采用两因素方差分析,其他实验结果多组之间比较采用单因素方差分析,两两比较采用 LSD-t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 LBP 对 LPS 诱导后 ARPE-19 细胞密度及形态的影响
各组细胞培养24 h 后使用倒置荧光显微镜明场观察细胞形态,正常生长的ARPE-19 细胞呈卵圆形、三角形,细胞密度增高后呈铺路石样外观。与空白组相比,LPS 诱导后细胞密度降低,部分细胞呈现出长梭形,部分收缩变圆。而LBP处理组细胞随着LBP 浓度升高其密度及形态趋于正常,见图1。
2.2 LBP 对 LPS 诱导后 ARPE-19 细胞活力及增殖的影响
CCK-8 结果显示,与空白组相比,模型组ARPE-19 细胞活力随时间延长而下降,各浓度LBP组细胞活力随着LBP 浓度和时间的延长而升高(F交互=31.35,F时间=935.5,F浓度=85.85,P 均<0.01)。其中,各时间点 0.1 mg·mL-1组与 1 mg·mL-1组比较差异有统计学意义(P 均<0.05),见图 2。
2.3 LBP 对LPS 诱导后 ARPE-19 细胞凋亡率的影响
流式细胞仪检测结果表明,各组细胞凋亡率差异有统计学意义(F=37.960,P<0.05)。模型组细胞凋亡率较空白组升高,不同浓度LBP 组细胞凋亡率均较模型组下降(P 均<0.05),1 mg·mL-1LBP 组细胞凋亡率较 0.1 mg·mL-1LBP 组降低(P<0.05),见图 3。
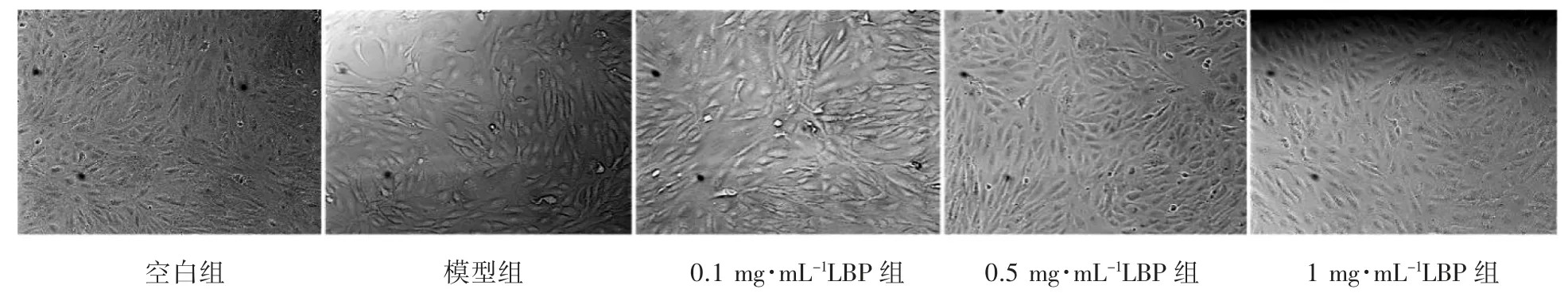
图1 倒置荧光显微镜观察各组细胞密度及形态的变化(×100)
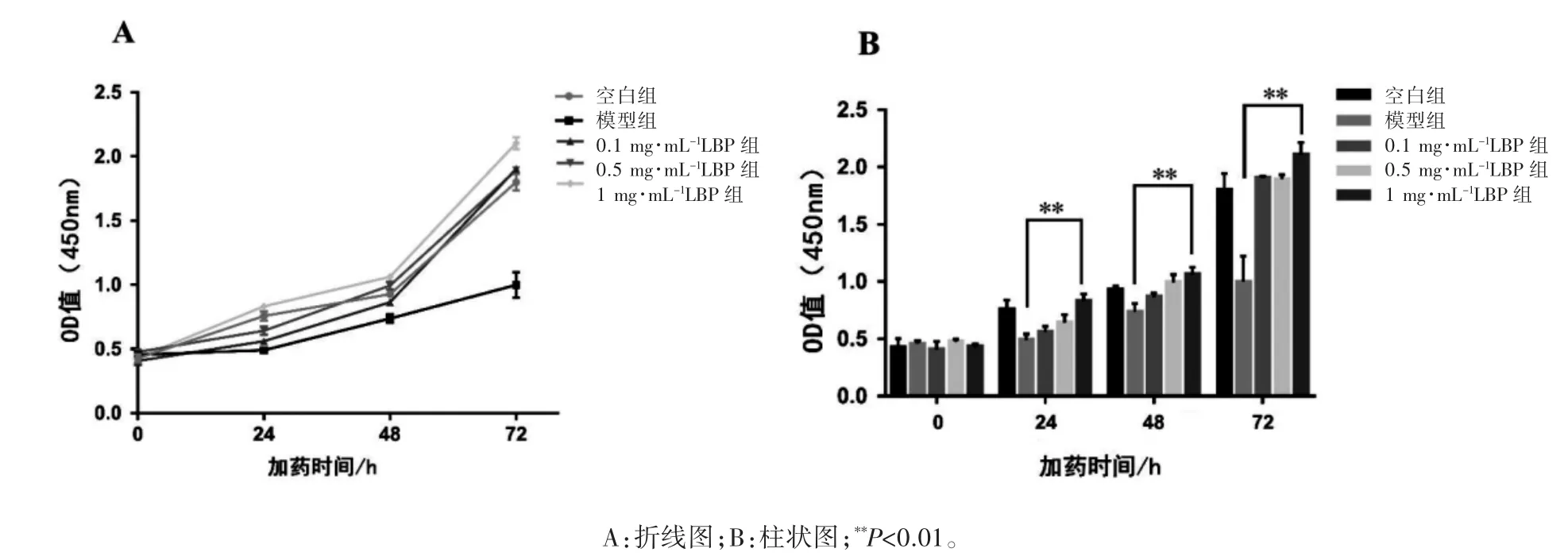
图2 CCK-8 检测LBP 对LPS 诱导后ARPE-19 的细胞活力及增殖的影响
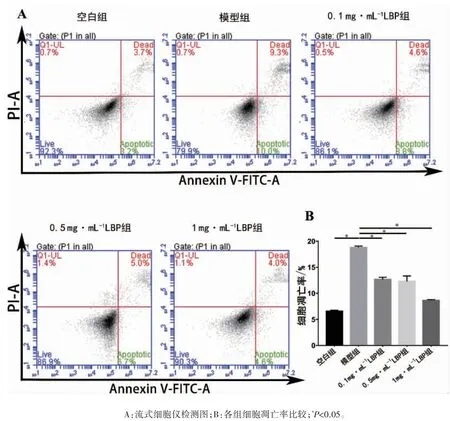
图3 不同浓度LBP 对LPS 诱导后ARPE-19 凋亡率的影响
2.4 LBP 对 LPS 诱导后 ARPE-19 细胞内凋亡相关因子mRNA 表达量的影响
RT-PCR 结果显示,各组 Bcl-2、Bax mRNA表达量差异均有统计学意义(F=19.616、39.801;P均<0.01)。与空白组比较,模型组Bcl-2 表达量降低、Bax 表达量升高(P 均<0.01);与模型组比较,各浓度 LBP 组 Bcl-2 均上调、Bax 均下调(P 均<0.01);0.1 mg·mL-1LBP 组与 1 mg·mL-1LBP 组比较差异有统计学意义(P<0.05),见图 4。
2.5 LBP 对 LPS 诱导后 ARPE-19 细胞内凋亡相关因子蛋白表达量的影响
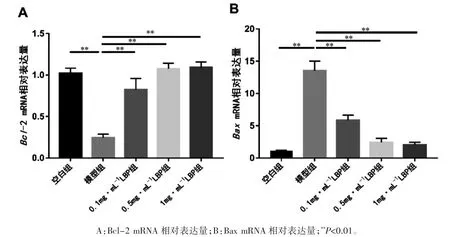
图4 不同浓度LBP 对LPS 诱导后ARPE-19 中Bcl-2、Bax 的mRNA 相对表达量的影响
Western blot 结果显示,各组 Bcl-2、Bax 蛋白相对表达量差异均有统计学意义(F=24.811、39.110,P 均<0.01)。模型组较空白组的 Bcl-2 表达量降低、Bax 升高(P 均<0.05);与模型组相比,0.1、0.5、1 mg·mL-1LBP 组的 Bcl-2 表达量均增加,Bax 表达量均减少(P 均<0.01);1 mg·mL-1LBP 组 Bax 表达量比 0.1 mg·mL-1组减少(P<0.05),见图 5。
2.6 LBP 对 LPS 诱导 ARPE-19 外分泌炎症因子的影响
ELISA 结果显示,各组 IL-6、IL-1β 及 MCP-1蛋白表达量差异均具有统计学意义(F=650.978、14.332、54.249,P 均<0.05)。与空白组相比,模型组上清液内 IL-6、IL-1β 及 MCP-1 蛋白表达量均升高;与模型组相比,各浓度LBP 组IL-6、IL-1β 及 MCP-1 蛋白表达量均降低(P 均<0.05)。1 mg·mL-1LBP 组的各因子浓度较 0.1 mg·mL-1LBP 组均降低(P 均<0.05),见图 6。
3 讨论
LBP 是中药枸杞中的主要活性成分,能够通过不同的炎性通路抑制多种细胞中炎症因子的生成以及细胞凋亡的发生。首先,LBP 能够通过抑制细胞炎症减少凋亡的发生。Li 等[14]用LBP 预处理通过激活丝裂原活化蛋白激酶(mitogen-activated brotein kinase,MAPK)炎性通路逆转凋亡因子Caspase-3 的表达,达到抗人角质形成细胞凋亡的目的。Zhao 等[15]发现LBP 通过抑制炎性通路NF-kB 和p38 MAPK 的激活降低海马神经元中炎性因子肿瘤坏死因子α(tumor necrosis factor,TNF-α)、IL-1β、IL-6、IL-10 的水平,同时减弱神经元细胞中的线粒体凋亡途径,抑制了小鼠脑缺血损伤造成的细胞凋亡。再者,AMD 的炎症机制病理过程为RPE 受到外界刺激后活化,产生多种炎症因子MCP-1、IL-8 等,细胞内活化的细胞因子及生长因子异常造成凋亡基因的异常,导致RPE 细胞凋亡[16]。并且,近年有关炎症与细胞凋亡的研究中也表明,炎症时细胞内炎性小体形成,Caspase-8 可被激活,导致细胞凋亡[17]。Celkova等[18]也在AMD 患者的眼中发现RPE 的细胞程序性死亡及 NLRP3 炎性体、IL-18、Caspase-1 及IL-1β 的升高,以及NLRP3 炎性体相关通路的激活。研究[19]发现,渗出性AMD 患者房水中炎症因子IL-6、MCP-1 的蛋白水平高于正常人,MCP-1参与AMD 中炎性反应的调控及脉络膜新生血管的形成,所以本实验研究选择检测LBP 对AMD的细胞炎症模型中RPE 细胞凋亡线粒体途径标志性凋亡因子Bcl-2、Bax 的影响,以及细胞外分泌炎症因子IL-6、IL-1β、MCP-1 的变化,用以判断LBP 是否可能通过减少炎症因子的形成降低RPE 炎性反应,从而抑制炎性反应相关的RPE 细胞凋亡。
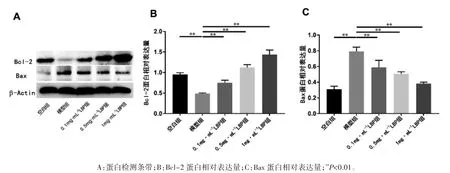
图5 不同浓度LBP 对LPS 诱导后ARPE-19 中Bcl-2、Bax 的蛋白相对表达量的影响
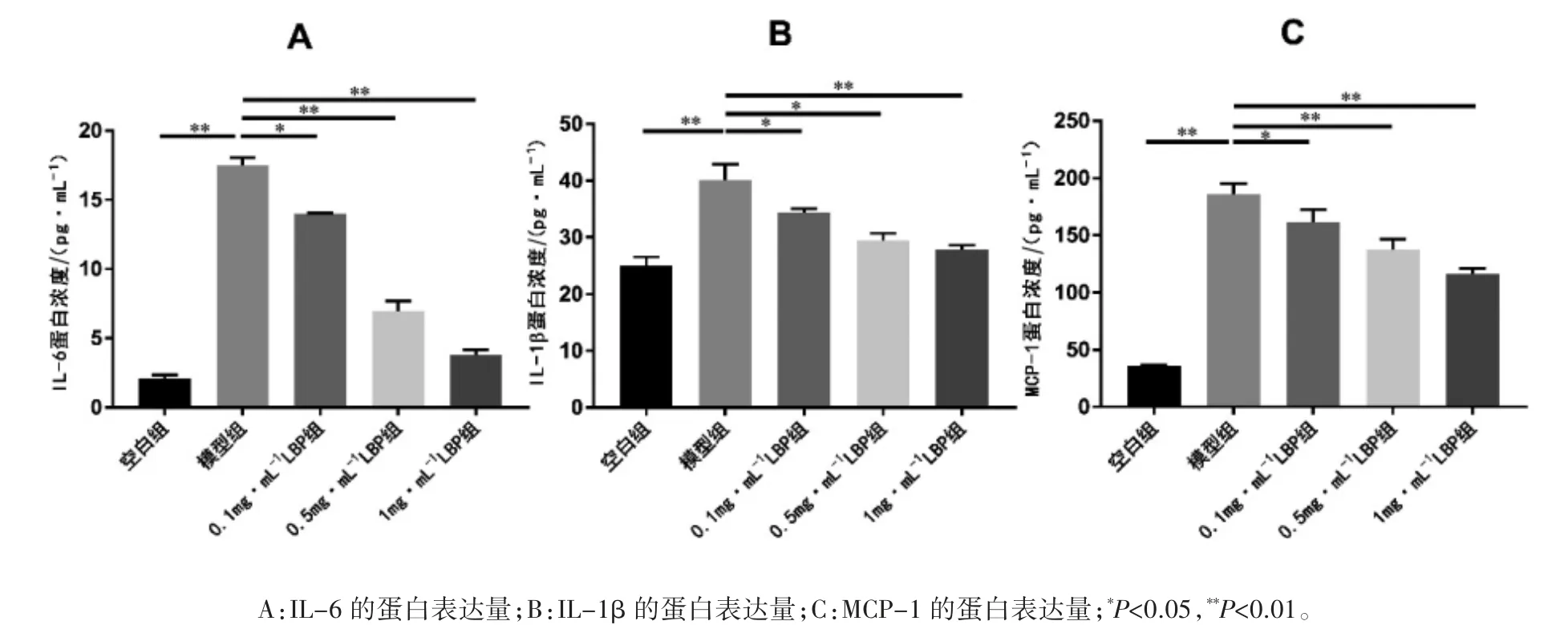
图6 不同浓度LBP 对LPS 诱导后ARPE-19 上清液中炎症因子的影响
由于LPS 作为AMD 炎性细胞模型中的细胞凋亡刺激物被研究者广泛采用[20-21]。故本实验选用了LPS 诱导ARPE-19 造成AMD 体外炎症模型。为判断RPE 的炎性反应,本研究检测了LBP对LPS 诱导ARPE-19 后细胞上清液中炎症因子IL-6、IL-1β、MCP-1 蛋白浓度的变化,以明确LBP 对ARPE-19 外分泌炎症因子的影响。结果表明,LPS 造成细胞上清中炎症因子含量的升高,而在使用不同浓度LBP 进行预处理后,炎症因子 IL-6、IL-1β、MCP-1 浓度下降,证实 LBP 对LPS 诱导的ARPE-19 炎性反应具有抑制作用。
针对细胞凋亡,本实验进行了三个方面的观察。首先,LPS 可造成ARPE-19 细胞活力以及细胞增殖的下降,同时CCK-8 结果显示,在给予LBP预处理后,受LPS 刺激影响的ARPE-19 细胞活力及增殖能力明显被逆转,并且随LBP 浓度的升高保护作用明显增强,在本研究中1.0 mg·mL-1的LBP 作用最强。LBP 对细胞活力以及细胞增殖的保护作用,侧面验证了LBP 能够抑制细胞增殖周期内LPS 诱导炎性损伤所致ARPE-19 的减少,拮抗炎性反应相关的RPE 细胞凋亡。
其次,为明确LBP 的抗凋亡作用是否存于出现炎性反应的RPE 细胞中,本研究观察LBP 对LPS 诱导后ARPE-19 的细胞凋亡率的影响。发现经 LPS 诱导ARPE-19 细胞凋亡率上升,而LBP 预处理后细胞凋亡率下降,1 mg·mL-1LBP处理后细胞凋亡率从19%左右降低到8%左右,并随LBP 浓度升高而下降,表明LBP 具有抑制炎性反应相关的RPE 细胞凋亡的作用。
最后,通过对凋亡蛋白的研究也证实了LBP抗凋亡的作用。在细胞凋亡的研究进展中,已明确细胞凋亡的线粒体途径与细胞应激及发育状态密切相关[22]。细胞在应激损伤的状态下,能够改变Bcl-2 蛋白家族的功能,从而破坏线粒体外膜的完整性,且Bcl-2 蛋白家族中三种效应蛋白Bax、Bak 和Bok 直接引起线粒体外膜通透性的增加,将线粒体膜间隙的蛋白质释放到胞浆中,而其中活性Bax 和Bak 被抗凋亡蛋白Bcl-2 抑制[22]。故本研究选择观察Bcl-2、Bax 这两种线粒体途径标志性因子的表达。实验发现,在ARPE-19 细胞中,LPS 刺激引起细胞凋亡率升高,也能诱导抗凋亡蛋白Bcl-2 的表达量降低、凋亡效应蛋白Bax 的表达量升高。各浓度LBP 作用显示其在减少炎症因子外分泌的同时,使Bcl-2 及Bax的表达逆转,并随LBP 浓度升高而增强。由此证实LPS 存在诱导RPE 炎性反应及细胞凋亡的作用,以及LBP 具有降低RPE 炎性反应及细胞凋亡的能力,还表明抑制细胞凋亡途径可能通过线粒体途径进行,但凋亡途径问题还需进一步研究明确。
综上所述,LBP 对 LPS 诱导的 ARPE-19 炎性损伤具有保护作用,可通过减少分泌炎症因子IL-6、IL-1β 及 MCP-1 以及逆转 RPE 细胞内Bcl-2、Bax 的转录和翻译过程,从而抑制炎性反应相关的RPE 细胞凋亡。
