新疆克孜勒河厚唇裂腹鱼人工繁殖及胚胎、早期仔鱼发育研究
2021-06-21赵贺洪继彪赵年桦胡仁云魏杰聂竹兰
赵贺,洪继彪,赵年桦,胡仁云,魏杰*,聂竹兰
(1.塔里木大学 动物科学学院,新疆维吾尔自治区 阿拉尔 843300; 2.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆维吾尔自治区 阿拉尔 843300; 3.塔里木珍稀鱼类研究中心,新疆维吾尔自治区 阿拉尔 843300;4.武汉中科瑞华生态科技股份有限公司,湖北 武汉 430000)
厚唇裂腹鱼Schizothoraxirregularis属鲤形目Cypriniformes鲤科Cyprinidae裂腹鱼亚科Schizothoracinae裂腹鱼属Schizothorax,是新疆克孜勒河土著鱼之一[1]。克孜勒河位于中国最西端,隶属于新疆维吾尔自治区克孜勒苏柯尔克自治州,发源于天山南脉中吉边界西侧吉尔吉斯斯坦境内扎尔多布卡山口海拔4 419 m的冰山上,是喀什噶尔河水系中水量最大的一条河流[2]。近几十年来,受气候变化影响,克孜勒河流域内植被覆盖率逐年降低,少有降水,加之人类对环境的破坏,厚唇裂腹鱼生存环境日渐恶劣,种群数量急剧减少。
目前,关于厚唇裂腹鱼的研究仅限于其资源分布[3-4]、形态学[5-6]、线粒体COI基因序列[7]、游泳能力[8]和精子活力[9]等方面,有关其人工繁殖、胚胎发育和早期仔鱼发育方面的研究尚未见报道。本研究中,对克孜勒河厚唇裂腹鱼亲鱼进行人工繁殖,探索厚唇裂腹鱼的繁殖时期、雌雄鉴别、人工催产和人工孵化等技术,并系统观察了其胚胎和早期仔鱼发育的过程,以探究其胚胎和早期仔鱼发育各个时期的典型特征,旨在为厚唇裂腹鱼的资源保护和人工繁殖提供基础资料和科学依据。
1 材料与方法
1.1 材料
试验于2019年4—5月在新疆维吾尔自治区克孜勒苏柯尔克自治州乌恰县卡拉贝利水利枢纽工程鱼类增殖放流站进行厚唇裂腹鱼人工繁殖试验。试验亲鱼于2017年12月、2018年1—12月捕自克孜勒河流域,共捕野生亲鱼1 380尾,体长为152.31~271.25 mm,体质量为102.17~265.31 g,暂养于室内玻璃缸(直径为2 m,水深为1 m)中,15 d后转移至养殖池(面积≥667 m2,水深≥0.6 m,循环水≥1 m3)中进行培育。亲鱼培育过程中全程投喂饲料,饲料以漂浮料(成都海大6602)为主,卤虫和升索颗粒饲料为辅,日投饵量为鱼体质量的2%~5%。
1.2 方法
1.2.1 亲鱼雌雄和成熟度鉴别 生殖季节雌鱼形体明显大于雄鱼,腹部膨大柔软,体表颜色相对雄鱼较浅,臀鳍较肥厚;雄鱼鳍条及身体颜色较鲜艳,臀鳍呈斜三角且末端尖形,形体修长,轻压腹部有少量白色精液流出(图1)。

图1 繁殖期厚唇裂腹鱼雌雄鉴别
1.2.2 人工催产 挑选3+龄雄性和4+龄雌性人工驯养成熟的亲鱼,雌雄亲鱼比为1∶2,使用2次注射进行催产。催产药物为促黄体激素释放激素(LHRH-A3)、马来酸地欧酮(DOM)和人绒毛膜促性腺激素(HCG),第1针注射LHRH-A34 μg/kg+DOM 3 mg/kg,间隔24 h后注射第2针(LHRH-A34 μg/kg+DOM 3 mg/kg+HCG 1 000 IU/kg)。为确定催产最佳水温,水温从16.0~19.5 ℃,设置8个梯度试验,每组间隔为0.5 ℃,用温控加热棒控温。每组雌鱼10尾,雄鱼20尾,每组设3个重复。
1.2.3 人工授精及孵化 至效应时间,采用人工干法授精,将成熟的鱼卵直接挤入干燥的孵化筐(0.50 m×0.40 m×0.35 m)中,再将雄鱼的精液直接挤到卵子上,用鹅毛轻轻搅动使二者充分混合。2 min后加入适量清水,受精卵吸水膨胀,25 min后再用清水清洗受精卵,转入孵化缸(5.00 m×0.45 m×0.50 m)中孵化。每个孵化缸可放孵化筐5个,每筐可放卵粒5 000粒,孵化时受精卵在水下0.03 m。孵化进水管道连接软管,在软管另一端接上淋浴蓬头,蓬头固定在孵化缸水面上方0.50 m,蓬头朝正上方方向喷水,喷出的水可距孵化水体水面0.90~1.30 m,淋水平均落差为1.10 m,水体交换量为0.11~0.22 m3/h。为确定受精卵孵化最佳水温,水温从16.0~19.5 ℃,设置8个温度梯度试验,每组间隔为0.5 ℃,用温控加热棒控温。每组受精卵500 粒,每组设3个重复。
1.2.4 胚胎发育和早期仔鱼发育观察 选取同批次50粒受精卵进行胚胎发育观察研究,利用显微镜(SMZ 1 270数码体式)观察受精卵发育各时期,以70%的受精卵进入相同发育时期作为一个发育期判定;选取同批次受精卵发育出膜的仔鱼用于早期仔鱼发育观察研究,每次选取至少5尾仔鱼,采用体积分数10%的福尔马林溶液固定,在显微镜(CX31-32C02型)4×10倍镜下进行观察并记录。
1.2.5 孵化效率评价
催产率=产卵鱼数/催情鱼总数×100%,
受精率=原肠中期活卵数/产卵总数×100%,
孵化率=鱼苗水花尾数/受精卵总数×100%。
1.3 数据处理
试验数据以平均数±标准差(mean±S.D.)表示。使用SPSS 26.0软件进行单因素方差分析,采用Duncan法进行多重比较,显著性水平设为0.05。采用Excel 2020软件进行早期仔鱼的全长生长方程拟合。
2 结果与分析
2.1 厚唇裂腹鱼人工催产和孵化的适宜水温
从图2可见:不同温度下厚唇裂腹鱼的催产率和受精率有显著性差异;温度对催产率影响试验中,水温为18.5 ℃时,催产率达到100%,当水温低于18.5 ℃,催产率显著下降(P<0.05),因此,水温维持在18.5 ℃左右时有利于亲鱼集中产卵,这也是提高催产率的有效途径之一,可见最适催产水温是18.5 ℃;温度对孵化率影响试验中,当水温为17.0 ℃时,受精卵孵化率最高,达87%,水温为17.5 ℃时,孵化率达到84%,温度低于17.0 ℃或高于17.5 ℃时,孵化率显著下降(P<0.05),因此,其最适孵化水温为17.0~17.5 ℃。
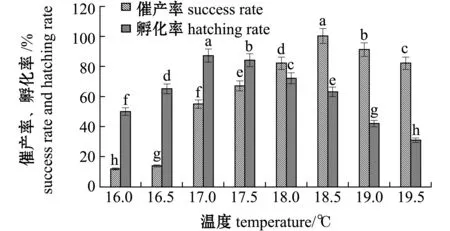
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
2.2 厚唇裂腹鱼胚胎发育
厚唇裂腹鱼胚胎发育过程分为胚盘、卵裂、囊胚、原肠胚、神经胚、器官形成和出膜7个阶段,划分方法参考其他硬骨鱼类[10],整个发育过程划分为18个时期(表1)。在水温为(17.14±0.01)℃条件下,厚唇裂腹鱼受精卵发育经过147 h 31 min孵化,总积温为2 513.01 ℃·h。

表1 厚唇裂腹鱼胚胎发育时序
2.2.1 受精卵胚盘形成时期 厚唇裂腹鱼成熟卵为微黏性沉性卵、浅黄色、圆球形、半透明,卵径(2.95±0.15)mm,吸水膨胀后达(3.53±0.12)mm(图3A),沉于水底。受精后2 h 27 min动物极出现明显的胚盘,隆起高度约占卵黄的1/4(图3B)。
2.2.2 卵裂阶段 厚唇裂腹鱼卵裂发生于胚盘,受精后3 h 26 min,胚盘中部形成分裂沟,将胚盘分裂为2个大小相近的分裂球,为2细胞期(图3C)。受精后3 h 50 min,胚盘再次分裂,形成4个大小相近的细胞,为4细胞期(图3D)。受精后4 h 56 min进行第3次分裂,形成8个大小相近的细胞,进入8细胞期(图3E)。受精后5 h 47 min进行第4次分裂,形成均匀排列的4排16个细胞,且细胞体积明显变小,此时期为16细胞期(图3F)。受精后6 h 47 min进行第5次分裂,细胞体积进一步缩小,进入32细胞期(图3G)。受精后7 h 17 min,第6次分裂完成,细胞团向上隆起,进入64细胞期(图3H)。受精后8 h 42 min,细胞数量不断增多,细胞团继续向上隆起,细胞体积变小,此时受精卵进入多细胞期(图3I)。
2.2.3 囊胚阶段 受精后10 h 17 min,细胞数量急剧增加,细胞界限不明显,胚胎发育进入囊胚早期(图3J)。受精后10 h 35 min,胚胎发育进入囊胚中期,此时单个细胞体积较小,且无法分辨细胞界限,分裂球隆起高度达到最大,占卵球高度的1/3(图3K)。受精后19 h 2 min,隆起高度逐渐降低,呈小帽状,胚胎发育进入囊胚后期(图3L)。
2.2.4 原肠胚阶段 受精后36 h 1 min,分裂球细胞向植物极移动下包至卵黄高度的1/3,边缘细胞排列平整,胚胎发育进入原肠胚早期(图3M)。受精后38 h 14 min,胚层继续下包至卵黄囊的1/2处,胚盾出现,进入原肠胚中期(图3N)。受精后40 h 4 min,胚层下包至卵黄囊4/5处,胚盾伸长,胚胎发育进入原肠后期(图3O)。
2.2.5 神经胚形成阶段 受精后44 h 1 min,胚体出现并紧贴于卵黄囊上,前端膨大形成脑泡,胚胎发育进入神经胚期(图3P)。受精后46 h 26 min,胚层完全包裹住卵黄,胚孔封闭,这个时期称为胚孔封闭期(图3Q)。
2.2.6 器官形成阶段 受精后57 h 3 min,胚体中部位置出现约6对透明肌节,为肌节出现期(图3R)。受精后64 h 1 min,头部两侧出现椭圆形的凹陷并形成眼囊,此时肌节增至约10对,胚胎发育进入眼囊期(图3S)。受精后70 h 41 min,卵黄一侧开始凹陷,肌节增至约23对,为尾芽期(图3T)。受精后74 h 30 min,眼杯口出现圆形的晶体,尾与胚体长轴成锐角,肌节约26对,为晶体出现期(图3U)。受精后76 h 1 min进入肌肉效应期,胚体开始颤动,尾芽逐步增长,肌节约31对,此时为肌肉效应期(图3V)。受精后77 h 56 min,肌节约35对,卵黄囊前方出现排列成串的细胞,形成心脏原基,即心脏原基期(图3W)。受精后82 h 6 min,胚体两侧的耳囊中出现2个颗粒,肌节约37对,此时为耳石期(图3X)。受精后86 h 23 min,尾部细胞聚集突出于体表,形成尾鳍原基,肌节约39对,为尾鳍原基期(图3Y)。受精后104 h 1 min,肌节约42对,心脏开始搏动,胚胎发育进入心脏搏动期(图3Z)。受精后123 h 51 min,耳囊后下方与卵黄交界处出现胸鳍原基,躯干出现血液循环,进入胸鳍原基形成期(图3a)。
2.2.7 孵化出膜阶段 受精后145 h 1 min进入出膜期(图3b),此阶段胚体开始剧烈运动,尾部最先破膜而出,仔鱼身体完全伸展。受精后147 h 31 min,完成出膜,出膜仔鱼呈淡黄色,通体透明,全长为(8.72±0.26)mm,可以观察到血液循环路线,卵黄囊紧贴仔鱼腹部,仔鱼静卧鱼水底,此时为初孵仔鱼(4A)。
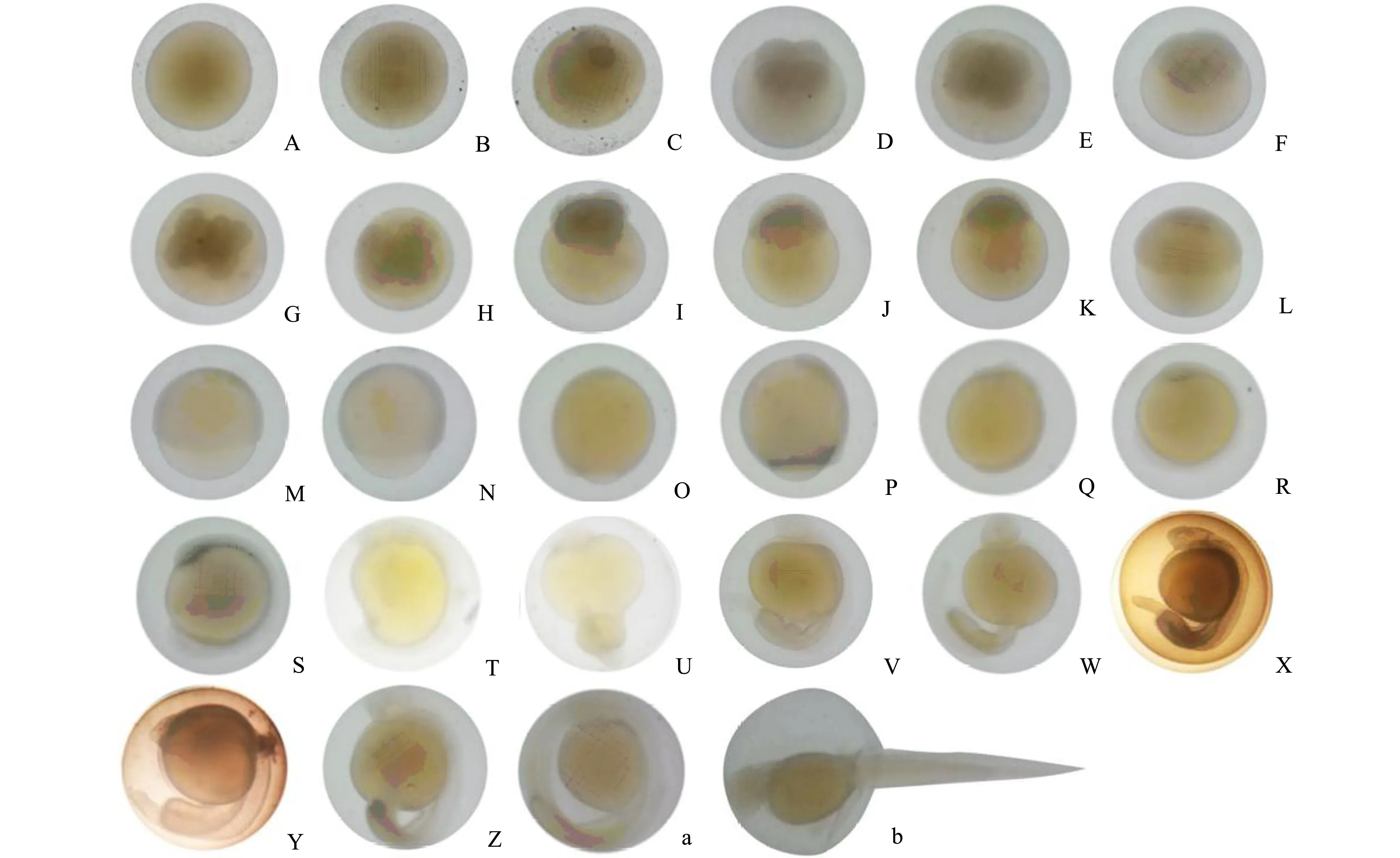
A—受精卵;B—胚盘期;C—2细胞期;D—4细胞期;E—8细胞期;F—16细胞期;G—32细胞期;H—64细胞期;I—多细胞期;J—囊胚早期;K—囊胚中期;L—囊胚后期;M—原肠早期;N—原肠中期;O—原肠后期;P—神经胚期;Q—胚孔封闭期;R—肌节出现期;S—眼囊期;T—尾芽期;U—晶体出现期;V—肌肉效应期;W—心脏原基期;X—耳石期;Y—尾鳍原基期;Z—心脏搏动期;a—胸鳍原基形成期;b—出膜期。
2.3 厚唇裂腹鱼早期仔鱼发育
早期仔鱼发育分为眼球色素出现期、体色素出现期、鳔充气期和卵黄囊完全吸收期4个时期(表2)。仔鱼生长温度控制在15.0~19.0 ℃,出膜后158 h后,仔鱼开始摄取开口饵料丰年虫。待到出膜后432 h后,仔鱼卵黄囊消耗完全,依靠外源性营养存活时,投喂微粒子饲料。经过回归分析,厚唇裂腹鱼早期仔鱼的全长生长方程为

表2 厚唇裂腹鱼早期仔鱼发育观察
L=6×10-5t2+0.001 8t+9.417 6
(R2=0.992 2,n=70)。
其中:L为仔鱼全长(mm);t为出膜时间(h)。
出膜后200 h内,仔鱼生长较缓慢,200 h后仔鱼生长速度逐渐加快,在出膜后432 h时全长达到(21.51±0.75)mm(图5)。当仔鱼体色变为黑色时,卵黄囊吸收50%以上,消化道贯通,即可下土池塘。
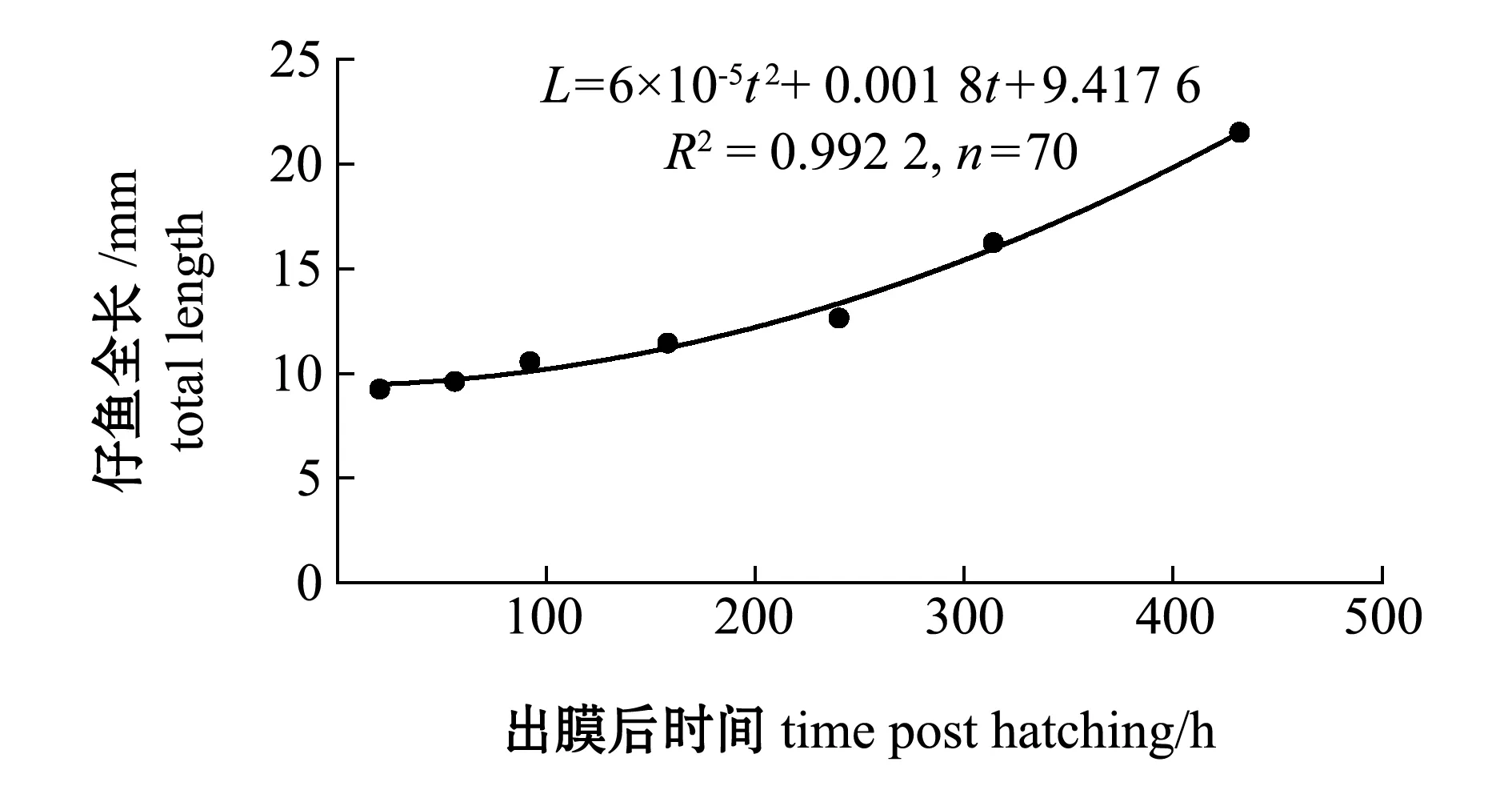
图5 厚唇裂腹鱼早期仔鱼的生长
2.4 厚唇裂腹鱼人工繁殖试验
2019年4月27日—5月16日在新疆维吾尔自治区克孜勒苏柯尔克自治州乌恰县卡拉贝利水利枢纽工程鱼类增殖放流站催产厚唇裂腹鱼亲鱼35组,进行了9批次厚唇裂腹鱼人工繁殖试验,共获得成熟卵粒20.69万粒,平均催产率为77.71%,平均受精率为76.73%,平均孵化率为89.14%,获水花鱼苗14.12万尾(表3)。
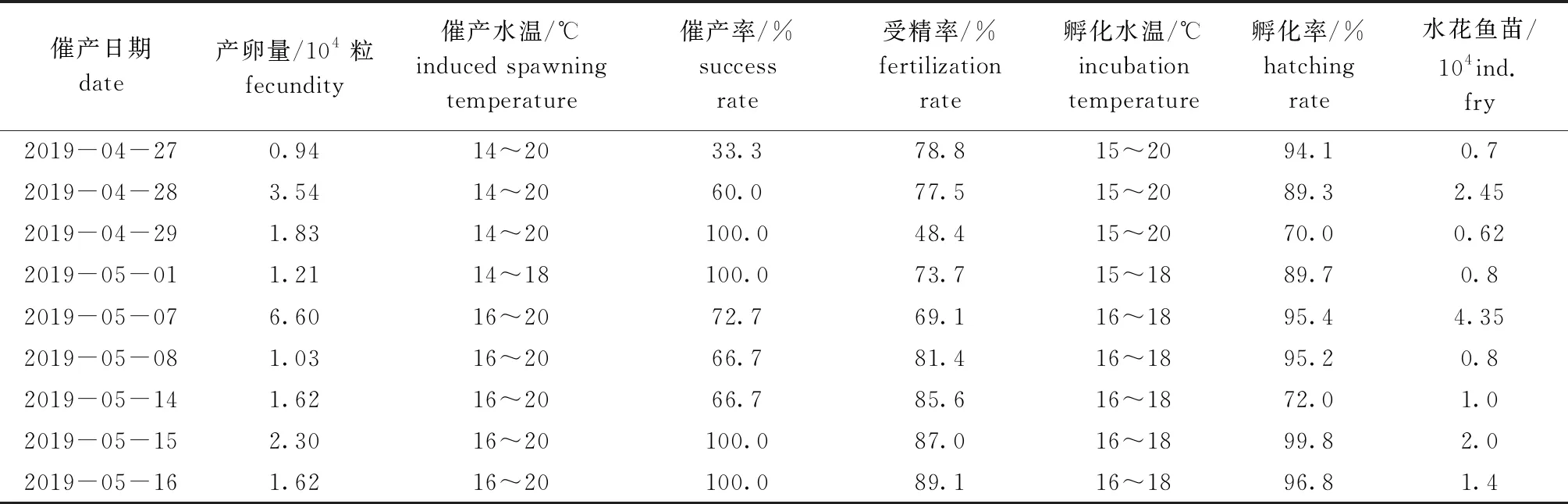
表3 厚唇裂腹鱼人工繁殖试验
3 讨论
3.1 人工驯养与繁殖
亲鱼是人工繁殖的基础,其培育的最终目的是获取性腺成熟的个体[11]。本试验中所用亲鱼捕自天然水体,野性较强,应激反应明显。为避免因应激反应造成亲鱼拒绝摄食、体弱染病和四处乱撞等情况,需精心培育亲鱼,投喂鲜活饵料,保持长流水。经人工驯养后,厚唇裂腹鱼性腺可发育成熟并正常进入繁殖期。人工催产的原理是通过注射外源激素来调节鱼类自身的内分泌活动,促进内源性激素的释放,从而诱导性腺发育成熟并排出精子和卵子[12]。本试验中,选择促黄体激素释放激素LHRH-A3、马来酸地欧酮DOM和人绒毛膜促性腺激素HCG 3种催产剂,采用2次注射法进行催产,这与对云南盘鮈Discogobioyunnanensis[13]、翘嘴鳜Sinipercachuasti[14]和泥鳅Misgurnusanguilicaudatus[15]的催产方法类似。

A—初孵仔鱼;B、C—眼球色素出现期;D、E—体色素出现期;F、G—鳔充气期;H—卵黄囊完全吸收期。
3.2 水温对人工繁殖的影响
本试验中,厚唇裂腹鱼最佳催产水温在18.5 ℃,催产率高达100%,在17.5~19.5 ℃水温下,厚唇裂腹鱼催产率均达到50%以上,这与其他裂腹鱼亚科催产所需水温相似,如青海湖裸鲤Gymnocypisprzewalskii[16]为16.0~20.0 ℃,塔里木裂腹鱼Schizothoraxbiddulphi[11]为13.0~18.0 ℃,扁吻鱼Aspiorhynchuslaticeps[17]为14.0~21.0 ℃。本试验中,厚唇裂腹鱼最佳孵化温度为17.0~17.5 ℃,温度较低。低温可以延缓鱼卵胚胎发育,减少能量消耗,有效抵御外界温度强烈变化,从而提高胚胎成活率[18]。
3.3 孵化缸淋浴式孵化的优点
刘鉴毅等[19]在改进中华鲟人工繁殖关键技术中,采用孵化缸淋浴式方法孵化受精卵,结果显示,该方法可有效减少水霉的发生,同时孵化率高达96%。康鹏天等[20]通过孵化缸淋浴式孵化法、比平列槽微流水孵化法和孵化缸微流水孵化法3种用不同的孵化方式进行青海湖裸鲤受精卵孵化试验,结果发现,孵化缸淋浴式孵化方式有利于将空气中的氧气带入孵化水体,降低了水霉病的发病率;孵化缸淋浴式孵化方式可有效提高孵化率,与比平列槽微流水孵化法相比提高了15%,比孵化缸微流水孵化法提高了7%;孵化缸淋浴式孵化方式还可缩短26~42 h的孵化期,以及13 h的出苗高峰期时间差。裂腹鱼亚科鱼类人工繁殖过程中多数采用微水流孵化法,微流水孵化法结果显示,花斑裸鲤Gymnocypriseckloni孵化率为72.2%[21],齐口裂腹鱼Schizothoraxprenanti孵化率最高为77.0%[22],长丝裂腹鱼Schizothoraxdolichonema平均孵化率为45.7%[23]。本试验中采用孵化缸淋浴式孵化方式,平均孵化率高达89.14%,远高于其他裂腹鱼亚科鱼类的孵化率。笔者推测,孵化缸淋浴式孵化法可有效提高孵化率,值得在裂腹鱼类人工繁殖中推广。
3.4 厚唇裂腹鱼与其他裂腹鱼亚科鱼类的胚胎发育差异
将厚唇裂腹鱼与短须裂腹鱼Schizothoraxwangchiachii[24]、拉萨裂腹鱼Schizothoraxwaltoni[25]、光唇裂腹鱼Schizothoraxlissolabiatus[26]、齐口裂腹鱼[27]、新疆裸重唇鱼Gymnodiptychusdybowskii[28]、祁连山裸鲤Cymnocyprischilianensis[29]、扁吻鱼[30]、硬刺松潘裸鲤Gymnocyprispotaninifirmispinatus[31]等其他裂腹鱼亚科鱼类胚胎发育进行比较,结果如表4所示。裂腹鱼亚科鱼类胚胎发育温度均较低(不超过22 ℃),这与裂腹鱼类生活在高原地区的寒冷水体环境相适应。厚唇裂腹鱼胚胎发育用时长于齐口裂腹鱼、新疆裸重唇鱼、扁吻鱼,短于短须裂腹鱼、拉萨裂腹鱼、光唇裂腹鱼、祁连山裸鲤鱼、硬刺松潘裸鲤,这可能是孵化水温和鱼的种类差异造成的。厚唇裂腹鱼的受精卵卵径在几种裂腹鱼亚科鱼类属于较大类型,卵径较大的鱼类可能发育速率较慢[32],但是较大卵黄可为仔鱼提供更多营养物质,弥补了厚唇裂腹鱼孵化时间长带来的存活压力[33-34],延长了仔鱼从内源性营养向外源性营养转变的时间,从而提高了仔鱼的成活率[35]。出膜阶段时,厚唇裂腹鱼、短须裂腹鱼、拉萨裂腹鱼、硬刺松潘裸鲤为胸鳍原基形成期,光唇裂腹鱼、齐口裂腹鱼、新疆裸重唇鱼、祁连山裸鲤为心脏搏动期,而扁吻鱼为血液循环期。在胚胎发育过程中,厚唇裂腹鱼心脏及血液循环、尾鳍原基和胸鳍原基均在孵化出膜前形成,这有利于仔鱼更好地适应高原贫营养及低水温环境[36],而厚唇裂腹鱼、短须裂腹鱼、新疆裸重唇鱼和祁连山裸鲤均为尾部先出膜,拉萨裂腹鱼、光唇裂腹鱼、齐口裂腹鱼、扁吻鱼和硬刺松潘裸鲤的出膜方式均为头部或尾部出膜,出膜方式的不同可能与鱼的种类差异有关。

表4 厚唇裂腹鱼与其他裂腹鱼亚科鱼类胚胎发育特点比较
3.5 厚唇裂腹鱼与其他裂腹鱼亚科鱼类的仔鱼发育差异
厚唇裂腹鱼初孵仔鱼全长大于祁连山裸鲤、扁吻鱼和硬刺松潘裸鲤,短于短须裂腹鱼、齐口裂腹鱼和新疆裸重唇鱼,与光唇裂腹鱼相近(表4),推测厚唇裂腹鱼初孵仔鱼在裂腹鱼亚科中属于中等类型。厚唇裂腹鱼仔鱼出膜18 d后卵黄囊才消耗殆尽,时间远长于光唇裂腹鱼、新疆裸重唇鱼、祁连山裸鲤、扁吻鱼和硬刺松潘裸鲤(表4)。推测厚唇裂腹鱼仔鱼为了更好地适应饵料生物匮乏的低温环境,所以发育过程中需要更多的内源性营养物质,以降低仔鱼在短时间内摄食不到外源营养而死亡的风险,从而提高仔鱼的成活率[37],但关于厚唇裂腹鱼卵黄囊确切机制还有待进一步研究。本试验显示,厚唇裂腹鱼仔鱼孵化后158 h后,进入混合营养期,此时卵黄囊并未完全吸收,仔鱼生长缓慢,孵化后200 h,卵黄囊被大量吸收,呈细条状,仔鱼摄取外源性营养的能力增强,生长速度加快[38-39]。
3.6 厚唇裂腹鱼早期发育与环境适应性
克孜勒河位于中国最西部,平均海拔4 000 m以上,年平均降水量150 mm左右,昼夜温差大,年平均气温较低,流域内大部分地区为荒山戈壁,生态环境恶劣[40]。本试验显示,厚唇裂腹鱼胚胎孵化温度较低,发育过程中器官发育较快,心脏及血液循环、尾鳍原基和胸鳍原基在出膜前就已形成,使出膜后仔鱼能更好地适应贫营养型水体。出膜仔鱼卵黄囊存在时间较长,从而降低了仔鱼因摄取不到外源营养而死亡的风险,因此,厚唇裂腹鱼胚胎和早期仔鱼发育过程与其生境具有一定的适应性。
