TOC法测定清洁验证中盐酸林可霉素残留量
2021-06-20张友冬
张友冬
摘 要 目的:验证总有机碳法测定盐酸林可霉素清洁残留物的准确性。方法:根据总有机碳法中测定值与浓度正相关的特性来判定林可霉素残留量。结果:该检验方法在0.5~2.0 μg/ml浓度范围有较好的线性关系,相关系数R2=0.998 6,检测限与定量限分别为0.504 9 和1.530 3 μg/ml,最低擦拭回收率为73.5%。结论:该方法简便、快捷、准确,适合林可霉素注射液生产结束清洁后残留量的检测。
关键词 总有机碳法 林可霉素 清洁残留 验证 方法学
中图分类号:R951 文献标志码:A 文章编号:1006-1533(2021)09-0067-04
Determination of lincomycin hydrochloride residue in cleaning verification by TOC method
ZHANG Youdong*
(Shanghai Sine-Jinzhu Pharmaceutical Co., Ltd., Shanghai 201506, China)
ABSTRACT Objective: To validate the accuracy of determination of lincomycin hydrochloride residue after cleaning by total organic carbon (TOC) method. Methods: The residue concentrations were determined based on the positive correlation between the measured value and the concentration in the TOC method. Results: A good linear relationship was shown when lincomycin hydrochloride concentrations were in the range of 0.5-2.0 mg/ml, with correlation coefficient R2=0.998 6. The limits of detection and quantification were 0.504 9 and 1.530 3 mg/ml, with minimum wipe recovery rate 73.5%. Conclusion: This method is simple, quick and accurate and is suitable for the detection of the cleaning residue after lincomycin hydrochloride production.
KEy WORDS total organic carbon method; lincomycin hydrochloride; cleaning residue; validation; methodology
藥品的生产过程中,由于不同产品共用一条生产线,因此在更换产品时如不注意极易造成微量交叉污染,需要对生产条线重新进行清洁验证,其前提是需要有合适的方法对目标化合物进行检验,即检验分析方法学验证。在我们的生产线上,根据产品清洁的难易程度及综合溶解度和浓度检测[1],发现盐酸林可霉素是最难清洁的残留药物。按照清洁验证分别采用MTDD法、10 ppm法和LD50法[2]进行计算,选择最低残留浓度为≤1.72 mg/ml,在此残留浓度下我们通过HPLC方法测试,无法满足方法学验证要求,通过对总有机碳(TOC)法测定林可霉素残留物的分析方法验证开发[3],以保证数据的准确性。
1 材料和方法
1.1 仪器
HTY-DI1500总有机碳分析仪(浙江泰林生物技术有限公司);BASA124S分析天平(赛多利斯科学仪器有限公司)。
1.2 试药
盐酸林可霉素标准品(批号130432-201911)、蔗糖标准品(批号111507-201704)和1,4-对苯醌标准品(101197-201904)均购自中国食品药品检定研究院。
1.3 方法
根据《药品生产验证指南》采用10 ppm法,以日治疗量的1/1 000及基于毒性半数致死量确认最低残留检测限度为1.72 mg/ml,用盐酸林可霉素标准品(以C18H37N5O9计)配制成一系列不同浓度的标准溶液,用总有机碳(TOC)测试仪检测不同浓度溶液所对应的TOC响应值,将所测得的TOC响应值和盐酸林可霉素浓度关系式建立TOC测定值与盐酸林可霉素含量之间的线性关系[4-8]。
1.3.1 系统适用性实验
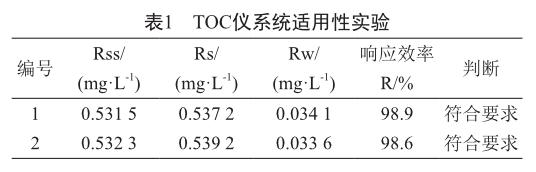
使用蔗糖标准品(111507-201704)配制成质量浓度为0.5 mg/L的蔗糖标准品溶液,作为易氧化的有机物,并测定其响应值(Rs)。使用1,4-对苯醌标准品(101197-201904)配制成质量浓度为0.5 mg/L的1,4-对苯醌标准溶液,作为系统适用性难氧化的有机化合物,并测定其响应值(Rss)。同时测定用于配制两瓶标准溶液的空白试剂注射用水的响应值(Rw)。当响应效率R=(Rss-Rw)/(Rs-Rw)×100%达到85%~115%,则符合要求。
1.3.2 盐酸林可霉素的校准曲线
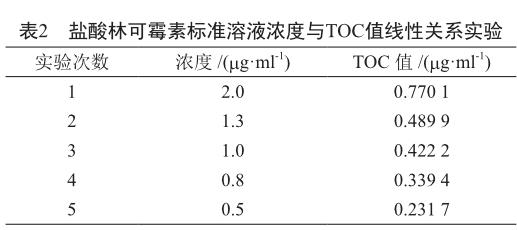
用注射用水配制盐酸林可霉素标准品母液的质量浓度为100 mg/ml,然后稀释成系列供试液,测定每种浓度的溶液总有机碳值,并将林可霉素溶液浓度为横坐标、总有机碳值为纵坐标作线性图。
1.3.3 擦拭回收率
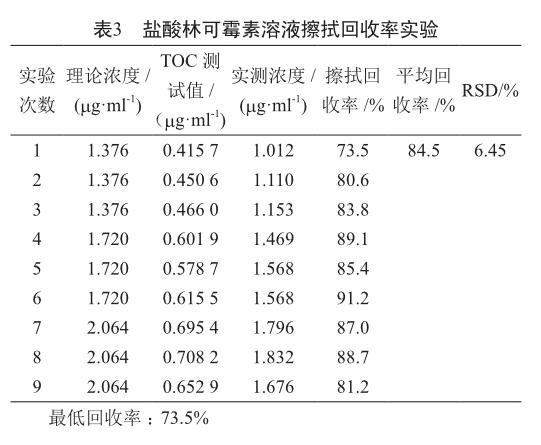
称取林可霉素标准品适量,用注射用水分别配制成质量浓度为68.8、86.0、103.2 mg/ml的盐酸林可霉素溶液。
分别精密量取上述溶液1.0 ml,均匀涂布在划有多个与设备表面材质相同的10 cm×10 cm方块的不锈钢板上,每种浓度各涂3块,于40 ℃恒温干燥箱中烘干6 h后取出,放冷。用润湿的棉签用力且平稳缓慢地逐一擦拭10 cm×10 cm方块的不锈钢板表面,在向前移动的同时将其从一边移到另一边并覆盖整个表面,翻转棉签头,将棉签头的另一面也在10 cm×10 cm方块的不锈钢板表面上与前次方向垂直擦拭整个表面(图1)。擦拭完后将棉签头小心剪下,分别置50 ml量瓶中,用水稀释至刻度,摇匀,作为供试品溶液。
1.3.4 準确度
分别精密量取上述68.8、86.0、103.2 mg/ml三种浓度的林可霉素溶液1.0 ml各3份,置于50 ml量瓶中,用注射用水稀释至刻度,摇匀。按照TOC测试仪操作规程,测试低、中、高3个浓度的标准溶液样品的TOC值。
1.3.5 精密度
精密量取上述86.0 mg/ml的盐酸林可霉素溶液5 ml置于250 ml量瓶中,用注射用水稀释至刻度,摇匀。按照TOC测试仪操作规程,连续测试理论浓度为1.72 mg/ml的标准溶液样品6次,记录TOC值。
2 结果
2.1 仪器性能确认
系统适用性实验结果表明0.5 mg/L蔗糖标准品溶液与1,4-对苯醌标准溶液响应效率分别为98.9%与98.6%,符合响应效率R达到85%~115%要求(表1)。
2.2 盐酸林可霉素的校准曲线
采用TOC法测定不同浓度下的盐酸林可霉素溶液总有机碳值,将表2数据经线性回归分析,其回归方程y=0.356 8x+0.054 6,R2=0.998 6,相关系数R2>0.98[2]。检测限:LOD=3.3 SD/B;定量限:LOQ=10 SD/B(SD为校正曲线的截距作为标准差;B为校正曲线的斜率)[3]。通过计算得出检测限和定量限分别为0.504 9和1.530 3 mg/ml,表明这两者均低于盐酸林可霉素注射液实际残留检测限度。
按照TOC测试仪操作规程,测试供试品的TOC值。由于配制盐酸林可霉素溶液含有试剂空白水和盐酸林可霉素标准品中的有机杂质,所以直接用线性关系式计算盐酸林可霉素浓度,棉签、钢板、试管、及盐酸林可霉素中有机杂质远远低于空白试剂注射用水的TOC值,故忽略不计。当y=0时,x=0.153 mg/L即为标准溶液配制背景TOC含量,来源于空白试剂水及盐酸林可霉素标准品中有机杂质。
2.3 擦拭回收率
考察了在三种浓度下TOC测试值与理论浓度的回收率,结果证实本方法的回收率较高(表3),能够满足回收率>50%且RSD<20%的要求。
2.4 准确度
选择3种不同浓度的样品进行测试,采用标准曲线法测定盐酸林可霉素含量,实验结果能够满足准确度RSD≤1%的要求(表4)。
2.5 精密度
选择理论残留限度作为精密度浓度的测试标准,平行测定6次,实验结果表明,RSD为1.23%,符合准确度RSD≤2%验证检验要求(表5)。
3 讨论
盐酸林可霉素(以C18H37N5O9计)分子量为461.02,其含碳百分比为46.85%,TOC可以在一个很高的灵敏度条件下检测总有机碳。TOC分析仪可以检测所有的有机残留,包括培养基和淸洗工艺中的降解物质。由于TOC检测的是所有有机成分,很难区分检测的物质是产品有机残留还是其他有机混合物,所以,TOC方法代表的是“最差情况”;另一方面,在取样和测试的过程中也有可能会引入污染物,所以所有的取样人员必须经过严格的培训并掌握淸洗取样的技术,尤其要注意取样工具不要对检测结果带来干扰。本研究建立的这种非特定方法的优点是灵敏度高、且对多成分化合物有效,缺点是缺乏识別具体分析物的专属性、测定结果可受其他残留物的干扰;文献报道的一些特定方法(高效液相法、滴定法)灵敏度高、能用于相关化合物的定量测定,但其缺点是不能检查更大范围的化合物、研究成本高、结果也可能受残留物干扰[9]。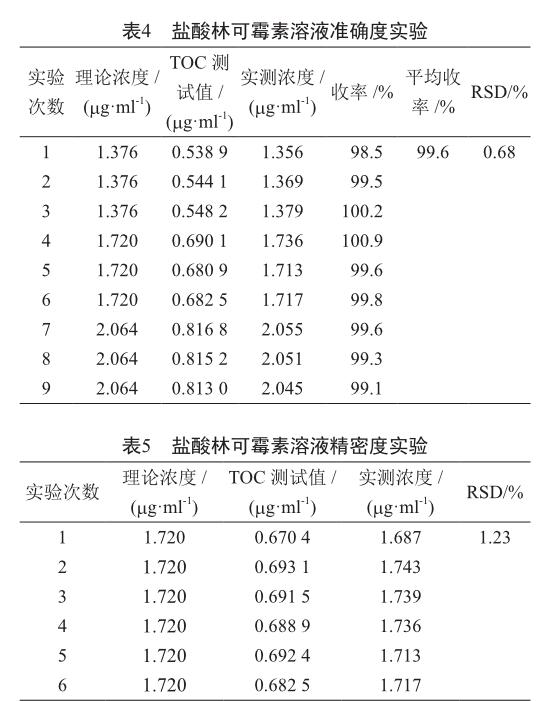
参考文献
[1] 中华人民共和国卫生部令第79号. 药品生产质量管理规范(2010年修订)[EB/OL]. (2011-01-17)[2020-05-19]. http://www.gov.cn/gongbao/content/2011/content_1907093. htm.
[2] 国家食品药品监督管理局药品安全监管司, 药品认证管理中心. 药品生产验证指南[M]. 北京: 化学工业出版社, 2003: 195-208.
[3] 国家药典委员会. 中华人民共和国药典2015年版四部[M]. 北京: 中国医药科技出版社, 2015: 85; 374-377.
[4] 罗佳, 周晓龙, 王春民, 等. 超高效液相-质谱/质谱法测定蜂蜜中的林可霉素残留[J]. 中国卫生检验杂志, 2019, 29(13): 1551-1552; 1563.
[5] 王雅娟. 禽组织、禽蛋及猪肉中大观霉素和林可霉素残留气相色谱-串联质谱检测方法的研究[D]. 扬州: 扬州大学, 2019.
[6] 阮祥春, 曾明华, 赵明. HPLC-ESI-MS/MS检测蜂蜜中林可霉素残留[J]. 安徽农业科学, 2009, 37(5): 1889-1891.
[7] 赵明. 蜂蜜中林可霉素残留检测方法的研究[D]. 合肥: 安徽农业大学, 2008.
[8] Sin DW, Wong YC, Ip AC. Quantitative analysis of lincomycin in animal tissues and bovine milk by liquid chromatography electrospray ionization tandem mass spectrometry[J]. J Pharm Biomed Anal, 2004, 34(3): 651-659.
[9] 何国强. 制药工艺验证实施手册[M]. 北京: 化学工业出版社, 2012: 245.
